1 . 下列物质中,不能由单质直接化合生成的是
| A.CuCl2 | B.FeCl2 | C.HCl | D.AlCl3 |
您最近一年使用:0次
2 . 写成电离方程式。
(1) =
=___________ 。
(2)HNO3=___________ 。
(1)
 =
=(2)HNO3=
您最近一年使用:0次
解题方法
3 . 吡咯他尼是一种利尿药,可用于治疗水肿、高血压症。有机物K是制备吡咯他尼的中间体,K的一种制备流程如图:
(1)A的名称是_______ ,C中官能团有_______ (填名称)。
(2)A→B的反应试剂和条件是_______ ;I→J的反应类型是_______ 。
(3)J→K的反应中,另一种生成物的化学式为_______ ,其分子的立体构型为______ 。
(4)写出H→I的化学方程式:_______ 。
(5)在C的芳香族同分异构体中,能发生银镜反应但不含氧氯键的结构有_______ (不考虑立体异构);其中核磁共振氢谱显示有3组峰且峰面积之比为2∶2∶1的同分异构休的结构简式为_______ 。
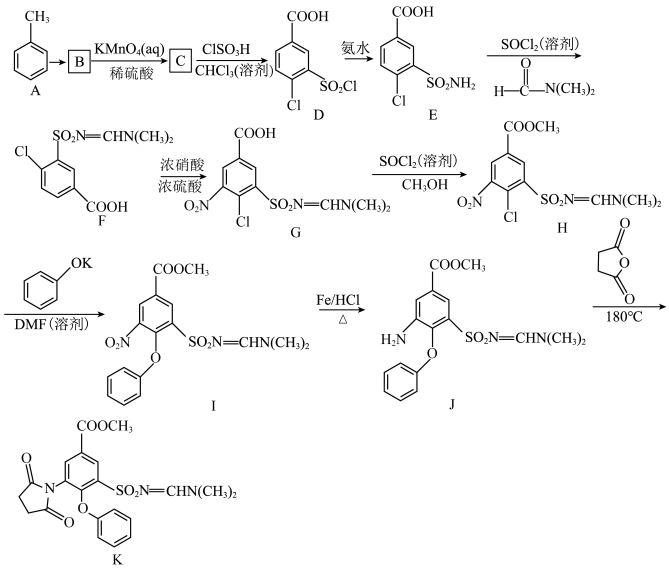
(1)A的名称是
(2)A→B的反应试剂和条件是
(3)J→K的反应中,另一种生成物的化学式为
(4)写出H→I的化学方程式:
(5)在C的芳香族同分异构体中,能发生银镜反应但不含氧氯键的结构有
您最近一年使用:0次
4 . 甲醇和乙醇都是清洁能源,也是重要的化工原料。回答下列问题:
(1)工业上利用合成气合成甲醇:
 ,已知:几种热化学方程式如下:
,已知:几种热化学方程式如下:
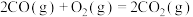
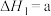 kJ⋅mol
kJ⋅mol

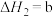 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则上述反应中的
______ kJ⋅mol (用含有a,b,c的式子表示)。
(用含有a,b,c的式子表示)。
(2)一定温度下,在恒容密闭容器中充入1 mol CO和1 mol ,在固体催化剂作用下合成甲醇:
,在固体催化剂作用下合成甲醇: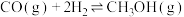 ,下列叙述正确的是_____(填字母)。
,下列叙述正确的是_____(填字母)。
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢: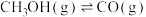
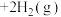 ,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。______ kJ/mol;该反应的决速步为____ (填反应后的序号):总反应经历5步反应中,最大能垒为_____ kJ⋅mol ,写出该步反应式:
,写出该步反应式:________ 。
(4)工业上,可以采用 催化还原制备
催化还原制备 、
、 。发生反应如下:
。发生反应如下:
① (主反应)
(主反应)
② (主反应)
(主反应)
③ (副反应)
(副反应)
一定温度下,在甲、乙体积相同的反应容器中分别充入1 mol 和3 mol
和3 mol  ,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得
,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。 平衡转化率增大,其原因是
平衡转化率增大,其原因是______ ;采用水分子膜分离技术的容器是_____ (填“甲”或“乙”)。
(5)一定温度下,向总压强恒定为100kPa的反应器中充入1 mol 和3 mol
和3 mol  ,发生(4)中反应①②③,达到平衡时
,发生(4)中反应①②③,达到平衡时 转化率为50%,甲醇选择性为
转化率为50%,甲醇选择性为 ,生成0.05 mol
,生成0.05 mol  ,则反应①的平衡常数
,则反应①的平衡常数 为
为______  (写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数
(写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数;甲醇选择性:
,分压=总压×物质的量分数;甲醇选择性: ]。
]。
(1)工业上利用合成气合成甲醇:

 ,已知:几种热化学方程式如下:
,已知:几种热化学方程式如下: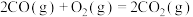
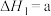 kJ⋅mol
kJ⋅mol

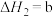 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则上述反应中的

 (用含有a,b,c的式子表示)。
(用含有a,b,c的式子表示)。(2)一定温度下,在恒容密闭容器中充入1 mol CO和1 mol
 ,在固体催化剂作用下合成甲醇:
,在固体催化剂作用下合成甲醇: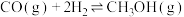 ,下列叙述正确的是_____(填字母)。
,下列叙述正确的是_____(填字母)。A.当 体积分数不变时达到平衡状态 体积分数不变时达到平衡状态 |
| B.平衡后充入少量氩气,平衡向左移动 |
C.平衡后再充入0.1 mol CO和0.1 mol  ,CO平衡转化率增大 ,CO平衡转化率增大 |
| D.平衡后增大催化剂表面积,逆反应速率大于正反应速率 |
(3)甲醇是一种潜在储氢材料。我国学者研究甲醇在钯基催化剂表面上分解制氢:
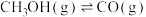
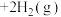 ,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。
,其反应历程如图所示(吸附在催化剂表面的物种用“*”表示)。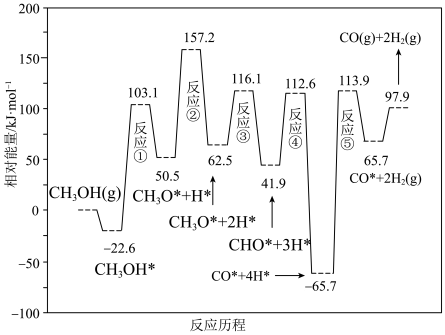
 ,写出该步反应式:
,写出该步反应式:(4)工业上,可以采用
 催化还原制备
催化还原制备 、
、 。发生反应如下:
。发生反应如下:①
 (主反应)
(主反应)②
 (主反应)
(主反应)③
 (副反应)
(副反应)一定温度下,在甲、乙体积相同的反应容器中分别充入1 mol
 和3 mol
和3 mol  ,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得
,发生上述反应,其中一个容器使用水分子膜分离技术,另一个容器不使用水分子膜分离技术。实验测得 平衡转化率与压强关系如图所示。
平衡转化率与压强关系如图所示。
 平衡转化率增大,其原因是
平衡转化率增大,其原因是(5)一定温度下,向总压强恒定为100kPa的反应器中充入1 mol
 和3 mol
和3 mol  ,发生(4)中反应①②③,达到平衡时
,发生(4)中反应①②③,达到平衡时 转化率为50%,甲醇选择性为
转化率为50%,甲醇选择性为 ,生成0.05 mol
,生成0.05 mol  ,则反应①的平衡常数
,则反应①的平衡常数 为
为 (写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数
(写出数字表达式即可)[用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数;甲醇选择性:
,分压=总压×物质的量分数;甲醇选择性: ]。
]。
您最近一年使用:0次
5 . 实验室利用正丁醇为原料,与乙炔、CO发生反应合成有机原料丙烯酸丁酯,其合成原理为: 。
。
| 物质 | 相对分子质量 | 密度/(g·cm ) ) | 沸点/℃ | 部分性质 |
| 正丁醇 | 74 | 0.80 | 117.7 | 易溶于丙酮,易燃 |
| 丙烯酸丁酯 | 128 | 0.89 | 145.7 | 易溶于丙酮,易燃;温度过高时容易自聚生成聚丙烯酸丁酯 |
| 丙酮 | 58 | 0.79 | 56 | 易燃易爆 |
Ⅰ.将50 mL正丁醇、30 mL丙酮以及3 g纳米NiO加入装置甲中;
Ⅱ.使用加热磁力搅拌器加热控制温度在110℃左右;
Ⅲ.将乙和丙中制备的乙炔与CO气体同时缓缓通入装置甲中,加热回流3小时;
Ⅳ.将三颈烧瓶中的液体过滤、减压蒸馏,将得到的粗品再纯化,得到丙烯酸丁酯纯品。
试回答下列问题:
(1)装置A的名称为
(2)纳米NiO的作用是
(3)装置甲中三颈烧瓶的规格为
A.100mL B.200mL C.500mL
(4)使用装置乙可制备
 ,制备乙炔选择饱和食盐水的原因
,制备乙炔选择饱和食盐水的原因(5)装置丙中草酸晶体(
 )分解的化学方程式为
)分解的化学方程式为(6)若最后获得的丙烯酸丁酯纯品的质量为32.0g,则该实验的产率为
您最近一年使用:0次
6 . 利用含钴废料(主要成分为Co、Ni、Mn、Pb以及 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
(1)基态Co原子的价电子原子轨道表达式为_______ 。铂钴合金具有较高的永磁性能,其晶胞如图所示,若A点Pt原子的坐标参数为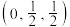 ,则B点Pt原子的坐标参数为
,则B点Pt原子的坐标参数为______ 。_______ 。“酸浸”时 发生反应的总离子方程式为
发生反应的总离子方程式为_______ 。
(3)酸浸后滤渣的主要成分为______ 。
(4)“沉锰”时, 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为:
,则“沉锰”时发生反应的离子方程式为:_______ 。
(5)可以通过电解 溶液获得单质Co和较浓的盐酸,其工作原理如图所示:
溶液获得单质Co和较浓的盐酸,其工作原理如图所示:______ (填“膜a”或者“膜b”)。阴极的电极方程式为:_______ 。
 、
、 等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示:
等)制备碳酸钴和硫酸镍晶体的一种工艺流程如图所示: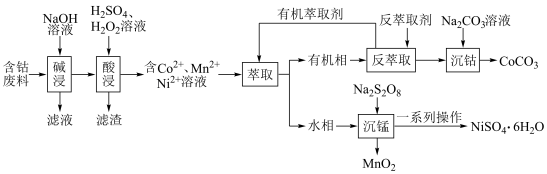
(1)基态Co原子的价电子原子轨道表达式为
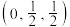 ,则B点Pt原子的坐标参数为
,则B点Pt原子的坐标参数为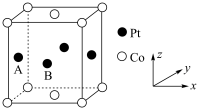
 发生反应的总离子方程式为
发生反应的总离子方程式为(3)酸浸后滤渣的主要成分为
(4)“沉锰”时,
 转化为
转化为 ,则“沉锰”时发生反应的离子方程式为:
,则“沉锰”时发生反应的离子方程式为:(5)可以通过电解
 溶液获得单质Co和较浓的盐酸,其工作原理如图所示:
溶液获得单质Co和较浓的盐酸,其工作原理如图所示: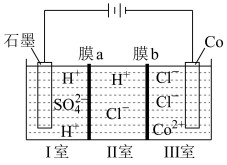
您最近一年使用:0次
7 . 由下列实验操作和现象所得结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向c(Cl-)=c(I-)的KCl、KI混合溶液中逐滴滴入AgNO3溶液 | 先出现黄色沉淀,后出现白色沉淀 |  |
| B | 向淀粉溶液中滴加适量稀硫酸,后加热一段时间停止加热,待溶液恢复室温后加入新制银氨溶液并水浴加热 | 没有出现“银镜” | 淀粉没有水解 |
| C | 向碳酸氢钠溶液中加入浓盐酸,将反应后的气体通入苯酚钠溶液中 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 常温下将铝条插入浓硫酸中,一段时间取出铝条 | 铝条几乎无变化 | 常温下铝条与浓硫酸不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 在碱性溶液中, 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
 与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
与缩二脲形成某种紫色配离子,结构如图所示。下列说法不正确的是
| A.该配离子中非金属元素的电负性大小顺序有O>N>C>H |
| B.该配离子中铜离子的配位数为4 |
C.该配离子中N与C的杂化类型分别为 和 和 |
| D.该配离子存在的化学键类型有离子键、共价键、配位键、氢键 |
您最近一年使用:0次
9 . 建设“美丽中国”离不开化学,下列说法错误的是
| A.铁红可作红色颜料,其属于碱性氧化物 |
| B.用高铁酸钠处理饮用水的过程中没有发生氧化还原反应 |
C.修建道路使用的水泥含熟石膏,其主要成分是 |
| D.建设美丽乡村大量使用钢材,它属于金属材料 |
您最近一年使用:0次
名校
解题方法
10 . 近日,我国科学家开发一款新型钠离子二次电池,工作原理如图所示。已知:钒常见的化合价有+2、+3、+4、+5.放电时最终还原产物为Na2S和Cu,氧化产物为NaV2(PO4)3。下列叙述错误的是
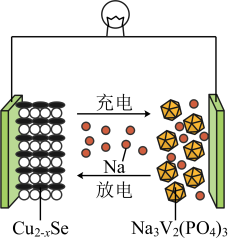
| A.放电时,电池左端为正极 |
B.放电时,负极反应式为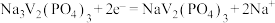 |
| C.充电时,转移2 mol电子时,阴极增重46 g |
D.充电时,总反应可能是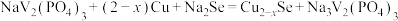 |
您最近一年使用:0次
2024-04-11更新
|
149次组卷
|
2卷引用:新疆维吾尔自治区喀什地区2024届高三4月适应性检测理综-化学试题



