解题方法
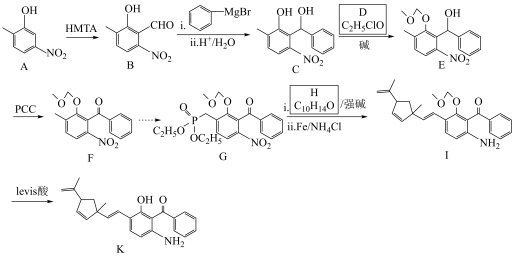
1 . K是一种抗病毒药物的重要中间体,K的一种合成路线如下(部分试剂和条件略去)。
(1)A中官能团的名称为___________ 。
(2)B中碳原子的轨道杂化类型为___________ 。
(3)由C生成E的化学方程式为___________ 。
(4)E→F的反应类型为___________ 。
(5)H的结构简式为___________ 。
(6)K分子中具有孤电子对的原子数目有___________ 个。
(7)在H的同分异构体中,同时满足下列条件的共有___________ 种(不考虑立体异构)。
①含有苯环且苯环上只有一个取代基;
②能与金属钠反应产生 。
。
其中,不含手性碳原子的同分异构体的结构简式为___________ (任写一种)。
已知:.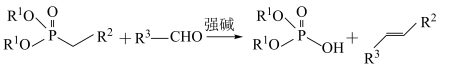
(1)A中官能团的名称为
(2)B中碳原子的轨道杂化类型为
(3)由C生成E的化学方程式为
(4)E→F的反应类型为
(5)H的结构简式为
(6)K分子中具有孤电子对的原子数目有
(7)在H的同分异构体中,同时满足下列条件的共有
①含有苯环且苯环上只有一个取代基;
②能与金属钠反应产生
 。
。其中,不含手性碳原子的同分异构体的结构简式为
您最近一年使用:0次
2 . 已知反应: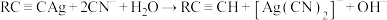 ,该反应可用于提纯炔烃。下列说法错误的是
,该反应可用于提纯炔烃。下列说法错误的是
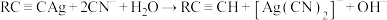 ,该反应可用于提纯炔烃。下列说法错误的是
,该反应可用于提纯炔烃。下列说法错误的是A. 的电子式为 的电子式为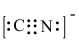 |
B.基态O原子的价电子排布图为 |
C. 的空间填充模型为 的空间填充模型为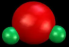 |
D.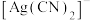 中 中 键与 键与 键的个数比为1:2 键的个数比为1:2 |
您最近一年使用:0次
名校
解题方法
3 . 某同学在实验室模拟工业制备H2SO4,再用制得的浓H2SO4制备C2H4气体,并设计实验检验气体产物。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据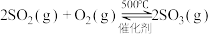 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题:______ ;A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是____________________ 。
②装置D盛放的是______ 溶液,其作用是____________________ 。
③实验开始时的操作顺序为______ 。(选填“a”或“b”)
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:____________________ 。操作中应迅速升温至______ ℃。
(3)反应前在②中放入几块碎瓷片的目的是____________________ 。
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是______ (填序号),原因是____________________ 。
Ⅰ.制备H2SO4的重要一步是制SO3(熔点:16.8℃,沸点:44.8℃)
某同学在实验室中根据
 ,设计如图1所示实验装置来制备SO3固体。回答下列问题:
,设计如图1所示实验装置来制备SO3固体。回答下列问题: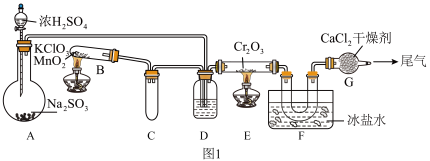
②装置D盛放的是
③实验开始时的操作顺序为
a.先点燃E处的酒精灯后将混合气体通入E。
b.先将混合气体通入E后点燃E处的酒精灯。
Ⅱ.制取乙烯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:

(3)反应前在②中放入几块碎瓷片的目的是
Ⅲ.检验产物
(4)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙烯 |
② | 澄清 | 变浑浊 | 产物含有CO2 |
③ | 通过品红溶液 | 红色褪去 | 产物含有SO2 |
您最近一年使用:0次
名校
4 . 回答下列问题
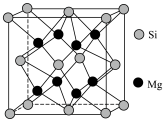
(1)基态Cu的价电子排布式为______ 。 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为______ ,配体为______ ,配位体所含元素中,电负性最大的是______ ,第一电离能最大的元素是______ 。
(2) 中心原子的价层电子对数目为
中心原子的价层电子对数目为______ ;叠氮酸根 的几何构型为
的几何构型为______ 。
(3)对羟基苯甲醛( )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是______ 。
(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):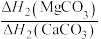
______ 1(选填“>”、“<”或“=”,下同);
②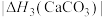
______ 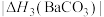 。
。
(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长: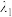
______  (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是______ 。______ 。
②阿伏加德罗常数的值为 ,该晶体的摩尔体积为
,该晶体的摩尔体积为______  (列出计算式)。
(列出计算式)。
(1)基态Cu的价电子排布式为
 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为(2)
 中心原子的价层电子对数目为
中心原子的价层电子对数目为 的几何构型为
的几何构型为(3)对羟基苯甲醛(
 )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):

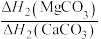
②
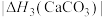
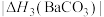 。
。(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
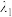
 (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是
②阿伏加德罗常数的值为
 ,该晶体的摩尔体积为
,该晶体的摩尔体积为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如图。
②
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______ 。(任写一种),除铁时溶液的pH值调控范围为:______ 。
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:____________________ 。
(3)常温下“除铁”时加入的试剂A可用______ ,若加A后溶液的pH调为5,则溶液中 的浓度为
的浓度为______  。
。
(4)沉锰的离子方程式为:____________________ 。滤液Ⅱ经蒸发结晶得到的盐主要是______ 。(写化学式)
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是______ 。
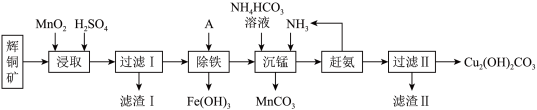
金属离子 |
|
|
|
|
开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |

(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有
(2)滤渣Ⅰ中的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S单质的离子方程式:
(3)常温下“除铁”时加入的试剂A可用
 的浓度为
的浓度为 。
。(4)沉锰的离子方程式为:
(5)过滤Ⅱ得到的沉淀经过洗涤、干燥可以得到碱式碳酸铜,判断沉淀是否洗净的操作是
您最近一年使用:0次
名校
6 . 利用CH4与CO2进行催化重整,对温室气体的减排具有重要意义,催化重整时发生的反应: ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
(1)已知: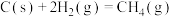
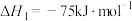
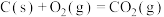
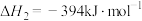
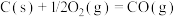
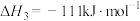
催化重整反应 的
的
______  。
。
(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为______ ;用H2表示的反应速率为______  。
。
(3)已知:常温下CH3COOH的电离常数 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、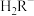 、
、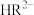 、
、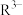 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显______ 性(选填“酸”或“碱”或“中”),常温下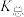 的数量级为
的数量级为______ 。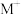 (
(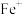 、
、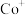 、
、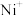 等)与O3反应可得
等)与O3反应可得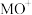 。
。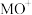 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: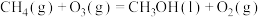 ;
;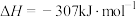 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应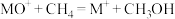 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是______ (填“a”或“b”)。300K、60 s时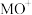 的转化率为
的转化率为______ (列出算式)。 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(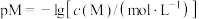 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
______ 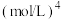 。
。
 ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:(1)已知:
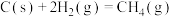
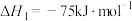
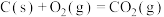
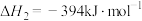
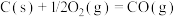
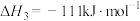
催化重整反应
 的
的
 。
。(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生
 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为 。
。(3)已知:常温下CH3COOH的电离常数
 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、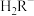 、
、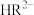 、
、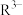 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显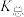 的数量级为
的数量级为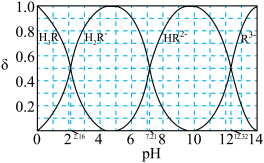
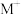 (
(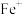 、
、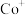 、
、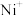 等)与O3反应可得
等)与O3反应可得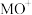 。
。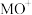 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: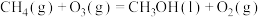 ;
;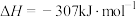 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应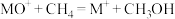 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是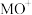 的转化率为
的转化率为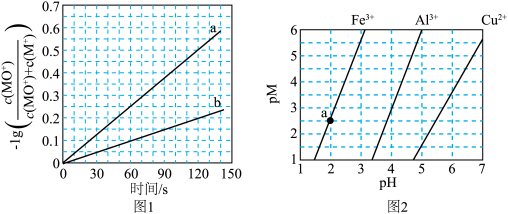
 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(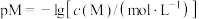 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
 。
。
您最近一年使用:0次
名校
7 . 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
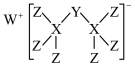
| A.WZ属于离子化合物,其水溶液呈碱性,图中阴离子含非极性键 |
| B.元素X、Y、Z的非金属性顺序为:X>Y>Z |
| C.Y的最高价氧化物的水化物是强酸 |
| D.该化合物中Y原子的价层满足8电子稳定结构 |
您最近一年使用:0次
名校
8 . 图(Ⅰ)和图(Ⅱ)分别为二元酸H2A和乙二胺(H2NCH2CH2NH2)溶液中各微粒的百分含量δ(即物质的量百分数)随溶液pH的变化曲线(25℃)。下列说法正确的是

| A.[H3NCH2CH2NH3]A溶液显碱性 |
B.[H3NCH2CH2NH2]HA溶液中存在关系式: 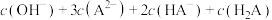 |
C.[H3NCH2CH2NH2][HA]溶液中各离子浓度大小关系为: |
D.向[H3NCH2CH2NH2][HA]溶液中通入一定量的HCl气体,则 可能增大也可能减小 可能增大也可能减小 |
您最近一年使用:0次
9 . 三氯化六氨合钴(Ⅲ) 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备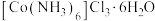 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: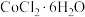 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。
III.经过“一系列”操作,得到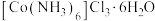 晶体。
晶体。
已知:① 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。
②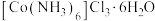 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于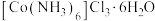 晶体析出。
晶体析出。
回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为___________ , 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是___________ 。
(2)步骤II中加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ ,向三颈烧瓶中先滴加氨水后滴加 溶液的原因是
溶液的原因是___________ 。
(3)稀盐酸可将吸附在活性炭上的 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入___________ 溶解,趁热过滤,冷却后向滤液中加入少量___________ ,边加边搅拌,充分静置后过滤,用___________ 洗涤2~3次,低温干燥。(可选用试剂:稀盐酸、浓盐酸、无水乙醇)
(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为___________ ,产品中钴元素的质量分数为___________ 。(已知: 、
、 )
)
 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备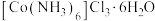 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: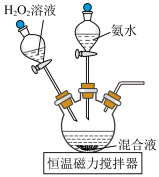
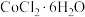 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入
 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。III.经过“一系列”操作,得到
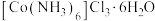 晶体。
晶体。已知:①
 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。②
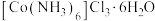 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于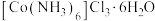 晶体析出。
晶体析出。回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为
 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是(2)步骤II中加入
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为 溶液的原因是
溶液的原因是(3)稀盐酸可将吸附在活性炭上的
 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量
 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为 、
、 )
)
您最近一年使用:0次
名校
解题方法
10 . 一种制备 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数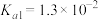 ,
,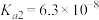 。下列说法正确的是
。下列说法正确的是
 的工艺路线如图所示,反应
的工艺路线如图所示,反应 所得溶液pH在3~4之间,反应
所得溶液pH在3~4之间,反应 需及时补加
需及时补加 以保持反应在
以保持反应在 条件下进行。常温下,
条件下进行。常温下, 的电离平衡常数
的电离平衡常数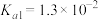 ,
,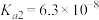 。下列说法正确的是
。下列说法正确的是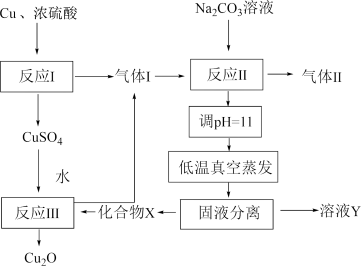
A.反应 、 、 、 、 均为氧化还原反应 均为氧化还原反应 |
B.低温真空蒸发主要目的是防止 被氧化 被氧化 |
C.溶液Y可循环用于反应 所在操作单元吸收气体 所在操作单元吸收气体 |
D.若 产量不变,参与反应 产量不变,参与反应 的X与 的X与 物质的量之比 物质的量之比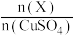 增大时,需补加 增大时,需补加 的量增多 的量增多 |
您最近一年使用:0次
2024-06-10更新
|
103次组卷
|
4卷引用:北京市第二中学2023-2024学年高三下学期三模化学试题

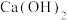 溶液
溶液




