名校
1 . 将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3 mol·L−1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。下列叙述不正确 的是
| A.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| B.参加反应的金属的总质量3.6g<m<9.6g |
| C.当生成的沉淀量达到最大时,消耗NaOH溶液的体积一定为V=100mL |
| D.当金属全部溶解时收集到NO气体的体积在标准状况下为2.24L |
您最近一年使用:0次
2016-12-09更新
|
2466次组卷
|
11卷引用:辽宁省部分中学2019-2020高一下学期期末考试化学试题
辽宁省部分中学2019-2020高一下学期期末考试化学试题2016届陕西省西藏民族学院附属中学高三上期末化学试卷2017届湖南省长株潭岳益五市十校高三12月联考化学卷2017届福建省漳州市八校高三上学期期末联考化学试卷(已下线)2019年1月24日《每日一题》二轮复习—— 氮的氧化物、硝酸的性质及应用(已下线)2019年4月17日 《每日一题》三轮复习-其他金属及其化合物【全国百强校】云南省曲靖市第一中学2018-2019学年高一下学期期中考试化学试题安徽省安庆市怀宁县怀宁中学2021届高三年级第一次质量检测化学试题江西省南昌市莲塘一中2021届高三上学期11月月考化学试题江西省上高二中2022届高三第二次月考化学试卷河北省张家口市宣化第一中学2021-2022学年高三上学期12月月考化学试题
名校
2 . 在一定浓度的浓硝酸中加入m克铜镁合金恰好完全溶解(假定硝酸的还原产物只有NO2),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,恰好完全反应,得到沉淀质量为n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中 的物质的量为bV mol
的物质的量为bV mol
③反应过程中转移的电子数为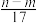 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L
⑤与合金反应的硝酸的物质的量为 mol
mol
①沉淀中氢氧根的质量为(n−m)克 ②恰好溶解后溶液中
 的物质的量为bV mol
的物质的量为bV mol③反应过程中转移的电子数为
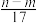 mol ④生成NO2气体的体积为
mol ④生成NO2气体的体积为 L
L⑤与合金反应的硝酸的物质的量为
 mol
mol| A.①②③④⑤ | B.①③④⑤ |
| C.①③⑤ | D.①②③⑤ |
您最近一年使用:0次
2016-12-09更新
|
2383次组卷
|
4卷引用:辽宁省部分中学2019-2020高一下学期期末考试化学试题
辽宁省部分中学2019-2020高一下学期期末考试化学试题2016届山东省济宁市第一中学高三上学期期中考试化学试卷(已下线)《2018,我的高考我的教师君》-【考前基础篇】高考化学必会知识大盘点江西师范大学附属中学2020-2021学年高一下学期4月月考化学试题
名校
解题方法
3 . 将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。则原混合物中单质铁的质量是
| A.2.4g | B.3.36g | C.5.60g | D.10.08g |
您最近一年使用:0次
2016-12-09更新
|
2789次组卷
|
7卷引用:辽宁省实验中学2021-2022学年高一上学期12月月考化学试题
辽宁省实验中学2021-2022学年高一上学期12月月考化学试题2014-2015四川省遂宁市射洪中学高一下学期第一次月考化学试卷2016届吉林省长春市第十一高中高三上学期期中测试化学试卷2016届湖南长沙市长郡中学三上学期第四次月考化学试卷江苏省启东中学2016-2017学年高一(创新班)下学期期中考试化学试题江苏省连云港市锦屏高级中学2016-2017学年高二上学期期中考试化学试题(已下线)3.1.2 铁盐和亚铁盐-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
4 . 从辉铜矿(Cu2S)中利用火法炼铜可以提取铜,发生如下反应:
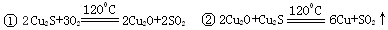
下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
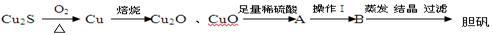
⑴Cu2S中铜元素的化合价为__ ,当有1molCu2S与O2反应生成2molCu时,转移电子的物质的量是_________ 。
⑵Cu2O、CuO中加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式______________________________________________ 。
⑶若使A中单质溶解,操作Ⅰ中加入的试剂最好是_______ 。(选填字母代号)
A.适量的HNO3B.适量的NaOH C.适量的H2O2
该反应的离子方程式为_________________________________ 。
⑷取5.00 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:

①由图中可以看出,胆矾分解的最低温度是_______ 。
②通过计算确定258℃时发生反应的化学方程式为__________________________________ ,e点对应的化学式为_________ (计算过程略去)。
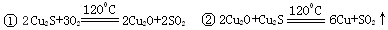
下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
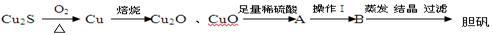
⑴Cu2S中铜元素的化合价为
⑵Cu2O、CuO中加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式
⑶若使A中单质溶解,操作Ⅰ中加入的试剂最好是
A.适量的HNO3B.适量的NaOH C.适量的H2O2
该反应的离子方程式为
⑷取5.00 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:

①由图中可以看出,胆矾分解的最低温度是
②通过计算确定258℃时发生反应的化学方程式为
您最近一年使用:0次
名校
5 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3617次组卷
|
21卷引用:2016届辽宁省沈阳市第二中学高三10月月考化学试卷
2016届辽宁省沈阳市第二中学高三10月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷辽宁省实验中学2022-2023学年高三上学期期中考试化学试题2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密四川省广安市第二中学2019届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题
解题方法
6 . 硼氢化钠(NaBH4)为白色粉末,容易吸水潮解,可溶于异丙胺(熔点:-101℃,沸点:33℃),在干空气中稳定,在湿空气中分解,是无机合成和有机合成中常用的选择性还原剂.某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
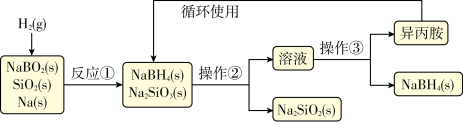
下列说法不正确的是( )

下列说法不正确的是( )
| A.实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 |
| B.操作②、操作③分别是过滤与蒸发结晶 |
| C.反应①加料之前需将反应器加热至100℃以上并通入氩气 |
| D.反应①中氧化剂与还原剂的物质的量之比为1:2 |
您最近一年使用:0次
2016-07-12更新
|
1213次组卷
|
7卷引用:2017届辽宁省东北育才学校高三上学期第一次模拟化学试卷
解题方法
7 . 某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:(已知乳酸酸性强于碳酸)
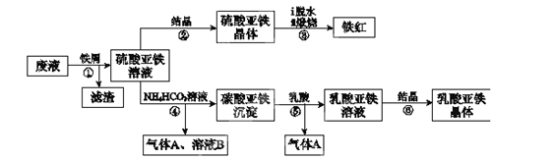
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O →TiO2 • xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为____________________ ,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是____________________ ;步骤②中得到纯净硫酸亚铁晶体的操作为蒸发浓缩、____________________ 。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________ 。
(3)步骤④的离子方程式是____________________ 。
(4)试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因:____________________ 。
(5)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品a g,配成500.00 mL溶液,取出25.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1KMnO4溶液25.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)____________________ 。

已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O →TiO2 • xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(3)步骤④的离子方程式是
(4)试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因:
(5)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品a g,配成500.00 mL溶液,取出25.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1KMnO4溶液25.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
您最近一年使用:0次



