名校
解题方法
1 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中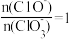 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2070次组卷
|
12卷引用:甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题
甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
2 . 电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:
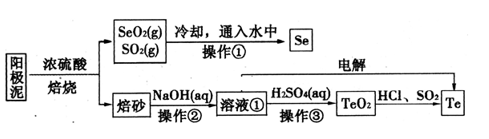
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为_____________________________ 操作①的名称为__________ 。
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______ 。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为___________________________ 。
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是_________________________________ 。
(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________ 。

已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是

(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为
您最近一年使用:0次
2019-01-22更新
|
1280次组卷
|
3卷引用:【校级联考】甘肃省宁县2019届高三上学期期末联考化学试题
名校
3 . A2、B2、C23种单质和它们离子间能发生下列反应2A- + C2 = 2C- + A2、2C- + B2 = 2B- + C2。若X-能与C2发生反应2X- + C2 = 2C- + X2有关说法中不正确的是( )
| A.氧化性B2>C2>A2 | B.还原性X->C->B- |
| C.X2与B-能发生反应 | D.B2与X-能发生反应 |
您最近一年使用:0次
2017-11-16更新
|
144次组卷
|
4卷引用:甘肃省武威第一中学2019-2020学年高一上学期期中考试化学试题
解题方法
4 . 铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为______________________ ;高铁酸钠能用作新型净水剂的原理是____________________________ ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
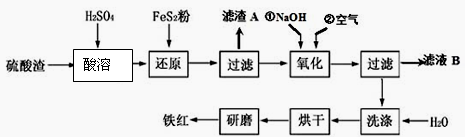
①酸溶过程中发生反应的化学方程式为___________ ,_____________ ,___________ ;“滤渣A”主要成分的化学式为_____________________ 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式_______________________________ ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为_____________ 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是____________ ,
如果pH过大,可能引起的后果是_____________________ 。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

①酸溶过程中发生反应的化学方程式为
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是
您最近一年使用:0次
2016-12-09更新
|
986次组卷
|
2卷引用:2016届甘肃省会宁一中高三上学期第四次月考理综化学试卷
名校
解题方法
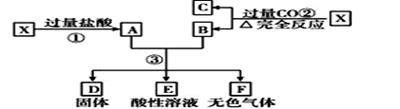
5 . 已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D 的质量为32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为

| A.4:1 | B.1:2 | C.2:1 | D.1:1 |
您最近一年使用:0次
名校
6 . 钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
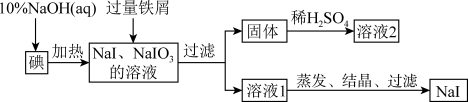
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
2016-12-09更新
|
913次组卷
|
6卷引用:2016届甘肃省天水一中高三上学期期末理综化学试卷
7 . 汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:
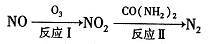
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是___ mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为_____
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为____ 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是 、
、 ,请写出生成等物质的量的
,请写出生成等物质的量的 和
和 时的离子方程式
时的离子方程式____________________________________ .
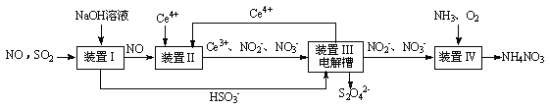
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的______ (填“阳极”或“阴极”),同时在另一极生成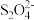 的电极反应式为
的电极反应式为_____________________ 。
(5)已知进入装置Ⅳ的溶液中, 的浓度为ag.L-1,要使1m3该溶液中的
的浓度为ag.L-1,要使1m3该溶液中的 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____________________ L(用含a代数式表示,结果保留整数)。
(1)氧化一还原法消除NOx的转化如下:
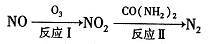
①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是
 、
、 ,请写出生成等物质的量的
,请写出生成等物质的量的 和
和 时的离子方程式
时的离子方程式
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的
 的电极反应式为
的电极反应式为(5)已知进入装置Ⅳ的溶液中,
 的浓度为ag.L-1,要使1m3该溶液中的
的浓度为ag.L-1,要使1m3该溶液中的 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气
完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气
您最近一年使用:0次
13-14高三·湖南长沙·阶段练习
解题方法
8 . X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
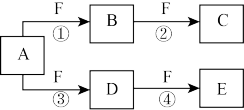
回答下列问题:
(1)A的电子式为______ 。
(2)A和E反应生成G,C与G中都含有______ (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为______ mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:______ 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:______ 。

回答下列问题:
(1)A的电子式为
(2)A和E反应生成G,C与G中都含有
(3)反应③中如果转移的电子为3 mol,则被氧化的A为
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO
 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
您最近一年使用:0次
名校
9 . 向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
| A.Fe2O3与FeO的物质的量之比为1∶6 |
| B.硝酸的物质的量浓度为3.0 mol/L |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2016-11-17更新
|
3600次组卷
|
21卷引用:甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题
甘肃省天水市第一中学2017-2018学年度上学期高三第三阶段考试化学试题甘肃省天水市一中2018届高三上学期第三学段考试化学试题2016届辽宁省沈阳市第二中学高三10月月考化学试卷2016届湖南省衡阳市第八中学高三上学期第三次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷2017届辽宁省瓦房店市高级中学高三上10月月考化学试卷四川省眉山中学2018届高三10月月考理科综合化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)《2018,我的高考我的教师君》-【临考技能篇】速解高考题——高考化学题型分类技巧指导(已下线)解密03 氧化还原反应——备战2018年高考化学之高频考点解密四川省广安市第二中学2019届高三上学期第一次月考化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)2019年1月16日 《每日一题》高考二轮复习-铁及其化合物湖南省长沙市雅礼中学2020-2021学年高一下学期期中考试化学试题浙江省台州市书生中学2021-2022学年高一下学期阶段性测试(3月)化学试题湖南省邵阳市第二中学2021-2022学年高一下学期期中考试化学试题湖南省邵东市第一中学2021-2022学年高一下学期第三次月考化学试题辽宁省实验中学2022-2023学年高三上学期期中考试化学试题江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题河南省周口市太康县第一高级中学2023-2024学年高一下学期4月第三次月考化学试题



