解题方法
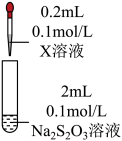
1 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应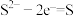 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
| 向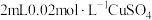 溶液中加入 溶液中加入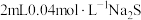 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
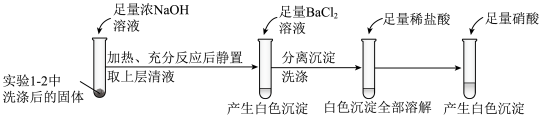
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 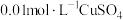 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 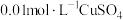 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 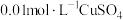 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
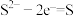 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
2 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.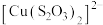 (淡绿色)、
(淡绿色)、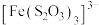 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+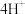
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
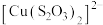 (淡绿色)、
(淡绿色)、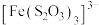 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+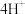
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。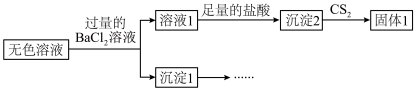
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
名校
解题方法
3 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
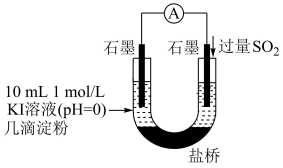
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
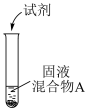
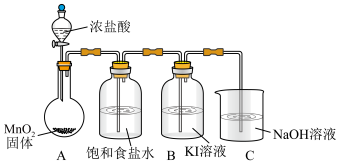
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
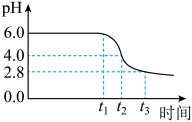
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
335次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
解题方法
5 . 小组同学探究 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。
实验:向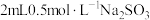 溶液中加入
溶液中加入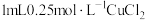 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。
已知:i.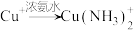 (无色)
(无色)
ii.
(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是 ,试剂X是
,试剂X是_______ 。
②无色溶液在空气中放置变为深蓝色,反应的离子方程式为_______ 。
(2)经检验,沉淀A不含 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。

①仅通过上述实验不能证明沉淀A中含有 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是_______ 。
②无色溶液中含有 ,推测
,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验过程中 氧化
氧化 ;
;
途径2:_______ (将途径补充完整)。
经研究,途径1不合理,途径2合理。
③解释 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:_______ 。
(3) 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是_______ 。用 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
(4)根据上述实验所得结论:_______ (答出两点)。
 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。实验:向
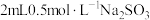 溶液中加入
溶液中加入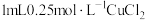 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。已知:i.
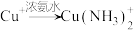 (无色)
(无色)ii.

(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是
 ,试剂X是
,试剂X是②无色溶液在空气中放置变为深蓝色,反应的离子方程式为
(2)经检验,沉淀A不含
 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
①仅通过上述实验不能证明沉淀A中含有
 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是②无色溶液中含有
 ,推测
,推测 的产生有两个途径:
的产生有两个途径:途径1:实验过程中
 氧化
氧化 ;
;途径2:
经研究,途径1不合理,途径2合理。
③解释
 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:(3)
 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。(4)根据上述实验所得结论:
您最近一年使用:0次
解题方法
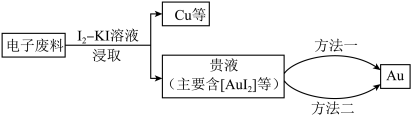
6 . 研究从电子废料(含金属铜和金)中回收金,主要过程如下。
已知: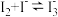 ;相同条件下,
;相同条件下, 与
与 的氧化性相近。
的氧化性相近。
(1)浸出 的离子方程式是
的离子方程式是___________ 。
(2)饱和碘水不能单独浸出 ,但是
,但是 溶液可以浸出
溶液可以浸出 ,原因有:
,原因有:
ⅰ. 在
在 溶液中的溶解度大,体系的氧化性强;
溶液中的溶解度大,体系的氧化性强;
ii.___________ 。
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是___________ 。
(4)方法一:用 还原。写出析出
还原。写出析出 的离子方程式:
的离子方程式:___________ 。
(5)方法二:用惰性电极电解,装置示意图如下。
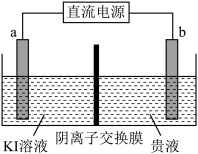
①___________ (填“a”或“b”)接电源的负极。
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是___________ 。
(6)与方法一对比:
①方法二的优点是___________ ;
②方法二的缺点是金的纯度较低,可用___________ (填试剂)进一步纯化。

已知:
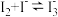 ;相同条件下,
;相同条件下, 与
与 的氧化性相近。
的氧化性相近。(1)浸出
 的离子方程式是
的离子方程式是(2)饱和碘水不能单独浸出
 ,但是
,但是 溶液可以浸出
溶液可以浸出 ,原因有:
,原因有:ⅰ.
 在
在 溶液中的溶解度大,体系的氧化性强;
溶液中的溶解度大,体系的氧化性强;ii.
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是
(4)方法一:用
 还原。写出析出
还原。写出析出 的离子方程式:
的离子方程式:(5)方法二:用惰性电极电解,装置示意图如下。

①
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是
(6)与方法一对比:
①方法二的优点是
②方法二的缺点是金的纯度较低,可用
您最近一年使用:0次
名校
解题方法
7 . 高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: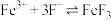
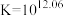

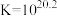
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的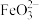 。此过程的反应为
。此过程的反应为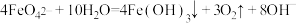 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中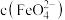 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
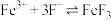
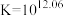

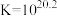
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的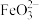 。此过程的反应为
。此过程的反应为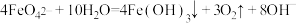 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
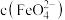 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
2023-05-07更新
|
575次组卷
|
2卷引用:北京市昌平区2023届高三下学期第二次统一练习化学试题
名校
8 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [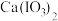 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,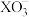 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
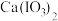 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热固底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
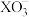 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
817次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一下学期期中考试化学试题
解题方法
9 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: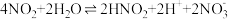
第二步: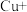 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 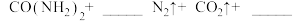 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约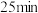 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
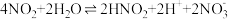
第二步:
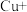 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 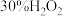 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
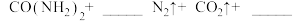 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
名校
10 . 具有十八面体结构的 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
I.配位-沉淀法制备 高效光催化剂
高效光催化剂

已知:ⅰ. 难溶于水,可溶于硝酸;
难溶于水,可溶于硝酸;
ⅱ. 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
ⅲ.银氨溶液中存在: 。
。
(1)配制银氨溶液时的反应现象是_______ 。
(2)加入 制备
制备 的离子反应方程式是
的离子反应方程式是_______ 。
(3) 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因:
固体光催化性能极差。从速率角度解释其原因:_______ 。
Ⅱ. 光催化剂的使用和再生
光催化剂的使用和再生
已知: 晶体在光照条件下发挥催化作用时,首先引发以下反应。
晶体在光照条件下发挥催化作用时,首先引发以下反应。
a.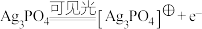
(4) 光催化
光催化 制备甲醇可实现“碳中和”,a的后续反应如下。
制备甲醇可实现“碳中和”,a的后续反应如下。
 ,
,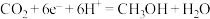
则由 制备甲醇的总反应的化学方程式为
制备甲醇的总反应的化学方程式为_______ 。
(5) 光催化降解
光催化降解 (代表有机污染物),
(代表有机污染物), 被氧化成
被氧化成 和
和 。a的后续反应如下。
。a的后续反应如下。
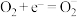 ,
,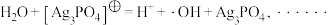
注: 在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
用 依次降解三份相同的废水,测得3次降解过程中
依次降解三份相同的废水,测得3次降解过程中 的残留率(
的残留率(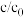 ,即时浓度与起始浓度之比)随时间变化的曲线如图。
,即时浓度与起始浓度之比)随时间变化的曲线如图。

①下列说法正确的是_______ (填字母序号)。
a. 和
和 是降解
是降解 的重要氧化剂
的重要氧化剂
b.第1次使用后 的光催化性能降低
的光催化性能降低
c.该实验条件下, 使用两次即基本失效
使用两次即基本失效
②第1次光降解时,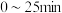 内的反应速率为
内的反应速率为_______  。(废水中
。(废水中 初始浓度
初始浓度 为
为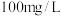 ,
, 的摩尔质量为
的摩尔质量为 )
)
 晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。
晶体是一种高效光催化剂,可用于实现“碳中和”,也可用于降解有机污染物。I.配位-沉淀法制备
 高效光催化剂
高效光催化剂
已知:ⅰ.
 难溶于水,可溶于硝酸;
难溶于水,可溶于硝酸;ⅱ.
 沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;
沉淀的生成速率会影响其结构和形貌,从而影响其光催化性能;ⅲ.银氨溶液中存在:
 。
。(1)配制银氨溶液时的反应现象是
(2)加入
 制备
制备 的离子反应方程式是
的离子反应方程式是(3)
 和
和 在溶液中反应也可制得
在溶液中反应也可制得 固体,但制得的
固体,但制得的 固体光催化性能极差。从速率角度解释其原因:
固体光催化性能极差。从速率角度解释其原因:Ⅱ.
 光催化剂的使用和再生
光催化剂的使用和再生已知:
 晶体在光照条件下发挥催化作用时,首先引发以下反应。
晶体在光照条件下发挥催化作用时,首先引发以下反应。a.
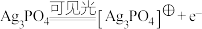
(4)
 光催化
光催化 制备甲醇可实现“碳中和”,a的后续反应如下。
制备甲醇可实现“碳中和”,a的后续反应如下。 ,
,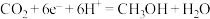
则由
 制备甲醇的总反应的化学方程式为
制备甲醇的总反应的化学方程式为(5)
 光催化降解
光催化降解 (代表有机污染物),
(代表有机污染物), 被氧化成
被氧化成 和
和 。a的后续反应如下。
。a的后续反应如下。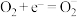 ,
,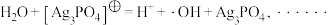
注:
 在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。
在该催化过程中可能发生光腐蚀,生成单质银,影响其光催化性能。用
 依次降解三份相同的废水,测得3次降解过程中
依次降解三份相同的废水,测得3次降解过程中 的残留率(
的残留率(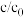 ,即时浓度与起始浓度之比)随时间变化的曲线如图。
,即时浓度与起始浓度之比)随时间变化的曲线如图。
①下列说法正确的是
a.
 和
和 是降解
是降解 的重要氧化剂
的重要氧化剂b.第1次使用后
 的光催化性能降低
的光催化性能降低c.该实验条件下,
 使用两次即基本失效
使用两次即基本失效②第1次光降解时,
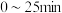 内的反应速率为
内的反应速率为 。(废水中
。(废水中 初始浓度
初始浓度 为
为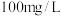 ,
, 的摩尔质量为
的摩尔质量为 )
)
您最近一年使用:0次