名校
解题方法
1 . 二氟草酸硼酸锂(LiBF2C2O4)热稳定性好,在较宽的温度范围内具有良好的离子电导率,对水分不敏感,被认为是最有希望取代六氟磷酸锂的电解质锂盐。由锂精矿(主要成分有LiAlSi2O6还含有少量Fe2+等离子)制备LiBF2C2O4的工艺如下。
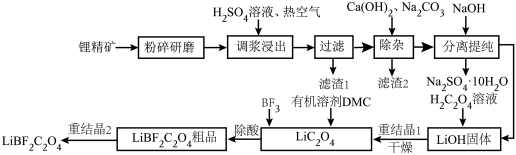
回答下列问题:
(1)调浆浸出时通入热空气的作用是___________ (用离子方程式表示)。
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为___________ ,滤渣2的主要成分是CaCO3和___________ (填化学式)。
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液___________ 、___________ (填简要操作),得到LiOH固体。
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
①一般认为BF3和Li2C2O4反应分两步进行:
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:___________ Ea2
请补齐第二步反应,并判断两步反应的活化能Ea1___________ (填“>”或“<”)Ea2。
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=___________ 。
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是___________ 。
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:_____ 。
Li+[ _____ ]。

回答下列问题:
(1)调浆浸出时通入热空气的作用是
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
| n(BF3):n(Li2C2O4) | 产物组成 |
| 0.5 1.0 1.5 2.0 2.5 | LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4 LiBF2C2O4、LiBF4 |
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:
请补齐第二步反应,并判断两步反应的活化能Ea1
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:
Li+[ _____ ]。
您最近一年使用:0次
2023-05-17更新
|
593次组卷
|
3卷引用:湖北省华大新高考联盟2023届高三4月二模教学质量测评化学试题
名校
2 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了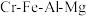 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
(5)工序③也可以利用电解法制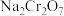 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备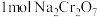 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
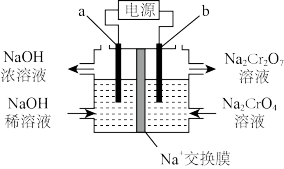
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于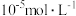 为恰好沉淀完全;已知
为恰好沉淀完全;已知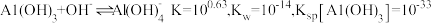 )
)
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
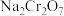 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的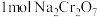 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为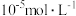 为恰好沉淀完全;已知
为恰好沉淀完全;已知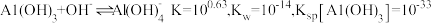 )
)
您最近一年使用:0次
名校
3 . 将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。下列说法正确的是
)。下列说法正确的是
 的体积和剩余金属的质量如下表(设硝酸的还原产物只有
的体积和剩余金属的质量如下表(设硝酸的还原产物只有 )。下列说法正确的是
)。下列说法正确的是| 编号 | ① | ② | ③ | ④ |
| 硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.6 | 9.6 | 0 | 0 |
| NO体积/L | 2.24 | 4.48 | 6.72 | V |
A.①中溶液存在 | B.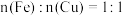 |
C.硝酸的浓度为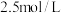 | D.④中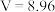 |
您最近一年使用:0次
2022-05-03更新
|
1508次组卷
|
3卷引用:湖北省六校新高考联盟2021-2022学年高一下学期4月联考化学试题
名校
解题方法
4 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
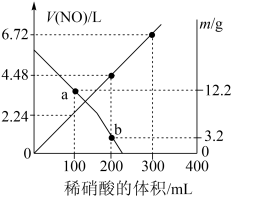

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3550次组卷
|
14卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
5 . 向稀硫酸和稀硝酸的混合溶液200mL中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知硝酸只被还原为NO气体)。下列分析错误的是
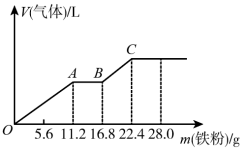

| A.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生H2 |
| B.A点溶液中的溶质为FeSO4和H2SO4 |
C.原混合酸中NO 和SO 和SO 物质的量之比为2:1 物质的量之比为2:1 |
| D.原混合酸中H2SO4的物质的量浓度为2mol·L-1 |
您最近一年使用:0次
2022-03-20更新
|
1718次组卷
|
3卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
名校
解题方法
6 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1080次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
名校
7 . 酸性废水中的砷元素主要以亚砷酸(H3AsO3)形式存在。已知As2S3难溶于水,也不溶于稀硫酸、稀盐酸等无机酸。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为_______ 。
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=_______ 。[Ksp(As2S3)=4.0×10-38]。
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是_______ 。
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
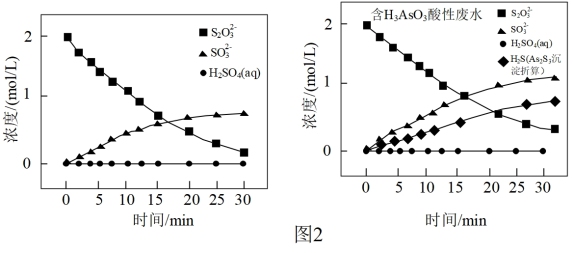
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为________ (图中“HS·”为自由基,“·”表示孤单电子)。
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是_______ 。
(1)工业上采用硫化法(通常用Na2S)去除废水中的砷。
①向酸性废水中加入Na2S,产生的H2S与H3ASO3反应生成As2S3的化学方程式为
②沉淀后,若废水中c(S2-)=1.0×10-4mol·L-1,则c(As3+)=
③为了防止As2S3与过量的S2-形成络合离子而溶解,通常需添加适量的FeSO4溶液,形成FeS,与As2S3共沉淀。验证沉淀中含有FeS的实验方法是
(2)用硫代硫酸钠(Na2S2O3)替代Na2S处理含砷酸性废水可避免H2S污染。
①Na2S2O3去除酸性废水中H3AsO3的反应机理如图1所示,S2O
 经过“途径I”的除砷过程可描述为
经过“途径I”的除砷过程可描述为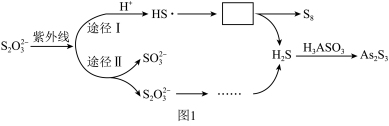
②其他条件相同时,在紫外线照射下,将Na2S2O3分别加入到不含H3AsO3的酸性废水和含H3AsO3的酸性废水中,监测到反应过程中部分物质的浓度变化如图2所示,发现均不释放H2S,其原因是

您最近一年使用:0次
2021-03-27更新
|
1480次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
解题方法
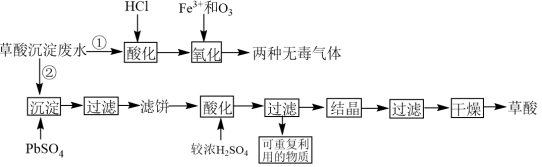
8 . 稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
您最近一年使用:0次
名校
解题方法
9 . 常温下,向1L 1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
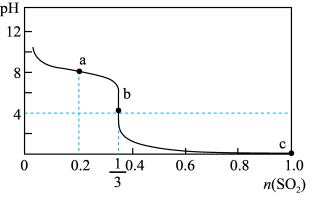

| A.常温下,HClO电离平衡常数的数量级为10﹣8 |
| B.a点溶液中存在 4c(Cl-)=c(HClO)+c(ClO-) |
C.b点溶液中存在c(Na+)>c(SO )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
| D.c点溶液中c(H+)=2mol/L |
您最近一年使用:0次
2020-11-12更新
|
1721次组卷
|
5卷引用:湖北省武汉市华中师大第一附中高考化学押题试卷
名校
10 . 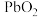 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的 和
和 价的混合氧化物,
价的混合氧化物, 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成 ,
, 价的Pb还原成
价的Pb还原成 价的Pb;现将
价的Pb;现将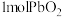 加热分解得到
加热分解得到 ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到 ,
, 和
和 的物质的量之比为
的物质的量之比为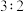 ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是
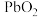 是褐色固体,受热分解为Pb的
是褐色固体,受热分解为Pb的 和
和 价的混合氧化物,
价的混合氧化物, 价的Pb能氧化浓盐酸生成
价的Pb能氧化浓盐酸生成 ,
, 价的Pb还原成
价的Pb还原成 价的Pb;现将
价的Pb;现将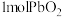 加热分解得到
加热分解得到 ,向剩余固体中加入足量的浓盐酸得到
,向剩余固体中加入足量的浓盐酸得到 ,
, 和
和 的物质的量之比为
的物质的量之比为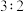 ,则剩余固体的组成及物质的量比是
,则剩余固体的组成及物质的量比是A. 混合的 混合的 、 、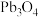 | B.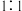 混合的 混合的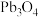 、PbO 、PbO |
C.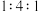 混合的 混合的 、 、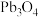 、PbO 、PbO | D.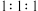 混合的 混合的 、 、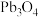 、PbO 、PbO |
您最近一年使用:0次
2020-02-06更新
|
1458次组卷
|
5卷引用:湖北省武汉市华中师范大学第一附属中学2022-2023学年高一下学期4月期中考试化学试题



