1 . 某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:
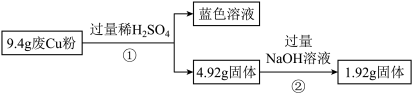
(1)废Cu粉中一定含有的杂质是________ (填化学式)。
(2)写出过程②发生反应的离子方程式:_____________ 。
过程Ⅱ:
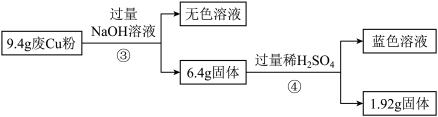
(3)综合过程Ⅰ、Ⅱ,计算废Cu粉中各成分的质量之比是_______ (化为最简整数比)
过程Ⅲ:已知25℃时:
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为________ ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是_______ 填字母)。
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是
(2)写出过程②发生反应的离子方程式:
过程Ⅱ:

(3)综合过程Ⅰ、Ⅱ,计算废Cu粉中各成分的质量之比是
过程Ⅲ:已知25℃时:
| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
(5)下列与 Ⅲ方案 相关的叙述中,正确的是
| A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染 |
| B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤 |
| C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜 |
| D.在pH>4的溶液中Fe3+一定不能大量存在 |
您最近一年使用:0次
2019-01-30更新
|
173次组卷
|
4卷引用:2016届河北省冀州市中学高三复习班上第一次月考化学试卷A
名校
2 . 电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se,工业上从其中回收硒(Se)、碲(Te)的一种工艺流程如下:
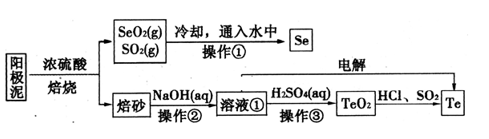
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为_____________________________ 操作①的名称为__________ 。
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、_______ 。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为___________________________ 。
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是_________________________________ 。
(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为__________________ 。

已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
(1)SeO2与SO2通入水中反应的化学方程式为
(2)焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、
(3)向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是

(4)将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为
您最近一年使用:0次
2019-01-22更新
|
1280次组卷
|
3卷引用:2019-2020广东省广州市广州中学高三10月考试化学试卷
名校
解题方法
3 . 聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.747 5 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为[已知:K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+7H2O]( )
| A.1∶1 | B.2∶1 | C.3∶1 | D.2∶5 |
您最近一年使用:0次
2018-12-15更新
|
1547次组卷
|
7卷引用:【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期第三次月考化学试题
【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高二下学期第三次月考化学试题2016-2017学年江苏省徐州一中高一上期中化学卷(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)(已下线)2019年1月2日 《每日一题》高考二轮复习-以物质的量为核心的计算辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题苏教2020版化学必修第二册专题9第三单元 金属材料的性能及应用课后习题
名校
解题方法
4 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢(HCN)气体。氰化氢的沸点只有26 ℃,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题:
(1)写出氰化钠遇水产生氰化氢气体的离子方程式_________________________
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式________________________________ 。
(3)爆炸残留在废水中的CN-可以用Cr2O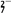 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
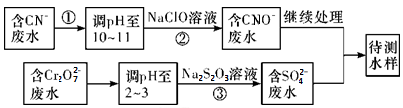
①上述处理废水流程中主要使用的方法是____________
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为_________________ ;
③步骤③中,每处理0.4 mol Cr2O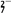 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式_________ ;
(1)写出氰化钠遇水产生氰化氢气体的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)爆炸残留在废水中的CN-可以用Cr2O
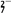 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
a.混凝法 b.中和法 c.沉淀法 d.氧化还原法
②②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol Cr2O
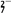 时转移电子2.4 mol,该反应的离子方程式
时转移电子2.4 mol,该反应的离子方程式
您最近一年使用:0次
2017-12-13更新
|
625次组卷
|
2卷引用:湖南省浏阳一中、醴陵一中、南方中学2017-2018学年高二12月联考化学试题
名校
5 . 从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________ , 被氧化的N原子的物质的量为__________ 。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________ 、_________ 、_________ 。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为
您最近一年使用:0次
2017-12-06更新
|
1330次组卷
|
2卷引用:江苏省东台市创新学校2019届高三上学期9月月考化学试题
名校
解题方法
6 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、A12O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如图所示。
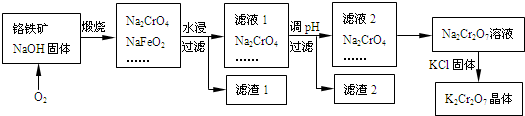
已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O 2CrO42-+2H+。
2CrO42-+2H+。
请回答:
(1)K2Cr2O7中K元素的原子结构示意图为____________ ,化合价是_______________ 。
(2)往铬铁矿里通入氧气的主要目的是__________________ 。滤液1的成分除Na2CrO4外,还含有_____ (填化学式)。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是________________________ 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是____________________ 。
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、__________ 、过滤、洗涤、干燥。
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是_______________________ 。

已知:①NaFeO2遇水强烈水解.②Cr2O72-+H2O
 2CrO42-+2H+。
2CrO42-+2H+。请回答:
(1)K2Cr2O7中K元素的原子结构示意图为
(2)往铬铁矿里通入氧气的主要目的是
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式
是
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是
(5)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
(6)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是
您最近一年使用:0次
名校
7 . 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与33.6LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.2.5L | B.1.2L | C.1.5L | D.3 L |
您最近一年使用:0次
2017-11-14更新
|
1806次组卷
|
4卷引用:云南省曲靖市第一中学2018届高三上学期第三次月考化学试题
名校
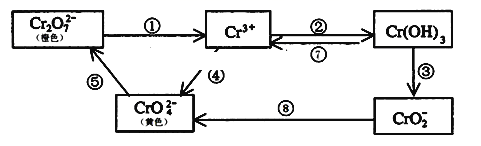
8 . 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
完成下列填空:
(1)溶液配制:称取一定量纯净的K2Cr2O7晶体配制100ml标准溶液,用蒸馏水完全溶解后,全部转移至_____ 中,加蒸馏水离刻度线1---2厘米处,改用__________ 加水至刻度线。
(2)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
___ Cr2O72-+___ Fe3O4 +__ H+ →__ Cr3+ +__ Fe3+ +__ H2O
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极___________ ,阴极_______________________ ;用铁做阳极的目的是:_____________________ 。
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:____________ 。
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为_____________________ (保留四位有效数字)。
完成下列填空:
(1)溶液配制:称取一定量纯净的K2Cr2O7晶体配制100ml标准溶液,用蒸馏水完全溶解后,全部转移至
(2)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式:
(3)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应:阳极
(4)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(5)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为
您最近一年使用:0次
2017-11-02更新
|
640次组卷
|
3卷引用:四川省绵阳市2018届高三一诊模拟(四)化学试题
9 . 现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为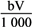 mol
mol
③反应过程中转移的电子的物质的量为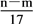 mol
mol
④生成NO气体的体积在标准状况下为 L
L
⑤与合金反应的硝酸的物质的量为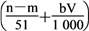 mol
mol
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为
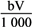 mol
mol③反应过程中转移的电子的物质的量为
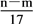 mol
mol④生成NO气体的体积在标准状况下为
 L
L⑤与合金反应的硝酸的物质的量为
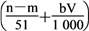 mol
mol| A.5项 | B.4项 | C.3项 | D.2项 |
您最近一年使用:0次
名校
10 . NH3和NO2在催化剂作用下反应:8NH3+6NO2=7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
| A.转移电子3.6NA | B.生成气体的体积32.56 L(标准状况) |
| C.还原剂比氧化剂多0.2 mol | D.被还原的氮原子是11.2 g |
您最近一年使用:0次
2017-10-17更新
|
1385次组卷
|
7卷引用:福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题



