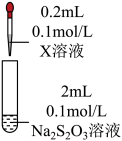
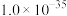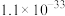1 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.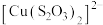 (淡绿色)、
(淡绿色)、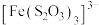 (紫黑色)、
(紫黑色)、 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+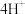
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
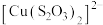 (淡绿色)、
(淡绿色)、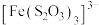 (紫黑色)、
(紫黑色)、 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+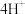
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。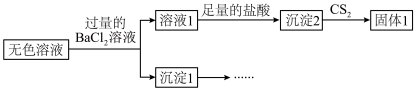
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
解题方法
2 . 二氧化硫脲[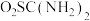 ](
](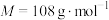 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
①滤液b主要成份为硫脲[ ](
](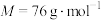 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。
②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[ ]。
]。
请回答:
(1)仪器Y的名称是________________ 。
(2)下列说法正确的是 。
(3)装置A的气密性检查操作为___________ 。
(4)请写出溶液b生成二氧化硫脲的化学方程式_____________ 。
(5)步骤5中将溶液温度下降到5℃的目的是______________ 。
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。
涉及到的反应有:
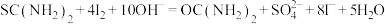
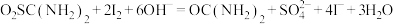

②另取0.1000g产品,加入50.00mL 0.1000 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。
涉及到的反应有:
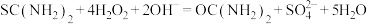


该产品中二氧化硫脲的质量分数为____________ 。
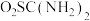 ](
](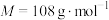 )为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下:
)为氮化合物的重要中间体,微溶于冷水,有还原性(碱性条件下增强)、热稳定性好。某同学利用废石膏制取二氧化硫脲,实验过程如下: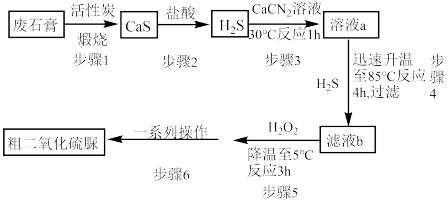

①滤液b主要成份为硫脲[
 ](
](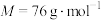 ),该物质易溶于水、有还原性。
),该物质易溶于水、有还原性。②当pH<2时,硫脲与双氧水发生反应只生成甲脒化二硫。
③二氧化硫脲粗产品中存在尿素[
 ]。
]。请回答:
(1)仪器Y的名称是
(2)下列说法正确的是 。
A.装置B中装的X溶液为饱和 溶液 溶液 |
B.装置E中的 与 与 发生氧化还原反应,起到尾气处理的作用 发生氧化还原反应,起到尾气处理的作用 |
| C.装置F中可分多次加入碳酸氢铵,以提高二氧化硫脲的产率 |
| D.步骤6“一系列操作”可为减压过滤,用冷水洗涤沉淀2-3次,一定温度下烘干沉淀 |
(3)装置A的气密性检查操作为
(4)请写出溶液b生成二氧化硫脲的化学方程式
(5)步骤5中将溶液温度下降到5℃的目的是
(6)为了检验产品中二氧化硫脲的含量(主要杂质为硫脲,其他杂质不参与反应),该同学设计了如下实验:
①称取5.000g产品,配制成100mL溶液。取10.00mL待测液于碘量瓶中,加入20.00mL 1.500
 NaOH溶液,再加入25.00mL 0.5000
NaOH溶液,再加入25.00mL 0.5000 I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
I2标准溶液,静置一段时间,加入适量硫酸进行酸化,改用0.5000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液体积为10.00mL。
溶液体积为10.00mL。涉及到的反应有:
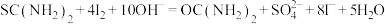
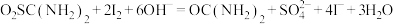

②另取0.1000g产品,加入50.00mL 0.1000
 NaOH溶液,再加入30.00mL 3.000%
NaOH溶液,再加入30.00mL 3.000%  溶液,静置2分钟。改用0.1000
溶液,静置2分钟。改用0.1000
 溶液进行滴定,测得消耗
溶液进行滴定,测得消耗 溶液为16.00mL。
溶液为16.00mL。涉及到的反应有:
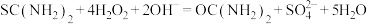


该产品中二氧化硫脲的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 取某铁铝铜合金9.34g,溶于足量的稀硝酸中,金属无剩余,收集到的一种气体是唯一还原产物。向溶液中加过量的氢氧化钠溶液,小心收集沉淀洗涤干净称重11.23g,加热分解至衡重,得固体质量为8.80g。则下列说法不正确的是
| A.参加反应的氢氧化钠不一定比参加反应的硝酸的物质的量多 |
| B.合金中铁铝的物质的量之比为1:2 |
| C.收集到的气体在标准状况下为4.256L |
| D.与铁铝铜合金反应的硝酸的物质的量是0.57mol |
您最近一年使用:0次
4 . 水合肼 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是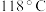 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。

回答下列问题:
(1) 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:___________ 。
(2)已知次氯酸钠与盐酸混合能够生成 ,说明氧化性
,说明氧化性
___________  (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与___________ 有关。
(3) 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为___________ 。
(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是___________ 。
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:___________ 。
(6)电化学方法制备 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。

①双极膜中产生的___________ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②若电路中转移2mol电子,理论上负极区溶液增重___________ g。
 常用于生产火箭燃料,其沸点是
常用于生产火箭燃料,其沸点是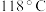 ,受热易分解。尿素法合成水合肼的基本流程如图所示。
,受热易分解。尿素法合成水合肼的基本流程如图所示。
回答下列问题:
(1)
 是二元弱碱,在水中的电离方式与氨相似,写出
是二元弱碱,在水中的电离方式与氨相似,写出 第二步电离的方程式:
第二步电离的方程式:(2)已知次氯酸钠与盐酸混合能够生成
 ,说明氧化性
,说明氧化性
 (填“>”或“<”)。实验发现,
(填“>”或“<”)。实验发现, 与烧碱溶液反应可以生成
与烧碱溶液反应可以生成 ,说明
,说明 与
与 的氧化性强弱关系与
的氧化性强弱关系与(3)
 强碱性溶液与尿素
强碱性溶液与尿素 水溶液加热制备水合肼的离子方程式为
水溶液加热制备水合肼的离子方程式为(4)常通过减压蒸馏从反应后的混合溶液中获得水合肼,采用该操作的原因是
(5)水合肼与硫酸反应生成的盐是农业上重要的杀虫剂、灭菌剂,写出水合肼与硫酸反应生成的碱式盐的化学式:
(6)电化学方法制备
 的装置如图所示。其中双极膜是阴、阳复合膜,层间的
的装置如图所示。其中双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②若电路中转移2mol电子,理论上负极区溶液增重
您最近一年使用:0次
5 . 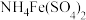 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
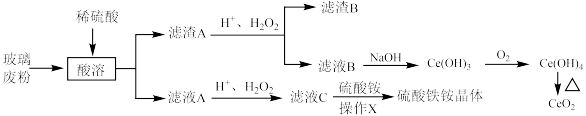
回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有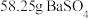 ,每次用
,每次用 的
的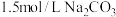 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;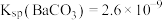 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为___________ 。
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率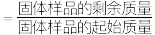
 。
。
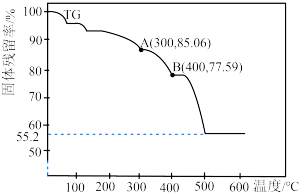
写出 的化学方程式:
的化学方程式:___________ 。
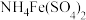 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
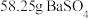 ,每次用
,每次用 的
的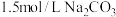 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;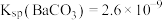 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率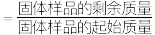
 。
。
写出
 的化学方程式:
的化学方程式:
您最近一年使用:0次
6 . 从含钴余液(含 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下:
(1)在去除钙、镁时,选择适当加热条件的理由是___________ ;该步骤控制pH是影响除钙镁效果的重要因素,下图是不同pH条件下硫化钴含量和钴收率图,根据图中信息选择最适宜的pH为___________ ;___________ ;
(3)已知P507萃取剂 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大 的萃取率,原因是
的萃取率,原因是___________ ;
(4)反萃取时加入的试剂a应为___________(填代号);
(5)沉钴的离子方程式为___________ ;
(6)系列操作中如何检验 是否洗涤干净
是否洗涤干净___________ ;
(7)空气中煅烧 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下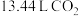 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为___________ 。
 、
、 、
、 、
、 等杂质)中提取氧化钴的流程如下:
等杂质)中提取氧化钴的流程如下: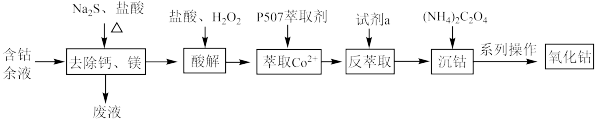
(1)在去除钙、镁时,选择适当加热条件的理由是

(3)已知P507萃取剂
 和
和 发生如下反应:
发生如下反应:
萃取时适当增加溶液的pH,能增大
 的萃取率,原因是
的萃取率,原因是(4)反萃取时加入的试剂a应为___________(填代号);
A. | B.HCl | C.NaOH | D. |
(5)沉钴的离子方程式为
(6)系列操作中如何检验
 是否洗涤干净
是否洗涤干净(7)空气中煅烧
 生成钴的某种氧化物和
生成钴的某种氧化物和 ,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下
,测得充分煅烧后剩余固体质量为24.1 g,同时获得标准状况下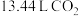 ,则钴的氧化物的化学式为
,则钴的氧化物的化学式为
您最近一年使用:0次
名校
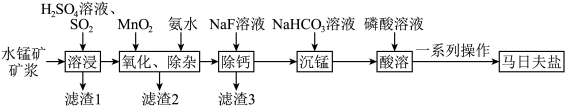
7 . 马日夫盐[Mn(H2PO4)2•2H2O]常用于机械设备的磷化处理,可起到防锈效果。以水锰矿[主要成分为MnO(OH),还含有少量的Fe2O3、SiO2及微量的CaO、Al2O3]为原料制备马日夫盐的一种工艺流程如图所示。
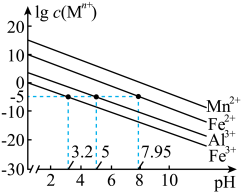
已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。
②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为_______ ,为提高SO2的吸收率,可采取的措施是_______ (写出两条即可)。
(2)“滤渣2”的主要成分为_______ (写化学式)。“氧化、除杂”步骤中不宜使用H2O2替代MnO2,原因是_______ 。加入氨水的目的是调节pH,应控制pH的范围是________ 之间。
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于______ mol/L。[已知:Ksp(CaF2)=3.6×10-12]。
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为_______ 。
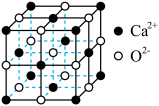
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为______ ,距离最近的Ca2+和O2-的核间距为apm,则CaO晶体的密度为_______ g/cm3(列出计算式,阿伏加德罗常数的值为NA)。

已知:①25℃时,金属离子在水溶液中的平衡浓度的对数与溶液的pH的关系如图所示。此实验条件下Mn2+开始沉淀的pH=7.54。

②当溶液中剩余的某金属离子浓度≤1×10-5mol/L时,通常认为该金属离子已沉淀完全。
回答下列问题:
(1)“溶浸”过程中主要成分发生反应的化学方程式为
(2)“滤渣2”的主要成分为
(3)加入NaF可以使Ca2+转化为CaF,沉淀除去,要使Ca2+完全沉淀,该步骤中应控制溶液中F-浓度不小于
(4)“沉锰”步骤中Mn2+转化为MnCO3沉淀,反应的离子方程式为
(5)CaO晶胞的结构如图所示,CaO晶体中Ca2+的配位数为

您最近一年使用:0次
2024-03-18更新
|
416次组卷
|
3卷引用:河北省石家庄市辛集中学、衡水中学2023-2024高三上学期期末联考化学试题
名校
解题方法
8 . 镓是优良的半导体材料。氮化镓是制作发光二极管的新材料,用于雷达、卫星通信设备等。某工厂利用铝土矿(主要成分为 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
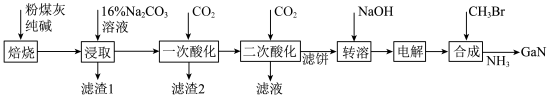
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度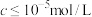 时,可认为已除尽。
时,可认为已除尽。
③金属离子氢氧化物的溶度积(25℃)
④ 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。
回答下列问题:
(1)写出元素镓在周期表中的位置______ ,其简化电子排布式为______ 。
(2)“焙烧”后所得产物主要有______ (写化学式)。
(3)“一次酸化”的目的是______ 。
(4)“二次酸化”中 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式______ 。
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式______ 。
(7)25℃时,已知: 可溶于氨水中,
可溶于氨水中,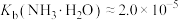 ,反应
,反应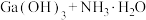
 的平衡常数
的平衡常数 ,计算反应
,计算反应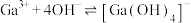 的平衡常数
的平衡常数
______ 。
 、
、 ,还有少量
,还有少量 等杂质)制备氮化镓流程如下:
等杂质)制备氮化镓流程如下:
已知:①镓性质与铝相似,金属活动性介于锌和铁之间。
②当溶液中可溶组分浓度
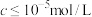 时,可认为已除尽。
时,可认为已除尽。③金属离子氢氧化物的溶度积(25℃)
|
|
| |
|
|
|
|
 、
、 均为两性,
均为两性, 的酸性略强于
的酸性略强于 。
。回答下列问题:
(1)写出元素镓在周期表中的位置
(2)“焙烧”后所得产物主要有
(3)“一次酸化”的目的是
(4)“二次酸化”中
 与足量
与足量 发生反应的离子方程式为
发生反应的离子方程式为(5)“电解”可得金属镓(铝不干扰镓盐的电解),写出阴极电极反应式
(6)“合成”得到的三甲基镓与氨反应得到氮化镓,写出此反应的化学方程式
(7)25℃时,已知:
 可溶于氨水中,
可溶于氨水中,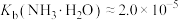 ,反应
,反应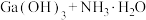
 的平衡常数
的平衡常数 ,计算反应
,计算反应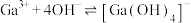 的平衡常数
的平衡常数
您最近一年使用:0次
解题方法
9 . 金属钌在电子制造、化学工业及催化剂生产等行业中有关键作用,六氯钌酸铵[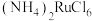 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
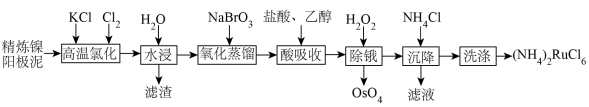
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到 、
、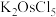 ,
,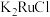 。
。 中Ru元素的化合价为
中Ru元素的化合价为___________ ,生成 的化学方程式为
的化学方程式为___________ 。
(2)“氧化蒸馏”过程中蒸出 、
、 ,生成
,生成 的离子方程式为
的离子方程式为___________ 。
(3)“酸吸收”过程中加入乙醇的作用是___________ 。
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为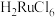 ,溶液中存在
,溶液中存在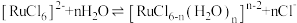
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有___________ 。
(5)检验滤液中主要阴离子的实验方法是___________ ,“洗涤”时最合适的试剂为___________ 。
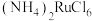 ]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
]是生产金属钌的重要中间产物。一种利用精炼镍阳极泥(主要含金属Ru、Os及Pb等)制备六氯钌酸铵的工业流程如图所示:
已知:六氯钌酸铵在冷水、乙醇中的溶解度较小。
回答下列问题:
(1)“高温氯化”后得到
 、
、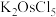 ,
,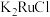 。
。 中Ru元素的化合价为
中Ru元素的化合价为 的化学方程式为
的化学方程式为(2)“氧化蒸馏”过程中蒸出
 、
、 ,生成
,生成 的离子方程式为
的离子方程式为(3)“酸吸收”过程中加入乙醇的作用是
(4)“除锇”过程中元素钌化合价不变,溶液的主要成分为
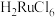 ,溶液中存在
,溶液中存在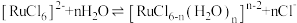
 ,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有
,六氯钌酸铵中水含量低,有利于六氯钌酸铵结晶物的粉碎焙烧。为降低六氯钌酸铵中水的含量,可以采用的措施有(5)检验滤液中主要阴离子的实验方法是
您最近一年使用:0次
名校
解题方法
10 . 某校化学小组探究 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
(1)对比实验i、ii、iii,说明反应速率与___________ 有关。
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于 ,淡黄色固体是
,淡黄色固体是___________ 。
(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是___________ ,但实验中溶液始终没有变蓝。
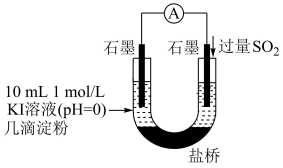
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是___________ 。
(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
根据(2)(4)(5)的实验现象,结合化学反应原理解释实验iv中始终未检测到单质碘的原因是___________ 。
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是___________ 。
实验结果证实了猜想,则总反应的化学方程式是___________ 。
 与
与 溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):
溶液的反应,进行了如下实验(以下实验过程中溶液体积变化忽略不计):| 实验 | 实验操作 | 实验现象 |
| i | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至量 至量 | 溶液慢慢变为浅黄色 |
| ii | 取 淀粉 淀粉 溶液 溶液 ,通入 ,通入 至过量 至过量 | 溶液迅速变为黄色,略有浑浊 |
| iii | 取 淀粉 淀粉 溶液 溶液 (用盐酸酸化至 (用盐酸酸化至 ),通入 ),通入 至过量 至过量 | 溶液迅速变为黄色,有浑浊 |
| iv | 将实验iii中的黄色浊液进行离心分离 | 试管壁上附着淡黄色固体,溶液为黄色 |
(1)对比实验i、ii、iii,说明反应速率与
(2)为了探究淡黄色固体的成分,甲同学进行实验:取实验iv试管壁上的淡黄色固体,发现其微溶于乙醇,易溶于
 ,淡黄色固体是
,淡黄色固体是(3)根据上述实验现象,甲同学猜测一定有单质碘生成,猜测的理论依据是
(4)利用如图装置继续实验,证实了单质碘可以生成。实验现象是

(5)对于实验i、ii、iii未能检测到单质碘,甲同学继续实验
| 实验 | 实验操作 | 实验现象 |
| v | 将 通入蓝色的碘淀粉混合溶液中 通入蓝色的碘淀粉混合溶液中 | 溶液蓝色迅速褪去 |
| vi | 取实验iv离心后的黄色溶液少量,加入盐酸酸化的 溶液 溶液 | 生成白色沉淀 |
(6)根据上述一系列实验,乙同学大胆猜测,整个反应中
 起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是
起到了催化剂作用,为了证明乙同学的猜想正确,还需要的实验证据是实验结果证实了猜想,则总反应的化学方程式是
您最近一年使用:0次