名校
解题方法
1 . 五氧化二钒用作有机化工的催化剂。从废钒催化剂(主要成分为V2O5、V2O4、K2SO4、SiO2、Fe2O3和Al2O3)中回收V2O5,既避免污染环境又有利于资源综合利用,该工艺流程如下:
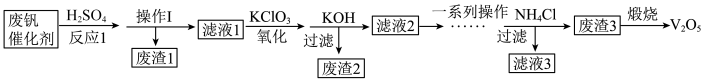
已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和___________ 。
(2)加入KClO3的作用是将VO2+转化为VO ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为___________ 。
(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是___________ 。
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:___________ 。
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,加入氯化铵调节溶液的最佳pH范围为___________ 。

已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和
(2)加入KClO3的作用是将VO2+转化为VO
 ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
您最近一年使用:0次
名校
2 . 镓的化合物
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式_____ 。
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态_____ ,画出C和D的结构_____ 。
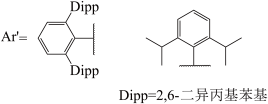
(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式_____ 。
(1)半导体工业中通过刻蚀制造微纳结构,GaN是重要的半导体材料,通常采用含氯气体在放电条件下进行刻蚀。写出利用Ar-Cl2混合气体放电刻蚀GaN的化学方程式
(2)金属镓熔点很低但沸点很高其中存在二聚体Ga.1990年,科学家将液态Ga和l2在甲苯中超声处理,得到了组成为Gal的物质。该物质中含有多种不同氧化态的Ga,具有两种可能的结构,分子式分别为Ga4I4(A)和Ga6I6(B),二者对应的阴离子分别为C和D,两种阴离子均由Ga和I构成且其中所有原子的价层均满足8电子。写出示出A和B组成特点的结构笱式并标出Ga的氧化态

(3)GaI常用于合成低价Ga的化合物。将GaI与Ar’Li(Ar’基如图所示,解答中直接采用简写Ar’)在-78℃的甲苯溶液中反应,得到晶体E,E中含有2个Ga原子:E在乙醚溶液中与金属钠反应得到晶体F,X射线晶体学表明,F中的Ga-Ga键长比E中短0.028nm。关于F中Ga-Ga的键级历史上曾有过争议,其中一种观点认为,F中的Ca价层满足8电子。基于该观点,画出E和F的结构式
您最近一年使用:0次
2023-09-07更新
|
321次组卷
|
2卷引用:2023年第37届中国化学奥林匹克(初赛)化学试题
3 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
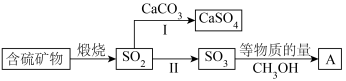
已知: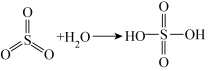
请回答:
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式___________ 。
(2)煅烧含硫量高的矿物得到高浓度的 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。
①下列说法正确的是___________ 。
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的 也可用浓
也可用浓 吸收
吸收
②一定压强下,化合物A的沸点低于硫酸的原因是___________ 。
(3)设计实验验证化合物A中含有S元素_____ ;写出实验过程中涉及的反应方程式____ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
已知:
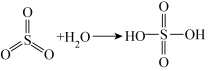
请回答:
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式(2)煅烧含硫量高的矿物得到高浓度的
 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。①下列说法正确的是
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的
 也可用浓
也可用浓 吸收
吸收②一定压强下,化合物A的沸点低于硫酸的原因是
(3)设计实验验证化合物A中含有S元素
您最近一年使用:0次
4 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
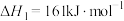
碳氯化:
反应Ⅱ: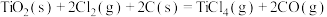
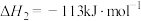
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
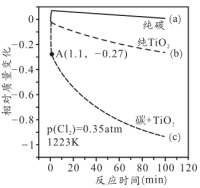
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照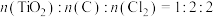 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照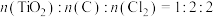 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
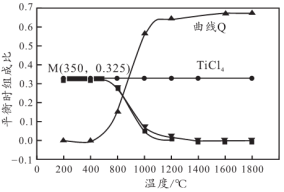
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

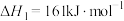
碳氯化:
反应Ⅱ:
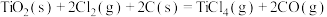
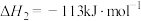
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
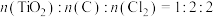 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近一年使用:0次
名校
解题方法
5 . 二氟草酸硼酸锂(LiBF2C2O4)热稳定性好,在较宽的温度范围内具有良好的离子电导率,对水分不敏感,被认为是最有希望取代六氟磷酸锂的电解质锂盐。由锂精矿(主要成分有LiAlSi2O6还含有少量Fe2+等离子)制备LiBF2C2O4的工艺如下。
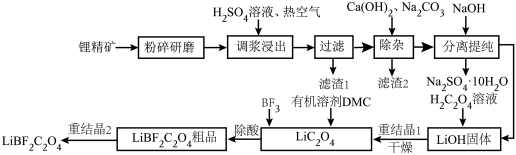
回答下列问题:
(1)调浆浸出时通入热空气的作用是___________ (用离子方程式表示)。
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为___________ ,滤渣2的主要成分是CaCO3和___________ (填化学式)。
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液___________ 、___________ (填简要操作),得到LiOH固体。
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
①一般认为BF3和Li2C2O4反应分两步进行:
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:___________ Ea2
请补齐第二步反应,并判断两步反应的活化能Ea1___________ (填“>”或“<”)Ea2。
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=___________ 。
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是___________ 。
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:_____ 。
Li+[ _____ ]。

回答下列问题:
(1)调浆浸出时通入热空气的作用是
(2)锂精矿中所有的Al元素和Si元素以某种铝硅酸盐从滤渣1中分离,该铝硅酸盐的化学式为
(3)分离提纯的步骤,将滤液蒸发浓缩,加入NaOH后,冷却到-5~-15℃分离出Na2SO4·10H2O。再将分离后的母液
(4)在较短的反应时间内,BF3和Li2C2O4反应时的比例对产物组成的影响如下表所示。
| n(BF3):n(Li2C2O4) | 产物组成 |
| 0.5 1.0 1.5 2.0 2.5 | LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4、Li2C2O4 LiBF2C2O4、LiBF4 LiBF2C2O4、LiBF4 |
第一步:Li2C2O4+BF3=LiBF2C2O4+LiFEa1
第二步:
请补齐第二步反应,并判断两步反应的活化能Ea1
②为避免药品浪费,反应的最佳比例n(BF3):n(Li2C2O4)=
(5)BF3和环境中微量的水反应会生成酸性物质,影响产品的纯度和性质,用Li2CO3比用LiOH除酸更好的原因是
(6)LiBF2C2O4的阴离子含五元环状结构,且B最外层为8e-构型,请你补全LiBF2C2O4的结构式:
Li+[ _____ ]。
您最近一年使用:0次
2023-05-17更新
|
605次组卷
|
3卷引用:湖北省华大新高考联盟2023届高三4月二模教学质量测评化学试题
名校
解题方法
6 . 为了实现碳达峰、碳中和目标,建立清洁低碳的能源体系,如何处置和利用废旧电池,已成为当前行业亟需解决的问题。一种废旧磷酸铁锂电池正极材料(主要成分为LiFePO4,另含有少量Al)回收利用的工艺流程如图所示。
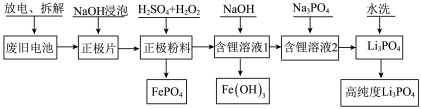
回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用_____ (填“封闭式全自动化拆解设备”或“开放式人工手动”)拆解,能避免环境污染并提高拆解效率.拆解后的正极片用NaOH溶液浸泡,目的是_____ 。
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是_____ 。生成FePO4的化学方程式为_____ 。
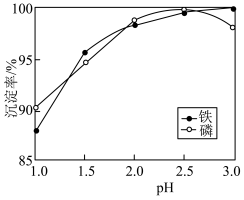
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是_____ 。
(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中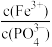 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中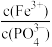 =
=_____ 。
(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的_____ (填化学式)中加入NaOH溶液制得。
(6)检验水洗Li3PO4已洗涤干净的操作方法是_____ 。

回答下列问题:
(1)拆解废旧磷酸铁锂电池会产生粉尘、废气等,采用
(2)正极粉料中加入硫酸酸化的双氧水,其中双氧水的作用是
(3)溶液的pH对铁和磷的沉淀率的影响如图所示。沉淀铁和磷时,应选择溶液的pH为2.5。当pH>2.5时,铁、磷沉淀率发生不同变化的原因是

(4)已知:Ksp(FePO4)=1.0×10-15,Ksp[Fe(OH)3]=2.8×10-39。向“含锂溶液1”[其中
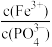 =1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中
=1]中加入NaOH固体,进行深度除铁。深度除铁后溶液的pH=4.5,则此时溶液中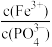 =
=(5)向“含锂溶液2”中加入Na3PO4溶液,得到Li3PO4沉淀。所加的Na3PO4溶液可通过向流程中的
(6)检验水洗Li3PO4已洗涤干净的操作方法是
您最近一年使用:0次
2023-05-15更新
|
580次组卷
|
2卷引用:河北省部分示范性高中2023届高三三模化学试题
名校
解题方法
7 . 小组同学探究 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。
实验:向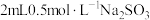 溶液中加入
溶液中加入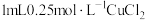 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。
已知:i.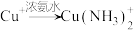 (无色)
(无色)
ii.
(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是 ,试剂X是
,试剂X是_______ 。
②无色溶液在空气中放置变为深蓝色,反应的离子方程式为_______ 。
(2)经检验,沉淀A不含 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是_______ 。
②无色溶液中含有 ,推测
,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验过程中 氧化
氧化 ;
;
途径2:_______ (将途径补充完整)。
经研究,途径1不合理,途径2合理。
③解释 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:_______ 。
(3) 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是_______ 。用 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
(4)根据上述实验所得结论:_______ (答出两点)。
 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。实验:向
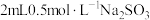 溶液中加入
溶液中加入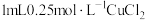 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。已知:i.
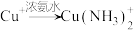 (无色)
(无色)ii.

(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是
 ,试剂X是
,试剂X是②无色溶液在空气中放置变为深蓝色,反应的离子方程式为
(2)经检验,沉淀A不含
 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是②无色溶液中含有
 ,推测
,推测 的产生有两个途径:
的产生有两个途径:途径1:实验过程中
 氧化
氧化 ;
;途径2:
经研究,途径1不合理,途径2合理。
③解释
 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:(3)
 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。(4)根据上述实验所得结论:
您最近一年使用:0次
2023-05-07更新
|
1299次组卷
|
3卷引用:北京市朝阳区2022-2023年高三下学期第二次模拟考试化学试题
解题方法
8 . 研究从电子废料(含金属铜和金)中回收金,主要过程如下。
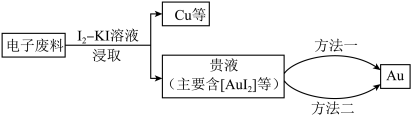
已知: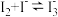 ;相同条件下,
;相同条件下, 与
与 的氧化性相近。
的氧化性相近。
(1)浸出 的离子方程式是
的离子方程式是___________ 。
(2)饱和碘水不能单独浸出 ,但是
,但是 溶液可以浸出
溶液可以浸出 ,原因有:
,原因有:
ⅰ. 在
在 溶液中的溶解度大,体系的氧化性强;
溶液中的溶解度大,体系的氧化性强;
ii.___________ 。
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是___________ 。
(4)方法一:用 还原。写出析出
还原。写出析出 的离子方程式:
的离子方程式:___________ 。
(5)方法二:用惰性电极电解,装置示意图如下。
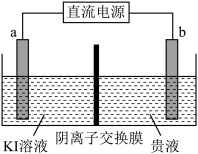
①___________ (填“a”或“b”)接电源的负极。
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是___________ 。
(6)与方法一对比:
①方法二的优点是___________ ;
②方法二的缺点是金的纯度较低,可用___________ (填试剂)进一步纯化。

已知:
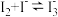 ;相同条件下,
;相同条件下, 与
与 的氧化性相近。
的氧化性相近。(1)浸出
 的离子方程式是
的离子方程式是(2)饱和碘水不能单独浸出
 ,但是
,但是 溶液可以浸出
溶液可以浸出 ,原因有:
,原因有:ⅰ.
 在
在 溶液中的溶解度大,体系的氧化性强;
溶液中的溶解度大,体系的氧化性强;ii.
(3)浸取一定时间后,应及时过滤,否则会降低金的浸出率,原因是
(4)方法一:用
 还原。写出析出
还原。写出析出 的离子方程式:
的离子方程式:(5)方法二:用惰性电极电解,装置示意图如下。

①
②直接电解贵液,不用阴离子交换膜,金的沉积率会降低,原因是
(6)与方法一对比:
①方法二的优点是
②方法二的缺点是金的纯度较低,可用
您最近一年使用:0次
名校
解题方法
9 . 高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: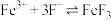
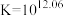

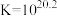
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的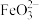 。此过程的反应为
。此过程的反应为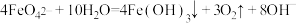 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中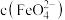 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
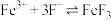
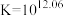

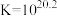
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的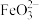 。此过程的反应为
。此过程的反应为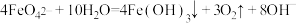 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
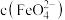 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
2023-05-07更新
|
588次组卷
|
2卷引用:北京市昌平区2023届高三下学期第二次统一练习化学试题
名校
10 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [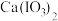 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,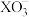 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的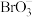 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
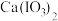 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
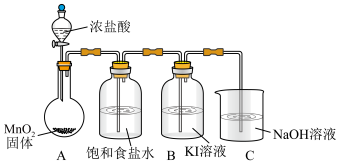
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
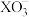 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的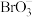 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
851次组卷
|
3卷引用:北京市北京师范大学附属实验中学2022-2023学年高一下学期期中考试化学试题



