1 . 某同学为探究蔬菜、水果长期放置后维生素C含量的变化,分别向盛有淀粉碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉碘溶液褪色,
| 黄瓜汁 | 新鲜 | 久置 |
| 滴数 | 10 | 20 |
| A.维生素C具有还原性,能将I2还原为I- |
| B.实验时两烧杯中的淀粉碘溶液的浓度、体积必须相等 |
| C.新鲜黄瓜汁比久置黄瓜汁中维生素C含量低 |
| D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果 |
您最近一年使用:0次
解题方法
2 . 在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论。下列“推理”正确的是
| A.根据1 mol O2和Mg完全反应获得4 mol电子;可推出1 mol O2和其他金属完全反应都获得4 mol电子 |
| B.配制浓度均为0.1 mol·L-1的H3PO4和H2SO4溶液,分别测其pH,若H3PO4溶液的pH大于H2SO4溶液;可推出元素的非金属性S>P |
C.根据Cl2 +2KI= 2KCl+I2反应中,氧化性:Cl2 >I2;可推出SiO2 +2C Si +2CO↑反应中,氧化性:C>Si Si +2CO↑反应中,氧化性:C>Si |
| D.向3%H2O2溶液中加0.1gMnO2粉末比加2滴1 mol·L-1FeCl3溶液反应剧烈;根据此实验可推出MnO2的催化效果一定比FeCl3好 |
您最近一年使用:0次
解题方法
3 . 四氮化四硫在沸腾的碱性溶液中会发生歧化反应,歧化产物取决于溶液碱性的强弱。在弱碱性溶液中,产物中硫的高氧化态阴离子为连硫酸根离子,其中含硫质量分数为50% ;在强碱性溶液中,歧化产物的两个阴离子中硫均呈正整数氧化态。在两个歧化反应中硫的低氧化态( +2价)阴离子产物是相同的,写出这两个歧化反应的离子方程式:
①____________________ ;②________________ 。
①
您最近一年使用:0次
解题方法
4 . 在碱性溶液中Na2Sx与NaClO反应,生成两种可溶盐溶液。在该混合液中加入BaCl2或AgNO3溶液都会生成不溶于稀酸的白色沉淀。经测试:1molNa2Sx与消耗6molNaOH恰好完全反应。x的值为._______ ;Na2Sx与NaClO反应的离子方程式是_______ 。
您最近一年使用:0次
解题方法
5 . 1.四氧化三铁在强碱性溶液中与次氯酸盐反应,生成高铁(VI)酸盐,其化学反应方程式是_______ 。高铁酸盐的作用之一是净化水,这是因为_______ 、_______ 。
您最近一年使用:0次
6 . 某元素X的氧化物很多,其中常见的有A、B两种
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.4%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为_______ ;
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为_______ 。
(3)你认为这两种气体是否可以在防SARS中作为消毒剂_______
(4)写出气体A与NaOH反应的化学方程式_______ 。由于工业上大量使用的A具有爆炸性,A适宜存放在_______ (填“酸”或“碱”)性溶液中。
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式_______ 。
(1)A为黄绿色气体,其中X元素在化合物中化合价为+4价,氧含量为47.4%,可用于漂白木浆和水处理,A在液态和浓缩的气态时具有爆炸性,该气体为
(2)B为黄棕色气体,氧含量为18.41%,当加热或遇电火花时会发生爆炸,该气体为
(3)你认为这两种气体是否可以在防SARS中作为消毒剂_______
| A.都可以 | B.都不可以 | C.只有气体A可以 | D.只有气体B可以 |
(5)用SO2还原X的+5价的盐,可制得A,写出该反应的离子方程式
您最近一年使用:0次
7 . 完成下列反应方程式(一律要配平): BrCl+ H2O=___________ ;(CN)2、(OCN2、(SCN)2 等与X2(X=F、Cl、Br、I)的性质相似,CN-、OCN-、SCN-与X-的性质相似,被称为拟卤素。(CN)2+H2O⇌___________ ;AgSCN+Br2=___________ ;AgCN 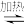
___________
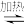
您最近一年使用:0次
解题方法
8 . 氙和氟气反应,生成含有XeF2和XeF4的固体混合物,现用两份等质量的此种固体混合物,分别做下面的化学分析:
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数___________ 。(提示:XeF2与H2O仅发生氧化还原反应;XeF4与H2O反应时,有一半的XeF4与水发生氧化还原反应,另一半的XeF4则发生歧化反应。)
①用水处理此固体,获得60. 2mL气体(在17°C和1.00×105Pa条件下),其中有24. 1mL是氧气,其余的是氙气,水溶液中的XeO3可以氧化30. 0mL。浓度为0. 100 mol/L的Fe2+。
②用KI溶液处理此固体,获得单质碘,此碘需要35.0mL浓度为0.200mol/L的Na2S2O3与之完全反应。
试求:此固体混合物中XeF2和XeF4的物质的量分数
您最近一年使用:0次
解题方法
9 . 钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、CaO和SiO2等杂质)来制备,其工艺流程如下:

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式______ 。
(2)流程中的“氧化剂”最好选用什么试剂?为什么______ ?
(3)写出由FePO4制备LiFePO4的化学反应方程式______ 。
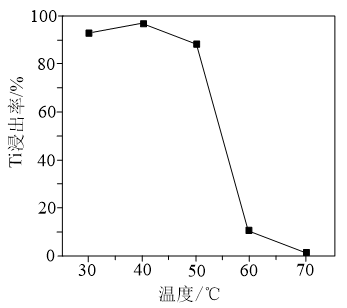
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么______ ?
(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少_____ 个。
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:
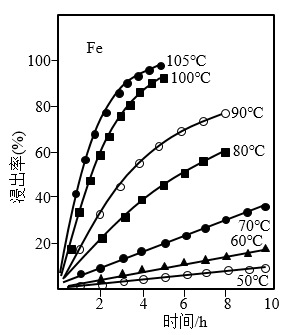

总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律_____ 。
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K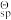 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成_____ ?
(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式_____ 。

请回答下列问题:
(1)已知FeTiO3与盐酸反应后有TiOCl
 生成, 写出该反应的离子方程式
生成, 写出该反应的离子方程式(2)流程中的“氧化剂”最好选用什么试剂?为什么
(3)写出由FePO4制备LiFePO4的化学反应方程式
(4)用双氧水和氨水溶解TiO2固体时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降,为什么

(5)过氧化钛酸锂Li2Ti5O15为一种配合物,请分析说明其中的过氧键(O- O)数目有多少
(6)“浸出”步骤中,温度对铁、钛的浸出效果如下图所示:


总结温度的影响规律:温度对铁和钛浸出效果的影响相似。请另写出两条规律
(7) 25 °C 下,已知FePO4、Ca3(PO4)2与Mg3(PO4)2的标准溶度积常数K
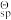 (简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K
(简称为溶度积常数,简写为Ksp)分别为9.9 ×10-29、 2.0 ×10-33、 9.9 ×10-25, H3PO4的三级标准电离常数K (简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成
(简称为电离常数,简写为Kai) 依次为7.1 ×10-3、 6.3 ×10-8、 4.2 ×10-13.若第二次过滤后所得滤液中Fe2+、Ca2+与Mg2+浓度分别为1.0、 0.02、 0.01 mol/L。试问,加入氧化剂和磷酸后(假设此时溶液中H+与H3PO4浓度均为1.0 mol/L),是否有Ca3(PO4)2与Mg3(PO4)2沉淀生成(8)若采用钛酸锂和磷酸亚铁锂作电极组成电池,充电时发生反应为:Li4Ti5O12 + LiFePO4 = Li4+xTi5O12 +Li 1-xFePO4 (0<x<1),请写出该电池放电时的阳极反应方程式
您最近一年使用:0次
解题方法
10 . 农业生产离不开空气、水、土壤和肥料,保护土壤资源,防止土壤污染,改良土壤酸碱性是保证社会可持续发展的重要工作。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:_______ 。
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。_______ ;_______ 。
(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):_______ 。
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):_______ 。
(1)土壤酸化的原因很多,主要有:矿物风化过程中产生的无机酸或大量二氧化碳;土壤中强酸弱碱盐的水解;无机肥料残留酸根;酸雨的影响;土壤胶体吸附的H+被其他阳离子交换;微生物、细菌在利用土壤有机物时,会产生二氧化碳和多种有机酸,或者将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸。
①土壤中主要含有的强酸弱碱盐:铝盐、铁盐等,写出其中一个水解方程式:
②在通气良好的土壤中,氧体系控制氧化还原反应,使多种物质呈氧化态,土壤中
 的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。
的氧化是在亚硝酸细菌和硝酸细菌作用下完成,写出反应离子方程式。(2)土壤呈碱性的原因与酸化原因大致相反,包括强碱弱酸盐的水解,尿素的过度使用,土壤所吸附的OH-、Na+等被其他离子交换或土壤中有机物中的氮被微生物分解生成氨的氨化过程。
①过度使用尿素[CO(NH2)2]会使土壤碱化的原因是(用化学方程式表示):
②改良土壤碱性的其中一种方法是使用石膏,其原理是(用化学反应方程式表示):
您最近一年使用:0次



