1 . 由下列实验操作及现象能得出相应结论的是
| 实验操作 | 现象 | 结论 | |
| A | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置 | 溶液分层,下层呈紫红色 | 氧化性: |
| B | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| C | 用pH计测定pH:①NaHCO3溶液②CH3COONa溶液 | pH:①>② | H2CO3酸性弱于CH3COOH |
| D | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-09-13更新
|
9428次组卷
|
25卷引用:2021年新高考辽宁化学高考真题
2021年新高考辽宁化学高考真题(已下线)第二单元 化学物质及其变化(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)甘肃省天水市田家炳中学2021-2022学年高三上学期第一阶段考试化学试题2021年辽宁高考化学试题变式题1-102021年海南高考化学试题变式题11-19(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)(已下线)查补易混易错点08 化学实验基础-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题08 氧化性和还原性强弱的实验探究及应用-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题辽宁省北镇市满族高级中学2022-2023学年高三上学期第一次质量检测化学试题新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年高三上学期第二次月考化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考点09 钠及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)实验03 探究氧化钠和过氧化钠的性质-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)(已下线)考点44 化学实验基础(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)热点题型特训 实验方案中逻辑关系的匹配判断黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期11月月考化学试题浙江省2023-2024学年高三上学期2月 模拟选考化学试题新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷(已下线)压轴题09 微型化学实验设计与评价(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
2 . 四钼酸铵是钼深加工的重要中间产品具有广泛的用途。一种以钼精矿(主要含 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。

回答下列问题:
(1)“焙烧”产生的气体用_______ 吸收后可制取氮肥。
(2)“浸出”时, 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有_______ (任写两种)。温度对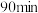 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致_______ 。

(3)“净化”时,浸出液中残留的 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中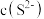 和pH的关系为:
和pH的关系为: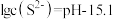 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于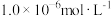 ,应控制溶液的pH不小于
,应控制溶液的pH不小于_______ 。(已知: ;
; 和
和 的
的 分别为35.2和17.2)
分别为35.2和17.2)
(4)“净化”后,溶液中若有低价钼(以 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(5)“沉淀”时,加入 的目的是
的目的是_______ 。
(6)高温下用 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为_______ 。【已知:(NH4)2Mo4O13受热分解生成 】
】
 ,还有
,还有 、
、 的化合物及
的化合物及 等)为原料制备四钼酸铵的工艺流程如下图所示。
等)为原料制备四钼酸铵的工艺流程如下图所示。
回答下列问题:
(1)“焙烧”产生的气体用
(2)“浸出”时,
 转化为
转化为 。提高单位时间内钼浸出率的措施有
。提高单位时间内钼浸出率的措施有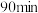 内钼浸出率的影响如图所示。当浸出温度超过
内钼浸出率的影响如图所示。当浸出温度超过 后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
后,钼的浸出率反而降低,主要原因是温度升高使水大量蒸发,导致
(3)“净化”时,浸出液中残留的
 、
、 转化为沉淀除去。研究表明,该溶液中
转化为沉淀除去。研究表明,该溶液中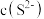 和pH的关系为:
和pH的关系为: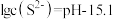 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于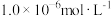 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;
; 和
和 的
的 分别为35.2和17.2)
分别为35.2和17.2)(4)“净化”后,溶液中若有低价钼(以
 表示),可加入适量
表示),可加入适量 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“沉淀”时,加入
 的目的是
的目的是(6)高温下用
 还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为
还原(NH4)2Mo4O13可制得金属钼,反应的化学方程式为 】
】
您最近一年使用:0次
2021-11-09更新
|
8284次组卷
|
12卷引用:2021年新高考福建化学高考真题
2021年新高考福建化学高考真题(已下线)专题15 工艺流程综合题-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第八章 水溶液中的离子反应与平衡 第55练 无机化工流程题的解题策略(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题
2022高三·全国·专题练习
真题
解题方法
3 . 科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如图。
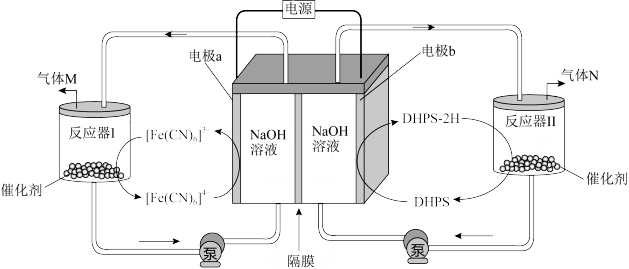
下列说法正确的是

下列说法正确的是
| A.电极b为阳极 |
| B.隔膜为阴离子交换膜 |
| C.生成气体M与N的物质的量之比为2:1 |
D.反应器I中反应的离子方程式为4[Fe(CN)6]3—+4OH— 4[Fe(CN)6]4—+O2↑+2H2O 4[Fe(CN)6]4—+O2↑+2H2O |
您最近一年使用:0次
2022-10-17更新
|
6191次组卷
|
6卷引用:2022年河北省高考真题化学试题
2022年河北省高考真题化学试题(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编(已下线)2022年河北省高考真题变式题(10-13)(已下线)专题九 电化学装置图(练)(已下线)题型19 两室膜电解装置及其应用微专题(16) 电解在物质制备和提纯中的应用
名校
4 . Cl2O沸点3.8°C,熔点-116°C,是很好的氯化剂,利用HgO+2Cl2=HgCl2+Cl2O可以制备高纯度的Cl2O。下列说法正确的是(NA为阿伏加德罗常数)
| A.标准状况下,2.24LCl2O含有分子数为0.1NA |
| B.0.2mol氯气与足量的HgO反应,转移电子数为0.2NA |
| C.HgO与稀硝酸反应的离子方程式为O2-+2H+=H2O |
| D.Cl2O与氢氧化钠溶液反应的离子方程式为Cl2O+2OH-=Cl-+ClO-+H2O |
您最近一年使用:0次
2022-04-13更新
|
2892次组卷
|
8卷引用:江西省九江市2022届第二次高考模拟统一考试理综化学试题
江西省九江市2022届第二次高考模拟统一考试理综化学试题(已下线)专题02化学计量与化学计算-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题02化学计量与化学计算-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题02化学计量与化学计算-五年(2018~2022)高考真题汇编(全国卷)福建省宁德第一中学2024届高三上学期第一次检测化学试题
5 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2593次组卷
|
11卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题(已下线)热点19 化学微型实验北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
6 . X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是
A.X、Y生成H2的物质的量之比一定为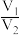 |
B.X、Y消耗酸的物质的量之比一定为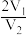 |
C.产物中X、Y化合价之比一定为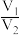 |
D.由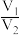 一定能确定产物中X、Y的化合价 一定能确定产物中X、Y的化合价 |
您最近一年使用:0次
2021-06-29更新
|
8203次组卷
|
27卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时11 物质的量、气体摩尔体积-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题02 化学计量与化学计算-备战2022年高考化学真题及地市好题专项集训【山东专用】江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题山东省烟台市第二中学2021-2022学年高一10月月考化学试题2021年山东高考化学试题变式题1-10湖北省武汉市汉阳、江夏2021-2022学年高一上学期12月联考化学试题河南省濮阳市第一高级中学2022-2023学年高三上学期第一次月考化学试题(已下线)第04讲 物质的量 气体摩尔体积 (练)-2023年高考化学一轮复习讲练测(新教材新高考)山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题湖南攸县长鸿实验中学2022-2023学年高三上学期第二次月考化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题(已下线)热点情景汇编-专题三 氧化还原中的化学武汉市第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题02 阿伏加德罗常数及其化学计算 (练)-2023年高考化学二轮复习讲练测(新高考专用)江苏省苏州市常熟中学2022-2023学年高一上学期末测试卷一化学试题(已下线)第一章 物质的量 第1讲 物质的量 气体摩尔体积山东省齐鲁名师联盟2023-2024学年高三上学期第一次诊断考试化学试题(已下线)考点08 物质的量在化学方程式计算中的应用(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点02 物质的量 气体摩尔体积(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题03 化学计量-2023年高考化学真题题源解密(全国通用)(已下线)专题03 阿伏加德罗常数与化学计算 -2023年高考化学真题题源解密(新高考专用)辽宁省沈阳市五校协作体2023-2024学年高一上学期11月期中考试化学试题(已下线)题型01 以物质的量为中心的计算-【好题汇编】备战2023-2024学年高一化学期末真题分类汇编(江苏专用)(已下线)第01讲 物质的量 气体摩尔体积(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(讲义)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
2022·河北·高考真题
真题
7 . 含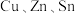 及S的四元半导体化合物(简写为
及S的四元半导体化合物(简写为 ),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_______ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(3) 的几何构型为
的几何构型为_______ ,其中心离子杂化方式为_______ 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______(填标号)。
(5)如图是硫的四种含氧酸根的结构:

根据组成和结构推断,能在酸性溶液中将 转化为
转化为 的是
的是_______ (填标号)。理由是_______ 。
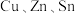 及S的四元半导体化合物(简写为
及S的四元半导体化合物(简写为 ),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)
 的几何构型为
的几何构型为(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______(填标号)。
A. | B. | C. | D.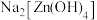 |

根据组成和结构推断,能在酸性溶液中将
 转化为
转化为 的是
的是
您最近一年使用:0次
2022-07-01更新
|
4211次组卷
|
7卷引用:2022年新高考河北省高考真题化学试题(部分试题)
(已下线)2022年新高考河北省高考真题化学试题(部分试题)(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
8 . 常温下、将等体积、浓度均为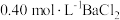 溶液与新制
溶液与新制 溶液混合,出现白色浑浊;再滴加过量的
溶液混合,出现白色浑浊;再滴加过量的 溶液,振荡,出现白色沉淀。
溶液,振荡,出现白色沉淀。
已知: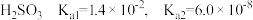
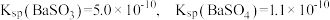
下列说法不正确 的是
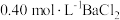 溶液与新制
溶液与新制 溶液混合,出现白色浑浊;再滴加过量的
溶液混合,出现白色浑浊;再滴加过量的 溶液,振荡,出现白色沉淀。
溶液,振荡,出现白色沉淀。已知:
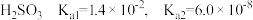
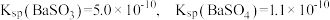
下列说法
A. 溶液中存在 溶液中存在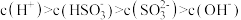 |
B.将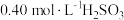 溶液稀释到 溶液稀释到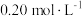 , ,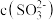 几乎不变 几乎不变 |
C. 溶液与 溶液与 溶液混合后出现的白色浑浊不含有 溶液混合后出现的白色浑浊不含有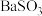 |
D.存在反应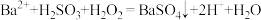 是出现白色沉淀的主要原因 是出现白色沉淀的主要原因 |
您最近一年使用:0次
2024-02-02更新
|
2253次组卷
|
5卷引用:2024年浙江高考真题化学(1月)
2024年浙江高考真题化学(1月)浙江省余姚中学2023-2024学年高二下学期3月质量检测化学试题四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学(已下线)选择题11-16(已下线)2024年高考化学真题完全解读(浙江1月卷)(讲义+课件)
真题
名校
9 . 某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是_______ 。
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:_______ 。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,_______ 。
④补充实验证实了③中的分析。
a是_______ ,b是_______ 。
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是_______ ,从原子结构角度说明理由______________ 。
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是_______ 。
(4)Ag分别与1mol·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:_______ 。
(5)总结:物质氧化性和还原性变化的一般规律是_______ 。
(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。
①反应的离子方程式是
②电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
④补充实验证实了③中的分析。
| 实验操作 | 试剂 | 产物 | |
| I | 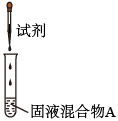 | 较浓H2SO4 | 有氯气 |
| II | a | 有氯气 | |
| III | a+b | 无氯气 |
(2)利用c(H+)浓度对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(4)Ag分别与1mol·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(5)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2021-09-03更新
|
7915次组卷
|
17卷引用:2021年新高考北京化学高考真题
2021年新高考北京化学高考真题2021年北京高考化学试题变式题11-19(已下线)回归教材重难点10 综合实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题24 氯气、氨气、二氧化硫的实验室制备与应用-备战2023年高考化学一轮复习考点微专题北京市中国人民大学附属中学丰台学校2022届高三上学期期中考试化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市丰台区丰台第二中学2022-2023学年上学期高三10月月考化学试题(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题山东省威海乳山市银滩高级中学2022-2023学年高三上学期10月月考化学试题(已下线)第十章 化学综合实验 第65讲 物质性质、化学反应综合实验探究(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题 北京市第一○一中学2023-2024学年高三上学期12月统练六化学试题 北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题北京市东城区第一六六中学2021-2022学年高三上学期期中考试化学试题
10 . 用电石(主要成分为CaC2,含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析不正确的是
| A.CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑ |
| B.不能依据反应①比较硫酸与氢硫酸的酸性强弱 |
| C.反应②中每24 mol CuSO4氧化11 mol PH3 |
| D.用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰 |
您最近一年使用:0次
2021-09-03更新
|
7585次组卷
|
20卷引用:2021年新高考北京化学高考真题
2021年新高考北京化学高考真题2021年北京高考化学试题变式题1-10黑龙江省哈尔滨德强学校2021-2022高三(清北班)上学期期中线下考试化学试题福建省厦门市湖滨中学2021-2022学年高三上学期期中考试化学试题(已下线)卷01 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)上海南汇中学2021-2022学年高三下学期阶段考试化学试题(已下线)微专题10 “守恒法”在氧化还原反应计算中的应用-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题(已下线)热点情景汇编-专题三 氧化还原中的化学(已下线)第05练 氧化还原反应的综合考查-2023年【暑假分层作业】高二化学(2024届一轮复习通用)河北正定中学2022-2023学年高二下学期第二次月考化学试题(已下线)考点04 氧化还原反应的基本概念和规律(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题北京师范大学第二附属中学2023-2024学年高三上学期10月月考化学试题北京一零一中学2023-2024学年高三上学期11月统练五化学试题天津市第二南开学校2023-2024学年高三上学期期中质量调查化学试题北京市北京师范大学第二附属中学2021-2022学年高三上学期期中考试化学试题北京市第十三中学2023-2024学年高三上学期开学考化学试卷 北京八中2023-2024学年高二下学期3月月考化学试题(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)



