1 . 氯元素形成的单质或化合物用途广泛。
(1)氯元素在周期表中的位置_____ 。
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是_____ (填合适的化学方程式)。
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:
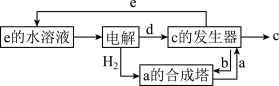
(3)C为______ (填化学式)。
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为______ 。
(5)“a的合成塔”中发生反应的化学方程式为______ 。
(6)“c的发生器”中发生反应的离子方程式为_____ (写出正确的离子方程式并用单线桥法分析电子转移的情况)。
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是_____ 。
(1)氯元素在周期表中的位置
(2)工业上可用钢瓶储运液氯,在加注液氯前要对钢瓶进行充分干燥的原因是
如图是氯的价类二维图:

其中C是一种新型净水剂,其合成路线如图:

(3)C为
(4)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:Zn+Cu2+=Zn2++Cu的氧化半反应可以表示为:Zn-2e-=Zn2+,电解时生成d的氧化半反应式为
(5)“a的合成塔”中发生反应的化学方程式为
(6)“c的发生器”中发生反应的离子方程式为
(7)实验测得等物质的量的f、O3、H2O2具有相同的漂白能力,原因是
您最近一年使用:0次
名校
2 . 纳米氧化亚铜(Cu2O,颗粒直径1~100nm)具有特殊的光学、光电和催化性能,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O(在潮湿空气中会慢慢氧化生成CuO)的合成路线如图所示。下列说法正确的是
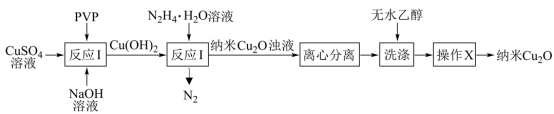

| A.反应Ⅰ为化合反应 |
| B.操作X为过滤 |
| C.反应Ⅱ中,每生成22.4L(标准状况)N2,转移4mol电子 |
| D.“洗涤”时,无水乙醇可用蒸馏水代替 |
您最近一年使用:0次
2021-10-09更新
|
414次组卷
|
3卷引用:重庆市西南大学附属中学2022届高三上学期第二次月考化学试题
解题方法
3 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
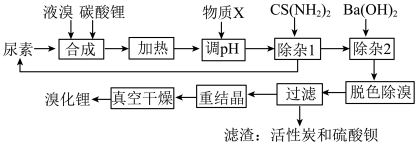
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
365次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
4 . 氢化铝锂(LiAlH4)、硼氢化钠(NaBH4)在有机合成中应用广泛。回答下列问题:
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为_______ 、_______ 。
(2)NaBH4的电子式为_______ ,其与水反应生成NaBO2,该反应的化学方程式为_______ 。
(3)还原能力(单位质量转移电子数):LiAlH4_______ (填“>”“=”或“<")NaBH4。
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是_______ 。
②“合成”反应的化学方程式为_______ 。
(1)工业上制备氢化铝锂方法是:首先高温高压合成氢化铝钠,然后与氯化锂反应,相关化学方程式为Na+Al+2H2
 NaAlH4;NaAlH4+LiCl
NaAlH4;NaAlH4+LiCl LiAlH4+NaCl。上述反应涉及的基本反应类型分别为
LiAlH4+NaCl。上述反应涉及的基本反应类型分别为(2)NaBH4的电子式为
(3)还原能力(单位质量转移电子数):LiAlH4
(4)工业上湿法合成NaBH4路线如下:

①"合成”步骤中常将NaH分散到矿物油中再与硼酸三甲酯[化学式:B(OCH3)3,易溶于矿物油中]反应,其目的是
②“合成”反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 氯化亚砜(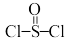 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
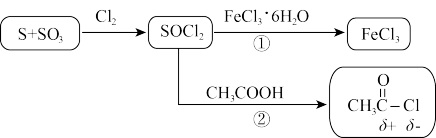
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式______ 。
(2)下列有关说法不正确 的是______ 。
(3)途径②除了CH3COCl外还产生两种酸性气体,写出该反应方程式______ 。
(4)SOCl2极易水解,试从共价键的极性角度分析其原因______ 。
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在______ 。
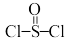 )常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
)常用作脱水剂和氯化剂。如图流程表示其制备及用途,回答下列问题:
(1)用硫磺、氯气和三氧化硫为原料,在一定条件下可合成SOCl2,原子利用率达100%。写出该反应方程式
(2)下列有关说法
| A.SO3是极性分子,容易与H2O发生反应 |
| B.途径①能制得无水FeCl3是因为SOCl2吸水性强且产物HCl能抑制Fe3+水解 |
C.FeCl3在溶液中分步水解,第一步反应为:Fe3++H2O Fe(OH)2++H+ Fe(OH)2++H+ |
| D.CH3COCl能与NH3反应生成乙酰胺 |
(4)SOCl2极易水解,试从共价键的极性角度分析其原因
(5)途径①可能发生氧化还原反应而生成副产物,设计实验分别检验氧化产物和还原产物的存在
您最近一年使用:0次
6 . 中国科学院天津工业生物技术研究所在实验室中首次实现从二氧化碳到淀粉分子的全合成,该技术同时解决了粮食危机和气候问题,路线如图所示:

A.反应1中,消耗1molCO2转移电子数 |
| B.温度越高,反应②、③的速率一定越快 |
C.将 与足量乙酸发生取代反应,可消耗乙酸 与足量乙酸发生取代反应,可消耗乙酸 |
| D.在Cu催化条件下也可实现反应② |
您最近一年使用:0次
名校
7 . 2021年,我国科学家首次在实验室实现 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是
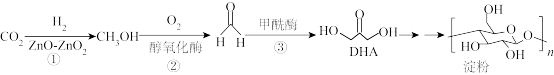
 到淀粉的全合成,其合成路线如下:设
到淀粉的全合成,其合成路线如下:设 为阿伏加德罗常数,下列有关说法不正确的是
为阿伏加德罗常数,下列有关说法不正确的是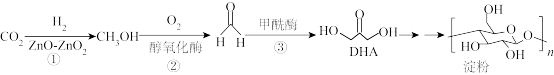
A.标况下,11.2L  中含有共用电子对数目为2 中含有共用电子对数目为2 |
| B.反应②、③无法在高温下进行 |
C.反应②中,3.2g  生成HCHO时转移电子数目为0.2 生成HCHO时转移电子数目为0.2 |
D.1mol DHA与乙酸发生取代反应,可消耗乙酸分子数目为 |
您最近一年使用:0次
2022-03-01更新
|
1432次组卷
|
9卷引用:广东省汕头市2022届高三下学期第一次模拟考试化学试题
广东省汕头市2022届高三下学期第一次模拟考试化学试题(已下线)押广东卷化学第11题 阿伏加德罗常数-备战2022年高考化学临考题号押题(广东卷)北京市通州区2022届高三查缺补漏化学试题北京市顺义牛栏山第一中学2022届高三下学期保温练习化学试题广西南宁市第二中学2021-2022学年高三下学期5月诊断理科综合化学试题北京市第十七中学2021-2022学年高三下学期5月模拟考试化学试题北京市顺义区第一中学2022届高三下学期三模化学试题(已下线)第一章 化学计量在实验中的应用(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题09 物质的量-备战2023年高考化学母题题源解密(广东卷)
解题方法
8 . 溴化锂(LiBr)是一种高效空气湿度调节剂;碘化钠(NaI)可用于医用祛痰剂等。它们可利用单质直接化合、氢氧化物和氢卤酸中和等反应合成。
(1)工业上以碳酸锂为原料制备 晶体的流程如下:
晶体的流程如下:
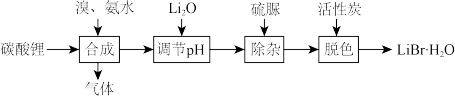
①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为___________ 。
②加还原剂硫脲 除去可能含有的
除去可能含有的 ,
, 共有
共有___________ molσ键。
③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取 晶体的操作有:在HBr氛围下蒸发浓缩、
晶体的操作有:在HBr氛围下蒸发浓缩、___________ ,___________ ,洗涤后烘干。

(2)某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。

药品: 溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,___________,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和 的离子方程式为
的离子方程式为___________ 。
②设计合理方案,补充完整上述实验步骤:___________ 。
(1)工业上以碳酸锂为原料制备
 晶体的流程如下:
晶体的流程如下:
①合成LiBr时生成了两种参与大气循环的气体,反应的化学方程式为
②加还原剂硫脲
 除去可能含有的
除去可能含有的 ,
, 共有
共有③溴化锂的溶解度随温度的变化曲线如图所示。则从脱色、过滤所得溶液中提取
 晶体的操作有:在HBr氛围下蒸发浓缩、
晶体的操作有:在HBr氛围下蒸发浓缩、
(2)某学生兴趣小组在实验室用碘单质制备较纯的NaI晶体,部分装置如图所示。

药品:
 溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。
溶液(含8.2gNaOH)、25.4g碘、水合肼(还原剂,产物为N2)、1.0g活性炭和蒸馏水等。实验步骤:向三口烧瓶中加入30mLNaOH溶液,边搅拌边加入25.4g单质碘。连接好装置并通入冷凝水,___________,过滤后将滤液蒸发浓缩、结晶、过滤、干燥得产品24.3g。
回答问题:①碘溶于NaOH溶液生成NaI和
 的离子方程式为
的离子方程式为②设计合理方案,补充完整上述实验步骤:
您最近一年使用:0次
9 . 铵明矾晶体的化学式为 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。
(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有___________ 。
(2)步骤III中生成白色沉淀C反应的化学方程式为___________ 。
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是___________ 。
(4)设计实验验证固体A含有的金属元素:___________ 。
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值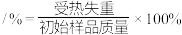 )
)
通过上述数据可判断,在温度区间___________ ℃,铵明矾基本上失去了结晶水。
 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。
 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有
(2)步骤III中生成白色沉淀C反应的化学方程式为
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是
(4)设计实验验证固体A含有的金属元素:
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值
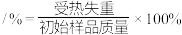 )
)| 温度区间/℃ | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值/% | 39.20 | 7.80 | 13.00 | 26.00 |
您最近一年使用:0次
名校
解题方法
10 . 碲化镉(CdTe)量子点具有优异的光电性能。某科研人员设计以电解精炼铜获得的富碲渣(含铜、碲、银等)为原料合成碲化镉量子点的流程如下:
(1)电解精炼铜时原料富碲渣将在___________ (填“阴”或“阳”)极区获得。
(2)“硫酸酸浸”时,取含单质Te 6.38%的富碲渣20 g,为将Te全部溶出转化为 ,需加质量分数为30%的H2O2(密度:1.134 g/cm3)
,需加质量分数为30%的H2O2(密度:1.134 g/cm3)___________ mL。但实际操作中,H2O2用量远高于该计算值,原因之一是Cu同时也被H2O2浸出,请写出Cu被浸出时发生反应的离子方程式:___________ 。
(3)化学中用标准电极电势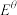 (氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为
(氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为 、
、 ,则SO2“还原”酸浸液时,主要发生反应的化学方程式是
,则SO2“还原”酸浸液时,主要发生反应的化学方程式是___________ 。
(4)①在研究“还原”步骤实验条件时,发现Te、Cu单位时间内沉淀率随NaCl溶液浓度的变化如图所示,则该步骤应选择的NaCl溶液适宜浓度为___________ 。___________ 。___________ (填字母)。
A.硬脂酸钠 B.甲苯 C.乙酸乙酯 D.碳酸钠
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,关于这一现象下列说法正确的是___________ (填字母)。
A.属于物理变化 B.属于化学变化 C.由光化学反应产生 D.由电子跃迁形成

(1)电解精炼铜时原料富碲渣将在
(2)“硫酸酸浸”时,取含单质Te 6.38%的富碲渣20 g,为将Te全部溶出转化为
 ,需加质量分数为30%的H2O2(密度:1.134 g/cm3)
,需加质量分数为30%的H2O2(密度:1.134 g/cm3)(3)化学中用标准电极电势
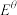 (氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为
(氧化态/还原态)反映微粒间得失电子能力的强弱,一般这个数值越大,氧化态转化为还原态越容易。已知硫酸酸浸液中部分微粒的标准还原电极电势为 、
、 ,则SO2“还原”酸浸液时,主要发生反应的化学方程式是
,则SO2“还原”酸浸液时,主要发生反应的化学方程式是(4)①在研究“还原”步骤实验条件时,发现Te、Cu单位时间内沉淀率随NaCl溶液浓度的变化如图所示,则该步骤应选择的NaCl溶液适宜浓度为


A.硬脂酸钠 B.甲苯 C.乙酸乙酯 D.碳酸钠
②量子点在微观尺寸发生变化时,可以在特定波长的激光照射下发出不同颜色的光,关于这一现象下列说法正确的是
A.属于物理变化 B.属于化学变化 C.由光化学反应产生 D.由电子跃迁形成
您最近一年使用:0次



