1 . 将有机物转化为高附加值产品是目前一个执门的研究方向。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g) 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
反应Ⅱ C3H8O3(I)+1.5O2(g) 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为_______ 。(答案写成最小整数比)
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是_______ 。
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是_______ 。
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2 La2O2CO3;第二步:
La2O2CO3;第二步:_______ 。(写化学方程式)
③La2O3除了减少积碳外,还可以提高H2的产率,原因是_______ 。
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。
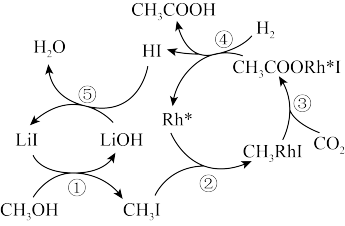
①该反应中的催化剂为_______ 。
②生成1molCH3COOH,最终转移电子_______ mol。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g)
 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1反应Ⅱ C3H8O3(I)+1.5O2(g)
 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2
 La2O2CO3;第二步:
La2O2CO3;第二步:③La2O3除了减少积碳外,还可以提高H2的产率,原因是
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。

①该反应中的催化剂为
②生成1molCH3COOH,最终转移电子
您最近一年使用:0次
解题方法
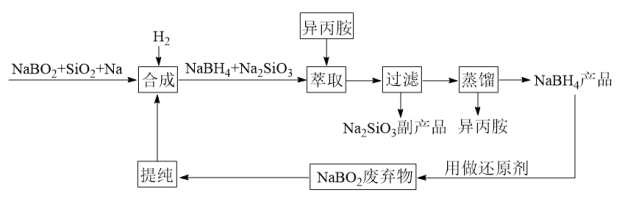
2 . 硼氢化钠( )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
回答下列问题
(1)写出 的电子式
的电子式_______ 。
(2)合成时,需要将石英晶体粉碎,其目的是_______ 。
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和_______ 。
(4)从煤油中取出金属钠后,需要先_______ (简述操作),再用石油醚洗涤。
(5)合成反应中氧化剂与还原剂的质量比为_______ 。
(6)流程中可以循环利用的物质除 外,还有
外,还有_______ 。
(7) 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
 )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
回答下列问题
(1)写出
 的电子式
的电子式(2)合成时,需要将石英晶体粉碎,其目的是
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和
(4)从煤油中取出金属钠后,需要先
(5)合成反应中氧化剂与还原剂的质量比为
(6)流程中可以循环利用的物质除
 外,还有
外,还有(7)
 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式
您最近一年使用:0次
解题方法
3 . 根据文字信息书写相应的方程式。
(1)PH3有剧毒,用硫酸铜溶液吸收,生成物含Cu3P沉淀、磷酸,反应的离子方程式为____ 。
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得,反应过程中还有CO2等生成,且n(CO2):n(ClO2)=1:2。该反应的化学方程式是____ 。
(3)CuCl难溶于水,常用作有机合成催化剂,实验室以铜矿粉(主要含Cu2S及少量Fe2O3、FeCO3等)为原料制备CuCl的流程如图:
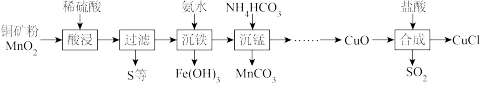
①“酸浸”时,Cu2S所发生反应的离子方程式为____ 。
②“沉锰”时有CO2气体放出,该反应的化学方程式为____ 。
③“合成”反应的化学方程式为____ 。
(1)PH3有剧毒,用硫酸铜溶液吸收,生成物含Cu3P沉淀、磷酸,反应的离子方程式为
(2)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得,反应过程中还有CO2等生成,且n(CO2):n(ClO2)=1:2。该反应的化学方程式是
(3)CuCl难溶于水,常用作有机合成催化剂,实验室以铜矿粉(主要含Cu2S及少量Fe2O3、FeCO3等)为原料制备CuCl的流程如图:

①“酸浸”时,Cu2S所发生反应的离子方程式为
②“沉锰”时有CO2气体放出,该反应的化学方程式为
③“合成”反应的化学方程式为
您最近一年使用:0次
4 . 酸锶(SrTiO3)具有光催化活性,工业上常用钛铁矿(主要含FeTiO3和少量SiO2、Fe2O3)为原料合成钛酸锶,其工艺流程如图:

已知:常温下,Fe(OH)3的Ksp=4.0×10-38。
回答下列问题:
(1)按化合物的组成和性质分类,SrTiO3属于____ 类(填正确答案标号)。
(2)“酸溶”时,分离混合物得到TiOSO4溶液的操作名称是____ 。
(3)常温下,“水浸”时需要控制溶液pH≤3.0,以确保水浸渣中不含Fe(OH)3,此时所得滤液中Fe3+的最大浓度为____ mol·L-1。
(4)“氯化”时,需在高温且碳过量的条件下进行,该反应的化学方程式为____ 。若水浸渣焙烧不充分,对“氧化”的不利影响是____ (写出一点即可)。
(5)“共沉淀”时,经过过滤、洗涤、干燥得到纯净的SrTiO(C2O4)2·4H2O。请简述实验室用蒸馏水洗涤沉淀的操作是____ 。
(6)利用钛酸锶光催化还原CO2有利于实现“碳达峰”“碳中和”,其原理如图所示。写出铂电极上的电极反应式____ ,反应过程中除需不断通入CO2外,一段时间后,还需向装置中补充____ (填化学式)。


已知:常温下,Fe(OH)3的Ksp=4.0×10-38。
回答下列问题:
(1)按化合物的组成和性质分类,SrTiO3属于
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(3)常温下,“水浸”时需要控制溶液pH≤3.0,以确保水浸渣中不含Fe(OH)3,此时所得滤液中Fe3+的最大浓度为
(4)“氯化”时,需在高温且碳过量的条件下进行,该反应的化学方程式为
(5)“共沉淀”时,经过过滤、洗涤、干燥得到纯净的SrTiO(C2O4)2·4H2O。请简述实验室用蒸馏水洗涤沉淀的操作是
(6)利用钛酸锶光催化还原CO2有利于实现“碳达峰”“碳中和”,其原理如图所示。写出铂电极上的电极反应式

您最近一年使用:0次
名校
5 .  是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:

已知:i.锰酸钾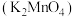 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是_______ (用化学方程式表示)。
(2)步骤Ⅱ中先将一定比例的KOH和 固体放于
固体放于_______ (填仪器名称)中加热至熔融,再分多次小心加入 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)步骤Ⅲ的实验装置如图所示。
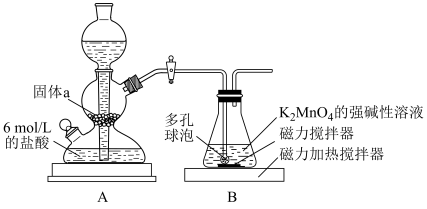
①固体a可以为_______ (填字母序号)。
A. B.
B. C.
C.
②装置B中随着 通入可观察到的现象是
通入可观察到的现象是_______ ,实验需控制 的用量,可能原因是
的用量,可能原因是_______ 。实验结束后,将装置B中溶液过滤,对滤液蒸发浓缩,冷却结晶,过滤、洗涤、干燥即可得到 晶体。
晶体。
③实验装置存在一处缺陷,可能会导致 产率降低,改进的方法是
产率降低,改进的方法是_______ 。
(4)测定 纯度的步骤如下:
纯度的步骤如下:
①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸 溶液250mL。
溶液250mL。
③移取标准草酸溶液25.00mL于锥形瓶中,用所配 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。
④重复3次,平均消耗 溶液29.80mL。
溶液29.80mL。
则产品中 的纯度(质量分数)为
的纯度(质量分数)为_______ %(保留小数点后两位)。
 是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:
已知:i.锰酸钾
 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是
(2)步骤Ⅱ中先将一定比例的KOH和
 固体放于
固体放于 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为(3)步骤Ⅲ的实验装置如图所示。

①固体a可以为
A.
 B.
B. C.
C.
②装置B中随着
 通入可观察到的现象是
通入可观察到的现象是 的用量,可能原因是
的用量,可能原因是 晶体。
晶体。③实验装置存在一处缺陷,可能会导致
 产率降低,改进的方法是
产率降低,改进的方法是(4)测定
 纯度的步骤如下:
纯度的步骤如下:①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸
 溶液250mL。
溶液250mL。③移取标准草酸溶液25.00mL于锥形瓶中,用所配
 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。④重复3次,平均消耗
 溶液29.80mL。
溶液29.80mL。则产品中
 的纯度(质量分数)为
的纯度(质量分数)为
您最近一年使用:0次
6 . 钒是人体不可缺少的元素,Heyliger 等首次报道了偏钒酸钠显著降低糖尿病大鼠血糖的作用后,钒化学的研究得到了很大发展。钒及其化合物也广泛应用于特种钢、催化剂、颜料、染料、电子材料及防腐剂等等领域。
(1)钒酸盐与磷酸盐结构相似。请画出VO 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型__________ 。
(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式__________ 。
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图__________ 。
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因__________ 。
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式__________ 。
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由__________ 。
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下__________ 。
(1)钒酸盐与磷酸盐结构相似。请画出VO
 、H2VO
、H2VO 、VO2(H2O)
、VO2(H2O)  和V2O
和V2O 的空间构型
的空间构型(2)生理条件下的钒以多种氧化态存在,各种氧化态可以相互转化。通常细胞外的钒是V(V), 。而细胞内的钒是V(IV)。研究表明,钒酸二氢根离子可与亚铁血红素(Mtrc-Fe2+)反应,写出该反应的离子方程式
(3)①已知配合物[VON(CH2COO)3]在水溶液中的几何构型是唯一 的,画出它的空间构型图
②理论推测上述配合物分子在晶体中是有手性的,指出产生手性的原因
(4)钒酸钇晶体是近年来新开发出的优良双折射光学晶体,在光电产业中得到广泛应用。可以在弱碱性溶液中用偏钒酸铵和硝酸钇合成。写出以Y2O3与V2O5为主要原料合成钒酸钇的化学方程式
(5)若以市售分析纯偏钒酸铵为原料制备高纯钒酸钇单晶,需将杂质铁离子含量降至一定数量级。设每升偏钒酸铵溶液中含三价铁离子为5.0 ×10-5 mol,用0.01 mol dm-3的鏊合剂除铁。
①说明不采取使铁离子水解析出沉淀的方法除铁的理由
②通过计算说明如何选择螯合剂使偏钒酸铵含铁量降至10-30moldm-3以下
| 配离子 |  |
| [Fe(edta)]2- [Fe(edta)]- [Fe(phen)3]2+ [Fe(phen)3]3+ | 2.1×1014 1.7×1024 2.0×1021 1.3×1014 |
| 沉淀 | Ksp |
| Fe(OH)2 Fe(OH)3 | 8.0×10-16 4.0×10-38 |
您最近一年使用:0次
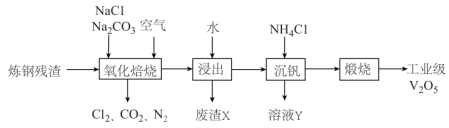
7 . 在炼钢残渣中, 和FeO结合成
和FeO结合成 。经如图所示工艺流程可提取出工业级
。经如图所示工艺流程可提取出工业级 ,继而可以制取钒单质及其化合物。
,继而可以制取钒单质及其化合物。
回答下列问题:
(1)钒是第四周期第ⅤB族元素,原子的最外层电子数是2,则钒的原子结构示意图为___________ 。
(2)“氧化焙烧”过程中,钒元素转化为 ,涉及到的主要反应有三个,分别为
,涉及到的主要反应有三个,分别为 、
、 和
和___________ 。
(3)废渣X的主要成分的用途是___________ (任写一点)。溶液Y中的主要溶质是___________ (填化学式)。
(4)以工业级 为原料,可用铝热法冶炼钒单质,反应的化学方程式为
为原料,可用铝热法冶炼钒单质,反应的化学方程式为___________ 。
(5)全钒液流电池的工作原理如图所示。电解槽中使用的离子交换膜仅允许 通过。已知:充电时,右侧区域
通过。已知:充电时,右侧区域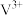 转化为
转化为 。
。

①充电时,b为电源的___________ (填“正极”或“负极”)。
②放电时,正极的电极反应式为___________ 。
 和FeO结合成
和FeO结合成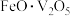 。经如图所示工艺流程可提取出工业级
。经如图所示工艺流程可提取出工业级 ,继而可以制取钒单质及其化合物。
,继而可以制取钒单质及其化合物。
回答下列问题:
(1)钒是第四周期第ⅤB族元素,原子的最外层电子数是2,则钒的原子结构示意图为
(2)“氧化焙烧”过程中,钒元素转化为
 ,涉及到的主要反应有三个,分别为
,涉及到的主要反应有三个,分别为 、
、 和
和(3)废渣X的主要成分的用途是
(4)以工业级
 为原料,可用铝热法冶炼钒单质,反应的化学方程式为
为原料,可用铝热法冶炼钒单质,反应的化学方程式为(5)全钒液流电池的工作原理如图所示。电解槽中使用的离子交换膜仅允许
 通过。已知:充电时,右侧区域
通过。已知:充电时,右侧区域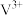 转化为
转化为 。
。
①充电时,b为电源的
②放电时,正极的电极反应式为
您最近一年使用:0次
名校
8 . 钯(Pd)是重要的金属元素,在有机合成工业上用途广泛。自然界中,钯含量少,常伴生在其他矿藏中,如硫化镍铜矿、镍黄铁矿等。以硫化镍铜矿(含有CuS、NiS、 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:

已知“酸浸”后的固体剩余物为 、PdO(不与碱反应)。
、PdO(不与碱反应)。
回答下列问题:
(1)“灼烧”时产生的污染性气体是_______ (填化学式)。
(2)写出“除硅”反应的离子方程式:_______ 。
(3)“系列操作”包括_______ ,过滤、洗涤、干燥。
(4)“还原”时反应还生成无污染的气体,化学方程式为_______ 。
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:_______ 。
(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(7)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=_______ 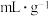 ,氢气的浓度r=
,氢气的浓度r=_______ (结果保留两位小数)。(吸附容量R即1g钯吸附氢气的体积;氢气的浓度r为1mol Pd吸附氢气的物质的量)
 以及少量的Pd)为原料制备
以及少量的Pd)为原料制备 和Pd的工艺流程如下:
和Pd的工艺流程如下:
已知“酸浸”后的固体剩余物为
 、PdO(不与碱反应)。
、PdO(不与碱反应)。回答下列问题:
(1)“灼烧”时产生的污染性气体是
(2)写出“除硅”反应的离子方程式:
(3)“系列操作”包括
(4)“还原”时反应还生成无污染的气体,化学方程式为
(5)王水是按照体积比3∶1将浓盐酸和浓硝酸混合而得到的强氧化性溶液,“王水溶解”时需要加热,该过程除了生成NO外,还有
 生成。写出Pd和王水反应的化学方程式:
生成。写出Pd和王水反应的化学方程式:(6)“氢气还原”时,参加反应的氧化剂与还原剂的物质的量之比为
(7)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量R=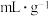 ,氢气的浓度r=
,氢气的浓度r=
您最近一年使用:0次
2022-10-01更新
|
343次组卷
|
3卷引用:河南省洛阳市2022-2023学年高三上学期9月联考化学试题
9 . 硫氰化钾(KSCN)是常用的分析试剂,用硫磺与KCN等为原料制备KSCN的实验流程如图:
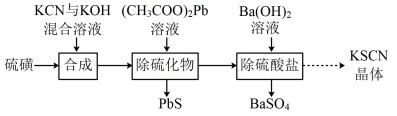
已知:①Ka(HSCN)=0.13,Ka(HCN)=6.2×10-10,Ksp(PbS)=9.0×10-29
②S+KCN KSCN(放热反应)
KSCN(放热反应)
(1)合成。将硫磺与一定量水配成悬浊液加入如图所示的反应釜中,在搅拌下滴入KCN与KOH混合溶液。
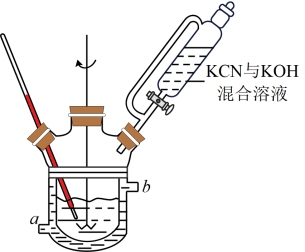
①冷水从____ (填“a”或“b”)端通入。
②若反应温度过高,可采取的措施有:减慢滴加KCN与KOH混合溶液的速率、____ 。
③反应釜中还有副反应发生,如硫磺与KOH溶液反应生成K2S和K2S2O3,该反应的化学方程式为_____ 。
(2)除硫化物。由于成品中不能含有铅,故加入(CH3COO)2Pb溶液只能略微不足。证明(CH3COO)2Pb溶液略微不足的实验操作与现象是____ 。
(3)除硫酸盐。选用Ba(OH)2溶液而不选用BaCl2溶液的原因是____ 。
(4)KSCN纯度测定。溶液pH介于0~1时,用KSCN溶液滴定已知浓度的AgNO3溶液来测定KSCN纯度,发生反应为SCN-+Ag+=AgSCN↓。请补充完整实验方案:①准确称取1.0000g样品,溶于适量蒸馏水,将溶液完全转移到100.00mL容量瓶中,定容得溶液A;②量取20.00mL____ ;③重复实验两次,计算消耗溶液A的平均体积为VmL;④通过公式w(KSCN)=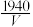 %计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
%计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。

已知:①Ka(HSCN)=0.13,Ka(HCN)=6.2×10-10,Ksp(PbS)=9.0×10-29
②S+KCN
 KSCN(放热反应)
KSCN(放热反应)(1)合成。将硫磺与一定量水配成悬浊液加入如图所示的反应釜中,在搅拌下滴入KCN与KOH混合溶液。

①冷水从
②若反应温度过高,可采取的措施有:减慢滴加KCN与KOH混合溶液的速率、
③反应釜中还有副反应发生,如硫磺与KOH溶液反应生成K2S和K2S2O3,该反应的化学方程式为
(2)除硫化物。由于成品中不能含有铅,故加入(CH3COO)2Pb溶液只能略微不足。证明(CH3COO)2Pb溶液略微不足的实验操作与现象是
(3)除硫酸盐。选用Ba(OH)2溶液而不选用BaCl2溶液的原因是
(4)KSCN纯度测定。溶液pH介于0~1时,用KSCN溶液滴定已知浓度的AgNO3溶液来测定KSCN纯度,发生反应为SCN-+Ag+=AgSCN↓。请补充完整实验方案:①准确称取1.0000g样品,溶于适量蒸馏水,将溶液完全转移到100.00mL容量瓶中,定容得溶液A;②量取20.00mL
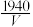 %计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
%计算KSCN的质量分数[实验中须使用的试剂:NH4Fe(SO4)2溶液、1.0mol·L-1HNO3溶液、0.1000mol·L-1AgNO3溶液]。
您最近一年使用:0次
名校
10 . 以废旧锂离子电池正极材料(主要成分为镍钴锰酸锂,还有少量铝箔和含铁化合物)为原料,回收 、
、 、
、 的过程可表示为:
的过程可表示为:
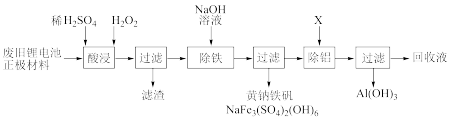
(1)“酸浸”时,三价镍、三价钴、四价锰转化为 、
、 、
、 进入溶液。该过程中
进入溶液。该过程中 的作用是
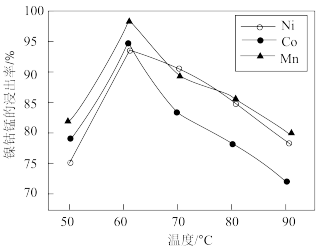
的作用是___________ 。保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图所示。60℃时浸出率达到最大,可能的原因是___________ 。
(2)“除铁”生成黄钠铁矾沉淀时需控制溶液的 为15~18.该过程中需不断加入
为15~18.该过程中需不断加入 溶液,其作用是
溶液,其作用是___________ 。
(3)物质X可调节溶液的 ,X为
,X为___________ (填序号)
A. B.
B. C.
C.
(4)回收液可用于合成锂离子电池正极材料,合成前需测定其中 等离子的浓度。
等离子的浓度。
测定原理:用过量标准 溶液氧化经预处理的回收液样品中的
溶液氧化经预处理的回收液样品中的 ,再用标准
,再用标准 溶液滴定过量的
溶液滴定过量的 。
。
反应方程式为: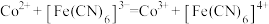 。
。
测定过程:取预处理后的回收液样品 ,向其中加入
,向其中加入

 溶液,充分反应;再用
溶液,充分反应;再用
 溶液滴定反应后的溶液,消耗
溶液滴定反应后的溶液,消耗 溶液
溶液 。
。
数据分析:计算预处理后的回收液样品中 的物质的量浓度
的物质的量浓度___________ 。(写出计算过程)
 、
、 、
、 的过程可表示为:
的过程可表示为:

(1)“酸浸”时,三价镍、三价钴、四价锰转化为
 、
、 、
、 进入溶液。该过程中
进入溶液。该过程中 的作用是
的作用是(2)“除铁”生成黄钠铁矾沉淀时需控制溶液的
 为15~18.该过程中需不断加入
为15~18.该过程中需不断加入 溶液,其作用是
溶液,其作用是(3)物质X可调节溶液的
 ,X为
,X为A.
 B.
B. C.
C.
(4)回收液可用于合成锂离子电池正极材料,合成前需测定其中
 等离子的浓度。
等离子的浓度。测定原理:用过量标准
 溶液氧化经预处理的回收液样品中的
溶液氧化经预处理的回收液样品中的 ,再用标准
,再用标准 溶液滴定过量的
溶液滴定过量的 。
。反应方程式为:
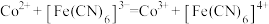 。
。测定过程:取预处理后的回收液样品
 ,向其中加入
,向其中加入

 溶液,充分反应;再用
溶液,充分反应;再用
 溶液滴定反应后的溶液,消耗
溶液滴定反应后的溶液,消耗 溶液
溶液 。
。数据分析:计算预处理后的回收液样品中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
2021-11-21更新
|
513次组卷
|
3卷引用:江苏省扬州市2021-2022学年高三上学期期中考试化学试题



