解题方法
1 . 亚硝酰氯( NOCl)是重要的有机合成试剂,可由NO与Cl2在常温下合成。某学习小组在实验室利用如图装置制备亚硝酰氯。

已知:①亚硝酰氯易水解,能与O2反应;
②沸点:NOCl为-5.5℃,Cl2为-34℃,NO为-152℃;
③常温下,2NO + Cl2 =2NOCl2 2NO2 + Cl2 =2NO2Cl。
请回答下列问题:
(1)NOCl中N元素的化合价为_______ ;NOCl水解生成两种酸,其化学方程式为_______ 。
(2)实验所需的NO在A装置中制得,反应的离子方程式为_______ 。
(3)装置B中所盛试剂为_______ 其作用是_______ 。
(4)实验开始时,先关闭K3,打开K2、K4,从a处通一段时间氩气,其目的是_______ 。 然后在a处接废气处理装置,关闭K1、K4,打开K3,再打开分液漏斗的活塞,滴加酸性FeSO4溶液,当观察到D中_______ 时, 关闭K2,打开K1、K4 ,通干燥纯净的Cl2。
(5)为收集产物和分离未反应的两种原料, E、F装置采用不同温度的低温浴槽,其中装置E的温度T区间应控制在_______ ,装置F 的U形管中收集到的是_______ 。

已知:①亚硝酰氯易水解,能与O2反应;
②沸点:NOCl为-5.5℃,Cl2为-34℃,NO为-152℃;
③常温下,2NO + Cl2 =2NOCl2 2NO2 + Cl2 =2NO2Cl。
请回答下列问题:
(1)NOCl中N元素的化合价为
(2)实验所需的NO在A装置中制得,反应的离子方程式为
(3)装置B中所盛试剂为
(4)实验开始时,先关闭K3,打开K2、K4,从a处通一段时间氩气,其目的是
(5)为收集产物和分离未反应的两种原料, E、F装置采用不同温度的低温浴槽,其中装置E的温度T区间应控制在
您最近一年使用:0次
2022-04-14更新
|
557次组卷
|
4卷引用:山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题
山西省临汾市2022届高考考前适应性训练考试(二)理科综合化学试题(已下线)微专题20 新型含氯化合物的制备与性质探究(ClO2、NOCl等)-备战2023年高考化学一轮复习考点微专题(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)山西省晋中市平遥县第二中学校2021-2022学年高二下学期升级化学试题
解题方法
2 . 黄钠铁矾[NaFe3 (SO4)2(OH)6]是一种高效净水剂,Ni(OH)2可作为合成镍钴锰三元电极材料的原料,工业上可用红土镍矿(主要成分为NiO、FeO、Fe2O3、MgO和SiO2)制备黄钠铁矾和Ni (OH)2,工艺流程如图所示。
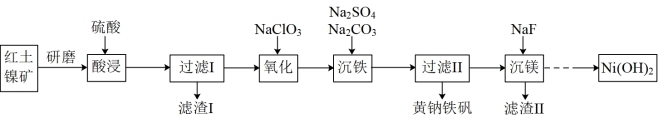
已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
(2)“氧化”过程中发生反应的离子方程式为:_______ ;为 了证明加入的NaClO3已足量,可取“氧化”后的溶液,向其中加入_______ 来检验(填标号)。
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
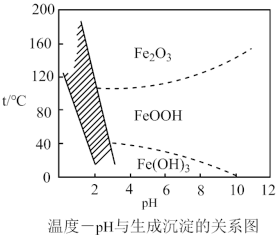
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为_______ ;若反应在低于40℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是_______ 。
(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是_______ 。
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为_______ mol·L-1 (已知:100.4≈2.5,
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式_______ 。

已知:①次亚磷酸钠(NaH2PO2)具有还原性;
②亚磷酸(H3PO3)是二元弱酸。
回答下列问题:
(1)下列说法正确的是_______ (填标号)。
| A.研磨粉碎的目的是增大反应速率 |
| B.用浓硫酸可提高“酸浸”时的浸取率 |
| C.过滤时用到的玻璃仪器主要有漏斗、烧杯、玻璃棒 |
| D.“滤渣I”的主要成分为H2SiO3 |
a. KSCN 溶液 b. K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(3)“沉铁” 过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图中阴影部分表示的是黄钠铁矾稳定存在区域),若控制pH=2.5,沉铁的最佳温度范围为

(4)①“沉镁”是生成MgF2沉淀除去Mg2+。若溶液酸度过高,则Mg2+沉淀不完全,原因是
②若“沉镁”后溶液的pH=8.0,则此时Ni2+浓度约为
Ksp[Ni(OH)2]=10-14.6)。
(5)化学镀镍是金属表面镀镍的常用方法。以NiSO4和NaH2PO2为原料,在90℃的酸性溶液中镀镍,同时生成H3PO3。写出化学镀镍反应的离子方程式
您最近一年使用:0次
3 . 申泮文院士(1916-2017),广东籍化学家、教育家,长期致力于无机化学教学研究为我国无机化学教学和教材建设做出了卓越贡献。他在化学教育研究领域创下多项第一;编写出新中国第一部大学化学教材、第一个引入美国科技出版物、第一个在化学教学应用计算机技术、主持完成我国第一部多媒体教科书等。他常在课堂教学中,号召学生牢记历史,报效祖国。2005年,申先生入选“中国10位最令人感动的教师”,也是我国执教时间最长的化学教师。2011年,95岁高龄的申先生还坚持骑着行车去给本科生讲课。
申先生是我国在离子型金属氢化物、储氢合金材料和镍/金属氢化物可逆电池等研究领域的先驱者。1959年10月,他和龚毅生等在《化学通报》发表“氢化铝锂的合成”,这是我国在氢化物研究领域发表的第一篇论文。
(1)完成以氢化锂(LiH)和氯化铝为原料合成氢化铝锂(LiAlH4)的反应方程式:
4LiH+______ =LiAlH4+3______
(2)根据以上材料谈一谈你的认识和启示______ 、______ 、______ (写三点)。
申先生是我国在离子型金属氢化物、储氢合金材料和镍/金属氢化物可逆电池等研究领域的先驱者。1959年10月,他和龚毅生等在《化学通报》发表“氢化铝锂的合成”,这是我国在氢化物研究领域发表的第一篇论文。
(1)完成以氢化锂(LiH)和氯化铝为原料合成氢化铝锂(LiAlH4)的反应方程式:
4LiH+
(2)根据以上材料谈一谈你的认识和启示
您最近一年使用:0次
名校
解题方法
4 . 化学与生活密切相关。下列说法错误的是
| A.雾和霾是气溶胶,PM2.5被认为是造成雾霾天气的“元凶” |
| B.2021年我国科学家以CO2为原料合成淀粉,为缓解温室效应带来新的希望 |
| C.二氧化硫可用作葡萄酒的食品添加剂,用来杀死有害细菌,防止色素被氧化 |
| D.新型水处理剂Na2FeO4利用其强氧化性对病菌和悬浮物进行高效处理 |
您最近一年使用:0次
2022-02-26更新
|
2367次组卷
|
5卷引用:湘豫名校2022届高三1月联考理科综合化学试题
湘豫名校2022届高三1月联考理科综合化学试题(已下线)专项01 化学与STSE-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省茂名高州市校际联盟2021-2022学年高一5月联考化学试题黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题安徽省六安市晓天中学2021-2022学年高一下学期第一次月考化学试题
解题方法
5 . 合成氨是重要的研究课题。粮食生产依赖于合成氨工业,氨也被认为是一种具有潜在应用前景的能源载体。
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是_______ 。
②将方框中的收集装置补充完整_______ 。
③用湿润的红色石蕊试纸检验NH3,_______ (填现象),说明检出NH3。
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是_______ (填写序号)。
②工业合成氨的化学方程式是:_______ 。
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:
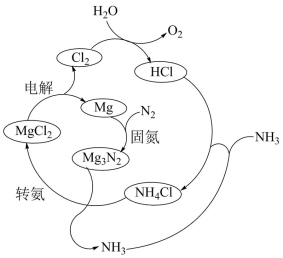
①合成氨的总反应方程式是_______ 。
②实验研究:查阅资料,同位素示踪法可以证实 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。
实验:将_______ (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在 。
。
③测量 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物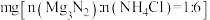 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为_______ 。( 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为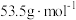 )
)
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。

①加热氯化铵和石灰反应的化学方程式是
②将方框中的收集装置补充完整
③用湿润的红色石蕊试纸检验NH3,
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:

①上述过程中吸收能量的是
②工业合成氨的化学方程式是:
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:

①合成氨的总反应方程式是
②实验研究:查阅资料,同位素示踪法可以证实
 中的氮元素在“转氨”过程中能转变为氨。
中的氮元素在“转氨”过程中能转变为氨。实验:将
检测结果:经探测仪器检测,所得氨气中存在
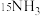 。
。③测量
 的转化率:取固体
的转化率:取固体 、NH4Cl的混合物
、NH4Cl的混合物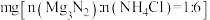 ,混匀,充分反应。生成的NH3与
,混匀,充分反应。生成的NH3与 的H2SO4恰好完全反应。
的H2SO4恰好完全反应。 的转化率为
的转化率为 摩尔质量为
摩尔质量为 、
、 摩尔质量为
摩尔质量为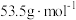 )
)
您最近一年使用:0次
名校
解题方法
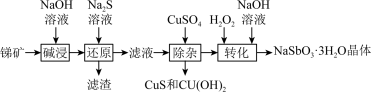
6 . 三水锑酸钠( )常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含
)常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含 、
、 、
、 、
、 等)为原料合成三水锑酸钠的工艺流程如下图。
等)为原料合成三水锑酸钠的工艺流程如下图。
已知:ⅰ.常温下, 、
、 ;
;
ⅱ. 冷水中不溶,溶于硫化钠溶液;
冷水中不溶,溶于硫化钠溶液; 冷水中不溶,热水中发生水解形成胶体。
冷水中不溶,热水中发生水解形成胶体。
(1)“碱浸”和“还原”中加快锑矿浸出速率的具体措施为___________ (任写两条)。
(2)“滤渣”中除了含有 外,还含有
外,还含有___________ (填化学式)。
(3)“还原”步骤中 溶液的作用为
溶液的作用为___________ ; 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(4)“除杂”步骤后溶液的 ,则此时溶液中
,则此时溶液中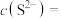
___________ 。
(5)“转化”时发生反应的化学方程式为___________ ;该过程中加入 溶液的目的是
溶液的目的是___________ 。
 )常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含
)常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含 、
、 、
、 、
、 等)为原料合成三水锑酸钠的工艺流程如下图。
等)为原料合成三水锑酸钠的工艺流程如下图。
已知:ⅰ.常温下,
 、
、 ;
;ⅱ.
 冷水中不溶,溶于硫化钠溶液;
冷水中不溶,溶于硫化钠溶液; 冷水中不溶,热水中发生水解形成胶体。
冷水中不溶,热水中发生水解形成胶体。(1)“碱浸”和“还原”中加快锑矿浸出速率的具体措施为
(2)“滤渣”中除了含有
 外,还含有
外,还含有(3)“还原”步骤中
 溶液的作用为
溶液的作用为 转化为
转化为 的离子方程式为
的离子方程式为(4)“除杂”步骤后溶液的
 ,则此时溶液中
,则此时溶液中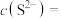
(5)“转化”时发生反应的化学方程式为
 溶液的目的是
溶液的目的是
您最近一年使用:0次
7 . 化合物X是由三种主族元素组成的液体物质,某兴趣小组对化合物X开展探究实验。

已知:①X遇水反应剧烈,产生白雾;
②气体A和气体B是纯净物;
③ 为不溶于水的白色沉淀。
为不溶于水的白色沉淀。
请回答:
(1)写出气体A的化学式___________ ,组成X的三种元素___________ (填元素符号)
(2)写出X与水反应的化学方程式是___________
(3)将A通入到还原性气体Y的水溶液中,生成一种淡黄色沉淀。则Y、A、 三种微粒还原性由强到弱的顺序为
三种微粒还原性由强到弱的顺序为___________ (用化学式表示)。
(4)用硫磺(用S表示)、液氯和三氧化硫为原料,在一定条件下合成X,如果总原子利用率最大化(即期望产物的总质量与生成物的总质量之比),则相对应的三种物质的物质的量之比为___________ 。
(5)将气体A和B通入足量的氢氧化钠溶液中,充分反应,请设计实验方案,检验所得溶液中的阴离子(不考虑水解和溶液中的 )
)___________ 。

已知:①X遇水反应剧烈,产生白雾;
②气体A和气体B是纯净物;
③
 为不溶于水的白色沉淀。
为不溶于水的白色沉淀。请回答:
(1)写出气体A的化学式
(2)写出X与水反应的化学方程式是
(3)将A通入到还原性气体Y的水溶液中,生成一种淡黄色沉淀。则Y、A、
 三种微粒还原性由强到弱的顺序为
三种微粒还原性由强到弱的顺序为(4)用硫磺(用S表示)、液氯和三氧化硫为原料,在一定条件下合成X,如果总原子利用率最大化(即期望产物的总质量与生成物的总质量之比),则相对应的三种物质的物质的量之比为
(5)将气体A和B通入足量的氢氧化钠溶液中,充分反应,请设计实验方案,检验所得溶液中的阴离子(不考虑水解和溶液中的
 )
)
您最近一年使用:0次
8 . 将有机物转化为高附加值产品是目前一个执门的研究方向。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g) 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
反应Ⅱ C3H8O3(I)+1.5O2(g) 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为_______ 。(答案写成最小整数比)
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是_______ 。
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是_______ 。
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2 La2O2CO3;第二步:
La2O2CO3;第二步:_______ 。(写化学方程式)
③La2O3除了减少积碳外,还可以提高H2的产率,原因是_______ 。
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。
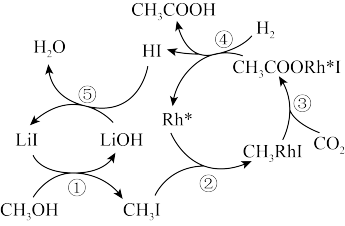
①该反应中的催化剂为_______ 。
②生成1molCH3COOH,最终转移电子_______ mol。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g)
 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1反应Ⅱ C3H8O3(I)+1.5O2(g)
 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2
 La2O2CO3;第二步:
La2O2CO3;第二步:③La2O3除了减少积碳外,还可以提高H2的产率,原因是
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。

①该反应中的催化剂为
②生成1molCH3COOH,最终转移电子
您最近一年使用:0次
解题方法
9 . 硼氢化钠( )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
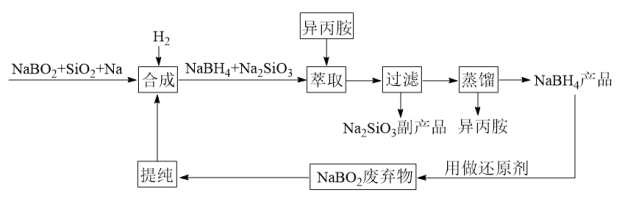
回答下列问题
(1)写出 的电子式
的电子式_______ 。
(2)合成时,需要将石英晶体粉碎,其目的是_______ 。
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和_______ 。
(4)从煤油中取出金属钠后,需要先_______ (简述操作),再用石油醚洗涤。
(5)合成反应中氧化剂与还原剂的质量比为_______ 。
(6)流程中可以循环利用的物质除 外,还有
外,还有_______ 。
(7) 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
 )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
回答下列问题
(1)写出
 的电子式
的电子式(2)合成时,需要将石英晶体粉碎,其目的是
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和
(4)从煤油中取出金属钠后,需要先
(5)合成反应中氧化剂与还原剂的质量比为
(6)流程中可以循环利用的物质除
 外,还有
外,还有(7)
 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式
您最近一年使用:0次
10 . 硫元素在自然界中主要以硫黄、硫化物或硫酸盐的形式存在,利用这些矿物可制取其他含硫化合物。
(1)硫元素存在多种单质,其中一种单质的蒸气密度是同温同压下 密度的8倍,该单质的摩尔质量为
密度的8倍,该单质的摩尔质量为________ ,其分子式为________ 。
(2)以硫化铜矿石为原料,利用某种能耐受铜盐毒性的细菌,以空气中的氧气为氧化剂将硫化铜氧化成可溶性铜盐,该反应的化学方程式为________ 。
(3)反应 为工业上合成硫酸的非常重要的一步。
为工业上合成硫酸的非常重要的一步。
一定温度下,向体积为2L的刚性密闭容器中充入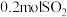 和
和 ,发生该反应。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
,发生该反应。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:

①图中曲线表示的是________ (填“ ”“
”“ ”或“
”或“ ”)的浓度随时间的变化,2min时
”)的浓度随时间的变化,2min时 的转化率为
的转化率为________ 。
②0~2min内,用 表示该反应的速率为
表示该反应的速率为________ 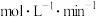 。
。
(4)浓硫酸具有强氧化性,但是常温下可用铝槽车运输浓硫酸,原因是________ 。浓硫酸能溶解红热的铜粉,用双线桥标出该反应的电子转移方向和数目________ 。
(5)硫代硫酸钠与稀硫酸的反应如下: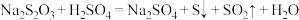 ,在以下条件下进行实验,产生浑浊的时间由短到长依次为
,在以下条件下进行实验,产生浑浊的时间由短到长依次为________ (填序号)。
(1)硫元素存在多种单质,其中一种单质的蒸气密度是同温同压下
 密度的8倍,该单质的摩尔质量为
密度的8倍,该单质的摩尔质量为(2)以硫化铜矿石为原料,利用某种能耐受铜盐毒性的细菌,以空气中的氧气为氧化剂将硫化铜氧化成可溶性铜盐,该反应的化学方程式为
(3)反应
 为工业上合成硫酸的非常重要的一步。
为工业上合成硫酸的非常重要的一步。一定温度下,向体积为2L的刚性密闭容器中充入
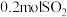 和
和 ,发生该反应。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
,发生该反应。反应过程中容器内某物质的物质的量浓度随时间变化关系如图所示:
①图中曲线表示的是
 ”“
”“ ”或“
”或“ ”)的浓度随时间的变化,2min时
”)的浓度随时间的变化,2min时 的转化率为
的转化率为②0~2min内,用
 表示该反应的速率为
表示该反应的速率为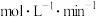 。
。(4)浓硫酸具有强氧化性,但是常温下可用铝槽车运输浓硫酸,原因是
(5)硫代硫酸钠与稀硫酸的反应如下:
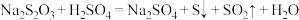 ,在以下条件下进行实验,产生浑浊的时间由短到长依次为
,在以下条件下进行实验,产生浑浊的时间由短到长依次为序号 |
|
| 蒸馏水 | 温度 | ||
A |
| 5mL |
| 5mL | 10mL | 15℃ |
B |
| 5mL |
| 5mL | 10mL | 15℃ |
C |
| 10mL |
| 10mL | 0 | 35℃ |
D |
| 5mL |
| 10mL | 5mL | 35℃ |
您最近一年使用:0次

 溶液
溶液 溶液
溶液



