名校
解题方法
1 . 化学与生活密切相关。下列说法错误的是
| A.雾和霾是气溶胶,PM2.5被认为是造成雾霾天气的“元凶” |
| B.2021年我国科学家以CO2为原料合成淀粉,为缓解温室效应带来新的希望 |
| C.二氧化硫可用作葡萄酒的食品添加剂,用来杀死有害细菌,防止色素被氧化 |
| D.新型水处理剂Na2FeO4利用其强氧化性对病菌和悬浮物进行高效处理 |
您最近一年使用:0次
2022-02-26更新
|
2367次组卷
|
5卷引用:湘豫名校2022届高三1月联考理科综合化学试题
湘豫名校2022届高三1月联考理科综合化学试题(已下线)专项01 化学与STSE-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)广东省茂名高州市校际联盟2021-2022学年高一5月联考化学试题黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题安徽省六安市晓天中学2021-2022学年高一下学期第一次月考化学试题
解题方法
2 . 一种用硫化铜精矿(含CuS、Cu2S及Fe2O3等)为原料制备CuCl的工艺流程如下:
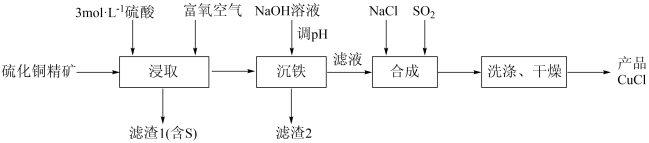
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)“浸取”时,按一定的液固比投料,并加入一定量的催化剂。
①被氧化的元素有___________ (填元素符号)。
② 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
③当浸取时间一定时,不同温度下铜的浸出率与温度的关系如图所示。
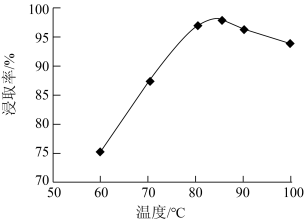
温度低于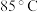 时,温度越高浸出率越大,其原因是
时,温度越高浸出率越大,其原因是___________ ;温度超过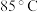 时,温度越高浸出率越小,其原因是
时,温度越高浸出率越小,其原因是___________ 。
(2)“沉铁”时,应将溶液的 范围调整为
范围调整为___________ 。
(3)“合成” 时,发生反应的离子方程式为
时,发生反应的离子方程式为___________ 。
(4)“洗涤”时,依次用 盐酸和乙醇洗,其中用乙醇洗的目的是
盐酸和乙醇洗,其中用乙醇洗的目的是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示: | 金属离子 |  |  |
开始沉淀的 | 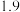 |  |
完全沉淀的 |  |  |
回答下列问题:
(1)“浸取”时,按一定的液固比投料,并加入一定量的催化剂。
①被氧化的元素有
②
 被浸出的化学方程式为
被浸出的化学方程式为③当浸取时间一定时,不同温度下铜的浸出率与温度的关系如图所示。

温度低于
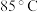 时,温度越高浸出率越大,其原因是
时,温度越高浸出率越大,其原因是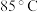 时,温度越高浸出率越小,其原因是
时,温度越高浸出率越小,其原因是(2)“沉铁”时,应将溶液的
 范围调整为
范围调整为(3)“合成”
 时,发生反应的离子方程式为
时,发生反应的离子方程式为(4)“洗涤”时,依次用
 盐酸和乙醇洗,其中用乙醇洗的目的是
盐酸和乙醇洗,其中用乙醇洗的目的是
您最近一年使用:0次
名校
解题方法
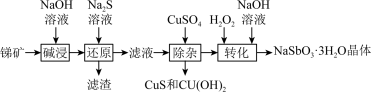
3 . 三水锑酸钠( )常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含
)常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含 、
、 、
、 、
、 等)为原料合成三水锑酸钠的工艺流程如下图。
等)为原料合成三水锑酸钠的工艺流程如下图。
已知:ⅰ.常温下, 、
、 ;
;
ⅱ. 冷水中不溶,溶于硫化钠溶液;
冷水中不溶,溶于硫化钠溶液; 冷水中不溶,热水中发生水解形成胶体。
冷水中不溶,热水中发生水解形成胶体。
(1)“碱浸”和“还原”中加快锑矿浸出速率的具体措施为___________ (任写两条)。
(2)“滤渣”中除了含有 外,还含有
外,还含有___________ (填化学式)。
(3)“还原”步骤中 溶液的作用为
溶液的作用为___________ ; 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
(4)“除杂”步骤后溶液的 ,则此时溶液中
,则此时溶液中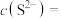
___________ 。
(5)“转化”时发生反应的化学方程式为___________ ;该过程中加入 溶液的目的是
溶液的目的是___________ 。
 )常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含
)常用作显像管、光学玻璃和各种高级玻璃的澄清剂,一种以锑矿(含 、
、 、
、 、
、 等)为原料合成三水锑酸钠的工艺流程如下图。
等)为原料合成三水锑酸钠的工艺流程如下图。
已知:ⅰ.常温下,
 、
、 ;
;ⅱ.
 冷水中不溶,溶于硫化钠溶液;
冷水中不溶,溶于硫化钠溶液; 冷水中不溶,热水中发生水解形成胶体。
冷水中不溶,热水中发生水解形成胶体。(1)“碱浸”和“还原”中加快锑矿浸出速率的具体措施为
(2)“滤渣”中除了含有
 外,还含有
外,还含有(3)“还原”步骤中
 溶液的作用为
溶液的作用为 转化为
转化为 的离子方程式为
的离子方程式为(4)“除杂”步骤后溶液的
 ,则此时溶液中
,则此时溶液中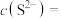
(5)“转化”时发生反应的化学方程式为
 溶液的目的是
溶液的目的是
您最近一年使用:0次
4 . 将有机物转化为高附加值产品是目前一个执门的研究方向。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g) 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
反应Ⅱ C3H8O3(I)+1.5O2(g) 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为_______ 。(答案写成最小整数比)
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是_______ 。
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是_______ 。
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2 La2O2CO3;第二步:
La2O2CO3;第二步:_______ 。(写化学方程式)
③La2O3除了减少积碳外,还可以提高H2的产率,原因是_______ 。
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。
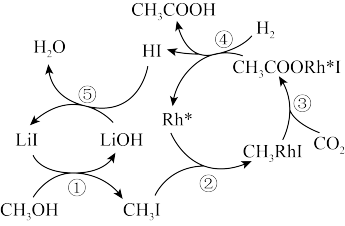
①该反应中的催化剂为_______ 。
②生成1molCH3COOH,最终转移电子_______ mol。
(1)甘油(C3H8O3)和水蒸气、氧气经催化重整或催化氧化可制得氢气,反应如下:
反应I C3H8O3(I)+3H2O(g)
 3CO2(g)+7H2(g) △H1=+128 kJ·mol-1
3CO2(g)+7H2(g) △H1=+128 kJ·mol-1反应Ⅱ C3H8O3(I)+1.5O2(g)
 3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1
3CO2(g)+4H2(g) △H2=-601.6 kJ·mol-1①通过控制C3H8O3、H2O、O2的比例可以实现自热重整,无需加热且保持恒温,此时体系中CO2与H2的物质的量之比为
②反应I除了生成H2,还会生成CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等副产物,为了提高原子利用率,首先要抑制CH4的生成,原因是
(2)高效的催化剂是甘油制氢大规模应用于工业的重要因素。Ni分散在载体(SiC、Al2O3、CeO2)上可以提高催化效率。向装有三种不同催化剂的反应管中匀速通入反应气,连续测定尾气中的甘油转化率,转化率与反应时间的关系如图。

①Ni@SiC催化剂的优点是
②Ni@Al2O3催化剂因头发生副反应产生大量积碳包裹催化剂,一段时间后催化效率迅速下降,通过加入可循环和用的氧化镧(La2O3)可有效减少积碳,La2O3消除积碳的机理如下:第一步:La2O3+ CO2
 La2O2CO3;第二步:
La2O2CO3;第二步:③La2O3除了减少积碳外,还可以提高H2的产率,原因是
(3)种以CH3OH和无机物为原料合成CH3COOH的反应路径如图。

①该反应中的催化剂为
②生成1molCH3COOH,最终转移电子
您最近一年使用:0次
解题方法
5 . 硼氢化钠( )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
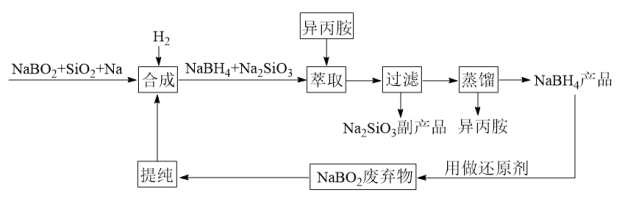
回答下列问题
(1)写出 的电子式
的电子式_______ 。
(2)合成时,需要将石英晶体粉碎,其目的是_______ 。
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和_______ 。
(4)从煤油中取出金属钠后,需要先_______ (简述操作),再用石油醚洗涤。
(5)合成反应中氧化剂与还原剂的质量比为_______ 。
(6)流程中可以循环利用的物质除 外,还有
外,还有_______ 。
(7) 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
 )是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠(
)是一种常用的络合金属氢化物还原剂,在化学反应中有很高的选择性。以硼氢化钠反应后生成的副产物偏硼酸钠( )为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
)为原料,结合改进后的Bayer法制备硼氢化钠的工艺流程如下:
回答下列问题
(1)写出
 的电子式
的电子式(2)合成时,需要将石英晶体粉碎,其目的是
(3)实验室完成过滤时,需要用到的玻璃仪器有漏斗、烧杯和
(4)从煤油中取出金属钠后,需要先
(5)合成反应中氧化剂与还原剂的质量比为
(6)流程中可以循环利用的物质除
 外,还有
外,还有(7)
 做还原剂时需控制溶液为弱碱性.若酸性较强,
做还原剂时需控制溶液为弱碱性.若酸性较强, 易与水反应放出
易与水反应放出 ,写出反应的离子方程式
,写出反应的离子方程式
您最近一年使用:0次
名校
6 .  是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:

已知:i.锰酸钾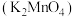 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是_______ (用化学方程式表示)。
(2)步骤Ⅱ中先将一定比例的KOH和 固体放于
固体放于_______ (填仪器名称)中加热至熔融,再分多次小心加入 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)步骤Ⅲ的实验装置如图所示。
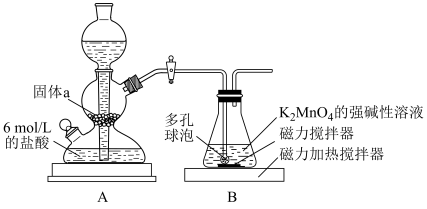
①固体a可以为_______ (填字母序号)。
A. B.
B. C.
C.
②装置B中随着 通入可观察到的现象是
通入可观察到的现象是_______ ,实验需控制 的用量,可能原因是
的用量,可能原因是_______ 。实验结束后,将装置B中溶液过滤,对滤液蒸发浓缩,冷却结晶,过滤、洗涤、干燥即可得到 晶体。
晶体。
③实验装置存在一处缺陷,可能会导致 产率降低,改进的方法是
产率降低,改进的方法是_______ 。
(4)测定 纯度的步骤如下:
纯度的步骤如下:
①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸 溶液250mL。
溶液250mL。
③移取标准草酸溶液25.00mL于锥形瓶中,用所配 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。
④重复3次,平均消耗 溶液29.80mL。
溶液29.80mL。
则产品中 的纯度(质量分数)为
的纯度(质量分数)为_______ %(保留小数点后两位)。
 是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、
是一种用途广泛的重要氧化剂,常用于物质合成、水处理和制药工业。实验室利用废旧普通锌锰电池(主要成分为碳粉、 、MnOOH、
、MnOOH、 、
、 等)为原料制备
等)为原料制备 的过程如下:
的过程如下:
已知:i.锰酸钾
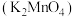 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
ii.已知相关物质的溶解度如图所示

回答下列问题:
(1)步骤Ⅰ的操作包括往废电池糊状填充物中加水,过滤、洗涤、灼烧。其中灼烧的目的主要是
(2)步骤Ⅱ中先将一定比例的KOH和
 固体放于
固体放于 粉末,搅拌并继续加热可得墨绿色固体,其主要成分为
粉末,搅拌并继续加热可得墨绿色固体,其主要成分为 ,加水溶解得到
,加水溶解得到 的强碱性溶液。写出
的强碱性溶液。写出 发生反应的化学方程式为
发生反应的化学方程式为(3)步骤Ⅲ的实验装置如图所示。

①固体a可以为
A.
 B.
B. C.
C.
②装置B中随着
 通入可观察到的现象是
通入可观察到的现象是 的用量,可能原因是
的用量,可能原因是 晶体。
晶体。③实验装置存在一处缺陷,可能会导致
 产率降低,改进的方法是
产率降低,改进的方法是(4)测定
 纯度的步骤如下:
纯度的步骤如下:①称取1.5000g产物晶体,用适量稀硫酸溶解后配成250mL溶液。
②配制0.1000mol/L的标准草酸
 溶液250mL。
溶液250mL。③移取标准草酸溶液25.00mL于锥形瓶中,用所配
 溶液滴定至终点,记录消耗的溶液体积。
溶液滴定至终点,记录消耗的溶液体积。④重复3次,平均消耗
 溶液29.80mL。
溶液29.80mL。则产品中
 的纯度(质量分数)为
的纯度(质量分数)为
您最近一年使用:0次
解题方法
7 . 苯甲酸是一种重要原料。实验室可以用高锰酸钾在中性条件下氧化甲苯(副产品为MnO2)制得,有关数据如下:
合成步骤:
①在装有电动搅拌,温度计和球形冷凝管的三颈烧瓶中加入2.7mL甲苯和100mL蒸馏水,分批加入8.5g高锰酸钾固体,回流4小时。
②反应结束后,趁热过滤,热水洗涤后,冰水冷却,盐酸酸化,抽滤,洗涤,沸水浴干燥得苯甲酸粗品。
回答下列问题;
(1)基态Mn原子的电子排布式:_______ 。
(2)请写出甲苯被高锰酸钾氧化的化学反应方程式:_______ 。
(3)球形冷凝管的作用是_______ ,步骤①中反应完全的现象是_______ 。
(4)实验过程中,发现滤液呈紫色,盐酸酸化时产生了黄绿色气体,酸化操作前加入最理想的_______ 溶液消除过量的高锰酸钾。
A.NaHSO3 B.H2O2 C.Na D.FeCl3
(5)重结晶时,苯甲酸粗品完全溶解后,须补加少量蒸馏水,目的是_______ 。
(6)副产品MnO2是碱式锌锰电池的正极材料,放电时产生MnO(OH),正极的反应式为_______ 。
| 熔点/℃ | 沸点/℃ | 水中溶解度/g(25℃) | 相对分子质量 | 密度/(g·cm-3) | |
| 甲苯 | -94.9 | 110.6 | 难溶 | 92 | 0.85 |
| 苯甲酸 | 122.13 | 249 | 0.344 | 122 | 1.27 |
①在装有电动搅拌,温度计和球形冷凝管的三颈烧瓶中加入2.7mL甲苯和100mL蒸馏水,分批加入8.5g高锰酸钾固体,回流4小时。
②反应结束后,趁热过滤,热水洗涤后,冰水冷却,盐酸酸化,抽滤,洗涤,沸水浴干燥得苯甲酸粗品。
回答下列问题;
(1)基态Mn原子的电子排布式:
(2)请写出甲苯被高锰酸钾氧化的化学反应方程式:
(3)球形冷凝管的作用是
(4)实验过程中,发现滤液呈紫色,盐酸酸化时产生了黄绿色气体,酸化操作前加入最理想的
A.NaHSO3 B.H2O2 C.Na D.FeCl3
(5)重结晶时,苯甲酸粗品完全溶解后,须补加少量蒸馏水,目的是
(6)副产品MnO2是碱式锌锰电池的正极材料,放电时产生MnO(OH),正极的反应式为
您最近一年使用:0次



