解题方法
1 . 四氢铝钠( )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):

回答下列问题:
(1) 中氢的化合价为
中氢的化合价为_______ 。
(2)浸渣的主要成分是_______ (填化学式);“转化”中 的具体作用是
的具体作用是_______ 。
(3)由 制备
制备 的离子方程式为
的离子方程式为_______ ;“分离”中铝元素转化成_______ (填离子符号)。
(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是_______ 。
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为_______ 。
(6)“有效氢”指单位质量(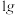 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表_______ (填化学式)。

 )是强还原剂和供氢剂,高铁酸钠(
)是强还原剂和供氢剂,高铁酸钠( )是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为
)是一种绿色净水剂。以工业制备硫酸的烧渣(主要成分为 、
、 和
和 含少量
含少量 )为原料制备四氢铝钠和高铁酸钠的流程如下(已知
)为原料制备四氢铝钠和高铁酸钠的流程如下(已知 是难溶于水的酸性氧化物):
是难溶于水的酸性氧化物):
回答下列问题:
(1)
 中氢的化合价为
中氢的化合价为(2)浸渣的主要成分是
 的具体作用是
的具体作用是(3)由
 制备
制备 的离子方程式为
的离子方程式为(4)“沉铝”后所得滤液经蒸干、灼烧得到固体是
(5)“合成”中乙醚作溶剂,发生反应的化学方程式为
(6)“有效氢”指单位质量(
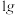 )含氢还原剂的还原能力相当于多少克氢气的还原能力。
)含氢还原剂的还原能力相当于多少克氢气的还原能力。 、
、 的“有效氢”如图所示,则乙代表
的“有效氢”如图所示,则乙代表
您最近一年使用:0次
解题方法
2 . 工业上用电解饱和NaCl溶液生成的氯气为原料生产溴酸钾(KBrO3)的工艺流程如下。下列说法错误的是
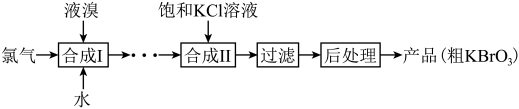

| A.合成Ⅰ中的氧化剂与还原剂的物质的量之比为1:5 |
| B.合成Ⅱ中利用了物质的溶解度差异 |
| C.粗产品KBrO3可通过重结晶进行提纯 |
| D.KBrO3是一种含有共价键的离子化合物 |
您最近一年使用:0次
名校
3 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
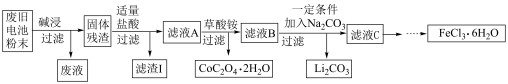
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
268次组卷
|
3卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题
名校
4 . 氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。请回答下列问题。
(1)下列属于氮的固定的是________ 。
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为_____________ 。
(3)三氟化氮( )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。
①写出该反应的化学方程式:___________ ,反应中生成0.2 mol  ,转移的电子数目为
,转移的电子数目为___________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
② 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是___________ 。
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途______ 。
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是_________________ (填“正盐”或“酸式盐”)。
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为_____________ 。
(1)下列属于氮的固定的是
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为
(3)三氟化氮(
 )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。①写出该反应的化学方程式:
 ,转移的电子数目为
,转移的电子数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②
 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
您最近一年使用:0次
5 .  是重要的化学试剂,在实验室和实际生产中应用广泛。
是重要的化学试剂,在实验室和实际生产中应用广泛。
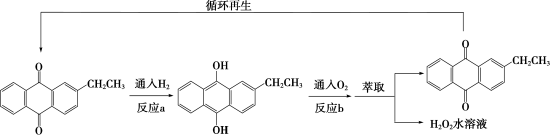
I.蒽醌法是工业上合成 的主要方法,蒽醌法的反应过程如下。
的主要方法,蒽醌法的反应过程如下。
(1)已知:
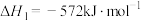
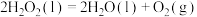
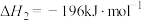
蒽醌法生产 总反应的热化学方程式
总反应的热化学方程式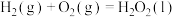

_______ 
(2)反应a的反应类型为_______ 。
(3)向反应b后的溶液可以加入蒸馏水为萃取剂,分析蒸馏水能做萃取剂的原因_______ 。
II.我国科学家设计如下图所示的光电催化体系,该体系利用双极膜既能将 转化为
转化为 所释放的化学能用于驱动阴极
所释放的化学能用于驱动阴极 的高效生成,同时还可以实现烟气脱
的高效生成,同时还可以实现烟气脱 。
。
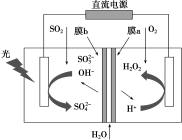
(4)阳极的电极反应为_______ 。
(5)理论上每生成 ,可以实现烟气脱
,可以实现烟气脱 的物质的量为
的物质的量为_______ mol。
III.测定 含量:
含量:
(6)取所得 水溶液amL,用
水溶液amL,用 酸性溶液滴定,消耗
酸性溶液滴定,消耗 酸性溶液vmL。已知:
酸性溶液vmL。已知: 的还原产物是
的还原产物是 。
。
① 酸性溶液与
酸性溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
②所得 水溶液中
水溶液中 的物质的量浓度为
的物质的量浓度为_______  。
。
 是重要的化学试剂,在实验室和实际生产中应用广泛。
是重要的化学试剂,在实验室和实际生产中应用广泛。I.蒽醌法是工业上合成
 的主要方法,蒽醌法的反应过程如下。
的主要方法,蒽醌法的反应过程如下。
(1)已知:

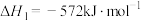
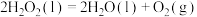
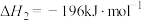
蒽醌法生产
 总反应的热化学方程式
总反应的热化学方程式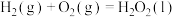


(2)反应a的反应类型为
(3)向反应b后的溶液可以加入蒸馏水为萃取剂,分析蒸馏水能做萃取剂的原因
II.我国科学家设计如下图所示的光电催化体系,该体系利用双极膜既能将
 转化为
转化为 所释放的化学能用于驱动阴极
所释放的化学能用于驱动阴极 的高效生成,同时还可以实现烟气脱
的高效生成,同时还可以实现烟气脱 。
。
(4)阳极的电极反应为
(5)理论上每生成
 ,可以实现烟气脱
,可以实现烟气脱 的物质的量为
的物质的量为III.测定
 含量:
含量:(6)取所得
 水溶液amL,用
水溶液amL,用 酸性溶液滴定,消耗
酸性溶液滴定,消耗 酸性溶液vmL。已知:
酸性溶液vmL。已知: 的还原产物是
的还原产物是 。
。①
 酸性溶液与
酸性溶液与 反应的离子方程式为
反应的离子方程式为②所得
 水溶液中
水溶液中 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
2023-01-09更新
|
500次组卷
|
4卷引用:北京市顺义区2023届高三第一次统练化学试题
6 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以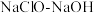 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(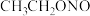 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以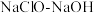 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(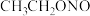 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入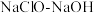 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成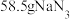 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
名校
解题方法
7 . 三氯氧钒(VOCl3,M=173.5g/mol)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。已知三氯氧钒为黄色液体,密度为1.84g/cm3,熔点为-77℃,沸点为126℃,遇水会迅速水解生成HCl和一种氧化物。某小组同学利用如图装置以氯气、V2O5和碳粉为原料制备三氯氧钒。
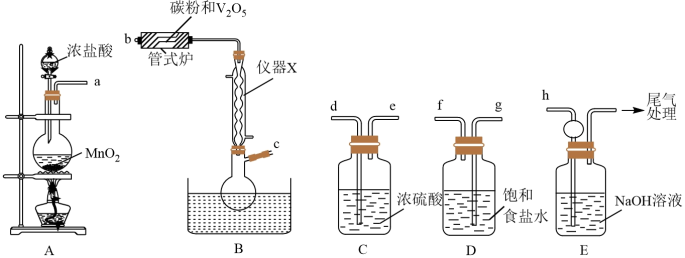
回答下列问题:
(1)仪器X的名称为___________ 。
(2)从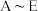 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是___________ (按气流方向,用小写字母表示,装置可重复使用)。
(3)装置A中发生反应的离子方程式为___________ 。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)装置D的作用为___________ 。
(6)装置E的作用为___________ 。
(7)实验过程中正确的加热顺序为___________ (填序号)。
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入 和
和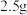 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到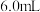 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为___________ (保留3位有效数字)。

回答下列问题:
(1)仪器X的名称为
(2)从
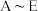 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是(3)装置A中发生反应的离子方程式为
(4)管式炉中发生反应生成CO的化学方程式为
(5)装置D的作用为
(6)装置E的作用为
(7)实验过程中正确的加热顺序为
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入
 和
和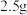 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到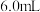 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
您最近一年使用:0次
2023-10-09更新
|
667次组卷
|
4卷引用:河南省名校青桐鸣大联考2024届高三上学期10月联考化学试题
名校
解题方法
8 . 过氧化氢(H2O2)是常用的绿色氧化剂。某化学兴趣小组查阅了H2O2的相关信息,并针对它的某些性质进行了探究,具体如下:H2O2可以通过H2和O2在某催化剂表面直接反应合成,具体原理如下图所示:

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或_______ 粒子(填化学式)。
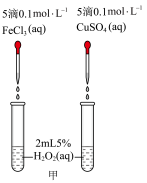
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中_______ 的现象,得出关于FeCl3和CuSO4催化效果的结论。某同学认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是_______ 。若反应30s后注射器中收集到气体的体积为VmL(标准状况),则锥形瓶A中实际产生气体的体积_______ VmL(填“>”、“<”或“=”)。
III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是_______ ,反应生成气体的化学式为_______ 。
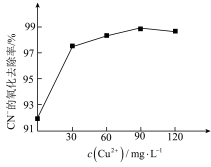
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是_______ 。
(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式_______ 。

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中

(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是

III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是

(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式
您最近一年使用:0次
解题方法
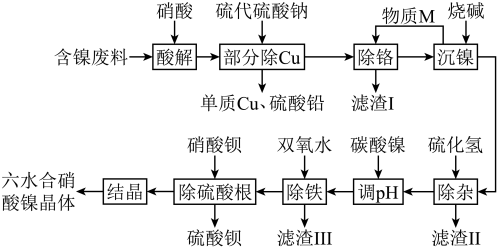
9 . NiCoCr-LDHs是一种新型吸附材料,可用作吸附剂去除水中的有机阴离子污染物,下面是利用含镍工业废料合成其重要原料Ni(NO3)2·6H2O的工艺流程。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为___________ 。
(2)请写出“部分除Cu”工序中除铜的离子方程式:___________ 。
(3)M物质的加入主要是为了调节溶液的pH,则物质M是___________ 。
(4)滤渣Ⅱ的主要成分为ZnS和___________ 。
(5)“除铁”时双氧水的作用是___________ 。
(6)硝酸镍的阴离子的空间构型是___________ 。
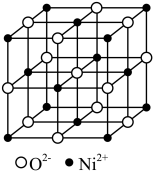
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为___________ 。已知该晶胞的晶胞参数均相同,晶胞内两个O原子的最短距离为apm,设NA为阿伏加德罗常数的值,则该晶体的密度为___________ g•cm-3(写出计算式即可)。
a.Ksp[Ni(OH)₂]=2×10-15,Ksp[Cr(OH)₃]=6.3×10-31,镍的+2价较为稳定;
b.含镍废料中含有Ni、Cr、Fe、Cu、Zn、Pb的化合物,其中Cr元素的存在形式为+3价。
请回答下列问题:
(1)基态Ni的价电子排布式为
(2)请写出“部分除Cu”工序中除铜的离子方程式:
(3)M物质的加入主要是为了调节溶液的pH,则物质M是
(4)滤渣Ⅱ的主要成分为ZnS和
(5)“除铁”时双氧水的作用是
(6)硝酸镍的阴离子的空间构型是
(7)Ni(NO3)2·6H2O经过灼烧可以生成一种Ni的氧化物,其晶胞结构如图。其中Ni的配位数为
您最近一年使用:0次
2023·河北·模拟预测
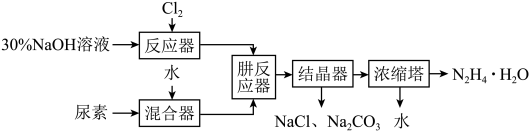
10 . 水合肼( )为无色透明液体,沸点为120℃,具有强还原性,能与水、醇混溶,不溶于乙醚和氯仿,广泛应用于合成农药、水处理剂、发泡剂、引发剂和固化剂等,开发利用前景广阔。工业上利用尿素生产水合肼的流程如图。
)为无色透明液体,沸点为120℃,具有强还原性,能与水、醇混溶,不溶于乙醚和氯仿,广泛应用于合成农药、水处理剂、发泡剂、引发剂和固化剂等,开发利用前景广阔。工业上利用尿素生产水合肼的流程如图。
某兴趣小组设计实验制备水合肼,装置如图。
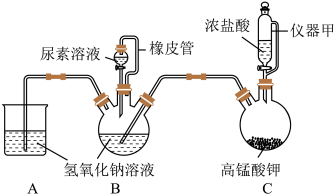
回答下列问题:
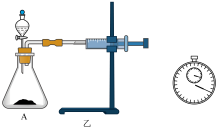
(1)仪器甲的名称是___________ 。橡皮管的作用是___________ 。
(2)实验中先___________ (填“加入过量的尿素溶液”或“通入氯气”),目的是___________ 。
(3)工业上制备水合肼的反应的化学方程式为___________ 。
(4)实验时,装置B要保持在温度较低的水浴中,目的是___________ 。在实验室中可用蒸馏装置代替工业生产中的浓缩塔,蒸馏后烧瓶内留下的是___________ (填“水合肼”或“水”)。
(5)水合肼的纯度测定:取a g样品配成溶液,加入一定量的碳酸氢钠碱化,用(0.1 mol·L
 标准溶液滴定(已知
标准溶液滴定(已知 ),进行三次平行实验,平均消耗
),进行三次平行实验,平均消耗 标准溶液V mL。
标准溶液V mL。
①实验中选用的终点指示剂为___________ 。
②该样品的纯度为___________ %(用含a、V的代数式表示)。
 )为无色透明液体,沸点为120℃,具有强还原性,能与水、醇混溶,不溶于乙醚和氯仿,广泛应用于合成农药、水处理剂、发泡剂、引发剂和固化剂等,开发利用前景广阔。工业上利用尿素生产水合肼的流程如图。
)为无色透明液体,沸点为120℃,具有强还原性,能与水、醇混溶,不溶于乙醚和氯仿,广泛应用于合成农药、水处理剂、发泡剂、引发剂和固化剂等,开发利用前景广阔。工业上利用尿素生产水合肼的流程如图。
某兴趣小组设计实验制备水合肼,装置如图。

回答下列问题:
(1)仪器甲的名称是
(2)实验中先
(3)工业上制备水合肼的反应的化学方程式为
(4)实验时,装置B要保持在温度较低的水浴中,目的是
(5)水合肼的纯度测定:取a g样品配成溶液,加入一定量的碳酸氢钠碱化,用(0.1 mol·L

 标准溶液滴定(已知
标准溶液滴定(已知 ),进行三次平行实验,平均消耗
),进行三次平行实验,平均消耗 标准溶液V mL。
标准溶液V mL。①实验中选用的终点指示剂为
②该样品的纯度为
您最近一年使用:0次



