名校
1 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
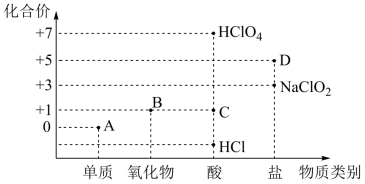
(1)已知D可用于实验室制O2,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M在水溶液中的电离方程式为_______ 。
(3)已知Br2的性质和Cl2有一定的相似性,写出Br2在一定条件下与NaOH溶液反应的离子方程式_______ 。
(4)臭氧氧化技术被广泛用于饮用水的处理,当水中含有Br-时会产生易致癌的BrO 。但水中BrO
。但水中BrO 能被活性炭有效去除,其去除机理分为两步:
能被活性炭有效去除,其去除机理分为两步:
第一步是活性炭吸附BrO
第二步是BrO 被活性炭还原为Br-,
被活性炭还原为Br-,
其反应方程式(未配平)如下:
①_______。
②*C+BrO-→Br- +*CO2
反应的总方程式为:2BrO + 3*C=2Br-+3*CO2 。
+ 3*C=2Br-+3*CO2 。
已知:其中*C代表活性炭表面,*CO2代表活性炭表面氧化物;每步中的*C被氧化为*CO2,则反应①的方程式为_______ ;则反应①与反应②中参加反应的*C个数之比为_______ 。

(1)已知D可用于实验室制O2,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是
(2)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M在水溶液中的电离方程式为
(3)已知Br2的性质和Cl2有一定的相似性,写出Br2在一定条件下与NaOH溶液反应的离子方程式
(4)臭氧氧化技术被广泛用于饮用水的处理,当水中含有Br-时会产生易致癌的BrO
 。但水中BrO
。但水中BrO 能被活性炭有效去除,其去除机理分为两步:
能被活性炭有效去除,其去除机理分为两步:第一步是活性炭吸附BrO

第二步是BrO
 被活性炭还原为Br-,
被活性炭还原为Br-,其反应方程式(未配平)如下:
①_______。
②*C+BrO-→Br- +*CO2
反应的总方程式为:2BrO
 + 3*C=2Br-+3*CO2 。
+ 3*C=2Br-+3*CO2 。已知:其中*C代表活性炭表面,*CO2代表活性炭表面氧化物;每步中的*C被氧化为*CO2,则反应①的方程式为
您最近一年使用:0次
名校
2 . 受疫情影响,自2020年底,芯片短缺就一直占据汽车行业话题榜首。回答相关问题:
Ⅰ.制备高纯硅的主要工艺流程如图所示:
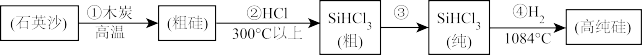
(1)流程①的化学反应方式为___________ 。
(2)流程④的化学反应为置换反应,其化学方程式为___________ 。
Ⅱ.“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(3)硫酸工业排出的尾气(主要含 )有多种处理方式。其中一种方式便是用软锰矿浆
)有多种处理方式。其中一种方式便是用软锰矿浆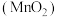 吸收,如图所示。写出“反应1”的化学方程式:
吸收,如图所示。写出“反应1”的化学方程式:___________ 。
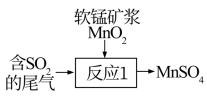
为测定排放气中 的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:
的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:___________ 。
(4)在一定条件下, 可将
可将 转化为无污染的物质。写出
转化为无污染的物质。写出 与
与 在一定条件下反应的化学方程式:
在一定条件下反应的化学方程式:___________ 。
Ⅲ.如图是氮元素的几种化合价与物质类别的对应关系:
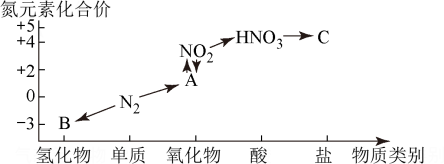
回答下列问题:
(5)实验室制取物质B的化学方程式为___________ 。
(6) 与水反应生成物质A的离子方程式为
与水反应生成物质A的离子方程式为___________ 。
Ⅰ.制备高纯硅的主要工艺流程如图所示:
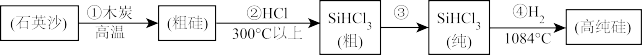
(1)流程①的化学反应方式为
(2)流程④的化学反应为置换反应,其化学方程式为
Ⅱ.“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(3)硫酸工业排出的尾气(主要含
 )有多种处理方式。其中一种方式便是用软锰矿浆
)有多种处理方式。其中一种方式便是用软锰矿浆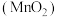 吸收,如图所示。写出“反应1”的化学方程式:
吸收,如图所示。写出“反应1”的化学方程式:
为测定排放气中
 的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:
的含量,可进行了如下实验:将排放气匀速通入一定量酸性高锰酸钾溶液中,进行相关计算,试写出该反应的离子方程式:(4)在一定条件下,
 可将
可将 转化为无污染的物质。写出
转化为无污染的物质。写出 与
与 在一定条件下反应的化学方程式:
在一定条件下反应的化学方程式:Ⅲ.如图是氮元素的几种化合价与物质类别的对应关系:

回答下列问题:
(5)实验室制取物质B的化学方程式为
(6)
 与水反应生成物质A的离子方程式为
与水反应生成物质A的离子方程式为
您最近一年使用:0次
解题方法
3 . 下列古诗或古文中的描述与化学方程式对应关系不正确的是
A.丹砂烧之成水银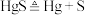 |
B.爆竹声中一岁除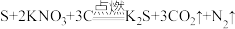 |
C.炉火照天地红星乱紫烟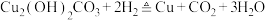 |
D.曾青得铁化为铜 |
您最近一年使用:0次
名校
4 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
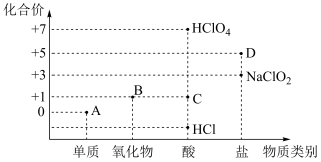
(1)已知D可用于实验室制 ,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是
,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是___________ (填化学式)。
(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于___________ (填“酸性”或“碱性”)氧化物。
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M的电离方程式为___________ 。
(4) 是一种高效的消毒剂和漂白剂。Mathieson法制备
是一种高效的消毒剂和漂白剂。Mathieson法制备 的流程如下:
的流程如下:
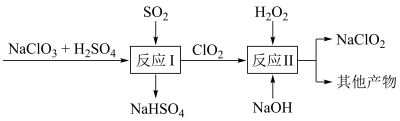
①反应Ⅰ中氧化剂与还原剂的物质的量之比为___________ ;反应Ⅱ中的氧化产物是___________ 。
②与新型消毒剂 比较,
比较, 消毒效率
消毒效率___________  消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是
消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是 )。
)。

(1)已知D可用于实验室制
 ,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是
,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M的电离方程式为
(4)
 是一种高效的消毒剂和漂白剂。Mathieson法制备
是一种高效的消毒剂和漂白剂。Mathieson法制备 的流程如下:
的流程如下:
①反应Ⅰ中氧化剂与还原剂的物质的量之比为
②与新型消毒剂
 比较,
比较, 消毒效率
消毒效率 消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是
消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是 )。
)。
您最近一年使用:0次
5 . 利用物质类别及核心元素的化合价推测物质的性质是研究化学的重要手段。硫元素的常见化合价与部分物质类别的对应关系如图。回答下列问题:
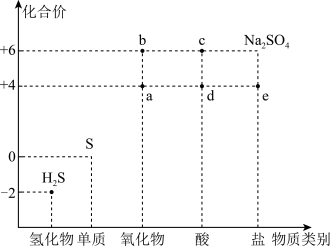
(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:_______ 。
(3)将a排入大气中会引起_______ 。
(4)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4。该反应中的氧化剂是_______ (填化学式)。向反应后的溶液中通入空气能使Fe2(SO4)3溶液再生,写出再生反应的离子方程式:_______ 。
(5)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生_______ 。
(6)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:
①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序_______ (填序号)。

(1)将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为
(2)c的浓溶液能与H2S反应产生一种气体和淡黄色沉淀,写出此反应的化学方程式:
(3)将a排入大气中会引起
(4)硫元素还有一种常见的价态为-1价,如硫铁矿(主要成分为FeS2)中的硫元素。FeS2可以与Fe2(SO4)3溶液发生反应:7Fe2(SO4)3+FeS2+8H2O=15FeSO4+8H2SO4。该反应中的氧化剂是
(5)常温下,c的浓溶液可用铁罐车或铝槽车运输,其原因是铁和铝在常温下遇到c的浓溶液会发生
(6)若要验证木炭与c的浓溶液反应的产物中同时含有气体a和CO2,可选择以下试剂进行实验:
①NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序
您最近一年使用:0次
名校
解题方法
6 . I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
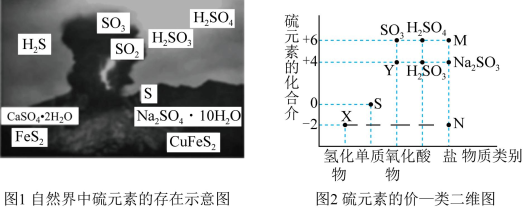
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次
7 . 化学知识在生产生活中有广泛的应用,下列物质的性质与应用有对应关系的是
| A.石墨的熔点很高,可用作干电池电极材料 |
| B.Fe的金属性比Cu强,FeCl3浓溶液可腐蚀Cu用于刻制印刷电路板 |
| C.溴能与很多有机物反应,在药物合成方面有广泛应用 |
| D.NH3断键时要吸收能量,工业上常用液氨作制冷剂 |
您最近一年使用:0次
2021-05-15更新
|
290次组卷
|
4卷引用:河北省邯郸市2021届高考三模化学试题
河北省邯郸市2021届高考三模化学试题(已下线)第18周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题湖北省宜城市第三高级中学2021-2022学年高三上学期期中考试化学试题
名校
8 .  是一种用途极广的稀土材料,可广泛应用于多种研究领域。由
是一种用途极广的稀土材料,可广泛应用于多种研究领域。由 矿制备
矿制备 的工艺流程如下图所示:
的工艺流程如下图所示:
(1) 为镧系的稀土元素,在元素周期表中的位置是
为镧系的稀土元素,在元素周期表中的位置是_______ ,在周期表中共有_______ 种稀土元素。
(2) 是
是_______ (填“复盐”或“混盐”),将 矿粉采用如下图所示方式焙烧的优点是
矿粉采用如下图所示方式焙烧的优点是_______ 。_______ 。
(4)溶解度关系:
_______ 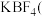 填“
填“ ”或“
”或“ ”)。
”)。
(5)实验室模拟操作N时,检验 是否沉淀完全的操作是
是否沉淀完全的操作是_______ 。若恰好沉淀完全时,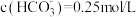 ,则溶液的
,则溶液的
_______ 。已知: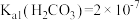 、
、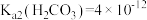 、
、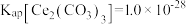 。
。
(6)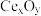 是一种常见的催化剂,用太阳光照射
是一种常见的催化剂,用太阳光照射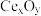 ,当
,当 时,电子吸收能量由M跃迁至N,并形成
时,电子吸收能量由M跃迁至N,并形成 和
和 ,
, 和
和 分别在催化剂表面进行反应,其反应过程如下图所示,则
分别在催化剂表面进行反应,其反应过程如下图所示,则 具有
具有_______ 性(填“氧化”或“还原”,下同),Y为_______ 产物。 具有与
具有与 相似的晶胞结构,若
相似的晶胞结构,若 晶体的密度为
晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶胞的边长为
晶胞的边长为_______ fm。
 是一种用途极广的稀土材料,可广泛应用于多种研究领域。由
是一种用途极广的稀土材料,可广泛应用于多种研究领域。由 矿制备
矿制备 的工艺流程如下图所示:
的工艺流程如下图所示:
(1)
 为镧系的稀土元素,在元素周期表中的位置是
为镧系的稀土元素,在元素周期表中的位置是(2)
 是
是 矿粉采用如下图所示方式焙烧的优点是
矿粉采用如下图所示方式焙烧的优点是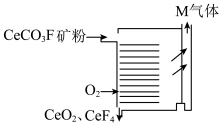
(4)溶解度关系:

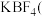 填“
填“ ”或“
”或“ ”)。
”)。(5)实验室模拟操作N时,检验
 是否沉淀完全的操作是
是否沉淀完全的操作是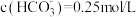 ,则溶液的
,则溶液的
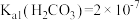 、
、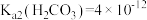 、
、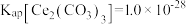 。
。(6)
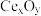 是一种常见的催化剂,用太阳光照射
是一种常见的催化剂,用太阳光照射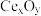 ,当
,当 时,电子吸收能量由M跃迁至N,并形成
时,电子吸收能量由M跃迁至N,并形成 和
和 ,
, 和
和 分别在催化剂表面进行反应,其反应过程如下图所示,则
分别在催化剂表面进行反应,其反应过程如下图所示,则 具有
具有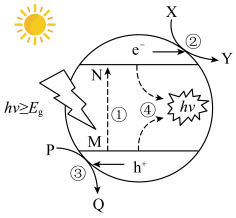
 具有与
具有与 相似的晶胞结构,若
相似的晶胞结构,若 晶体的密度为
晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶胞的边长为
晶胞的边长为
您最近一年使用:0次
名校
9 . 研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)氨气是氮的最简单氢化物,电子式为_______ ,其水溶液呈_______ (填“酸性”、“中性”或“碱性”)。
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是_______ (填选项字母)。
A.硝酸钾 B. C.尿素
C.尿素 D.碳铵
D.碳铵
② 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为_______ g。
(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:_______ 。
(4)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
途径一: 加热到380℃分解,原理为
加热到380℃分解,原理为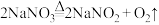 ;
;
途径二:NaOH溶液吸收NO、 气体。
气体。
①写出途径二反应的离子方程式:_______ 。
②制备等量的 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为_______ 。
(1)氨气是氮的最简单氢化物,电子式为
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是
A.硝酸钾 B.
 C.尿素
C.尿素 D.碳铵
D.碳铵②
 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
 消除
消除 的化学反应方程式:
的化学反应方程式:(4)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。途径一:
 加热到380℃分解,原理为
加热到380℃分解,原理为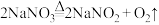 ;
;途径二:NaOH溶液吸收NO、
 气体。
气体。①写出途径二反应的离子方程式:
②制备等量的
 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
解题方法
10 . 亚氯酸钠 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
(1)用 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式___________ 。
(2)用二氧化氯 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。
② 饱和溶液高于
饱和溶液高于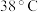 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。
①实验过程中需持续通入一定量的 ,说明原因
,说明原因___________ ;反应结束后需再通入一定量的 ,说明原因
,说明原因___________ 。
②写出装置 中的化学反应方程式
中的化学反应方程式___________ 。
③通入 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法___________ 。
(3)某水样用 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。
①取 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式___________ 。
②已知: ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用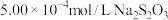 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度___________ (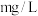 ,不要求计算过程)。
,不要求计算过程)。
 和
和 都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。
都是重要的化工原料,常用作高效、广谱、安全的杀菌消毒剂。(1)用
 和硫酸酸化的草酸
和硫酸酸化的草酸 反应可制得
反应可制得 ,写出该反应的离子方程式
,写出该反应的离子方程式(2)用二氧化氯
 可制备用途广泛的亚氯酸钠
可制备用途广泛的亚氯酸钠 ,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
,实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
 沸点为
沸点为 ,可溶于水,有毒,浓度较高时易发生爆炸。
,可溶于水,有毒,浓度较高时易发生爆炸。②
 饱和溶液高于
饱和溶液高于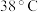 时析出
时析出 ,高于
,高于 时
时 分解为
分解为 和
和 。
。①实验过程中需持续通入一定量的
 ,说明原因
,说明原因 ,说明原因
,说明原因②写出装置
 中的化学反应方程式
中的化学反应方程式③通入
 中的
中的 与
与 中物质恰好完全反应,若从反应后的溶液中得到
中物质恰好完全反应,若从反应后的溶液中得到 固体,写出实验操作的方法
固体,写出实验操作的方法(3)某水样用
 处理后,有少量
处理后,有少量 残留在水中,可用碘量法检测。
残留在水中,可用碘量法检测。①取
 水样,加入过量的
水样,加入过量的 ,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出
,用硫酸酸化,再加入淀粉溶液,溶液变为蓝色。写出 与
与 反应的离子方程式
反应的离子方程式②已知:
 ,向所得溶液中加入适量
,向所得溶液中加入适量 溶液,将溶液调节为弱酸性,再用
溶液,将溶液调节为弱酸性,再用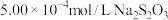 标准溶液进行滴定,恰好反应时消耗
标准溶液进行滴定,恰好反应时消耗 溶液
溶液 。计算水样中
。计算水样中 的浓度
的浓度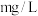 ,不要求计算过程)。
,不要求计算过程)。
您最近一年使用:0次



