名校
解题方法
1 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(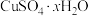 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为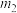 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为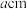 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: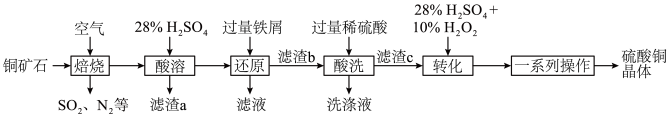
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
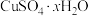 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为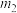 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为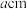 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。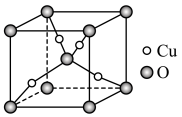
您最近一年使用:0次
2024-04-10更新
|
195次组卷
|
3卷引用:甘肃省2024届高三普通高中三模化学试卷
解题方法
2 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: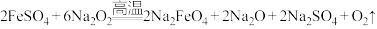 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
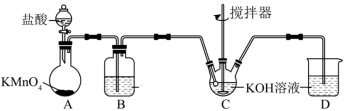
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成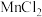 和
和 ,其化学方程式为
,其化学方程式为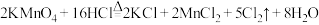 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
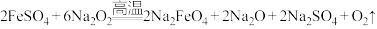 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成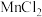 和
和 ,其化学方程式为
,其化学方程式为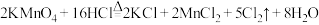 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
名校
3 . 下列关于物质的性质对应用途的说法错误的是
A.高铁酸钾 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 具有强氧化性,能杀菌消毒,所以可以用作消毒剂 |
B. 具有很强的毒性,所以不能用于自来水的杀菌消毒 具有很强的毒性,所以不能用于自来水的杀菌消毒 |
C.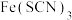 溶液显血红色,所以可以在影视剧中用作替代血液的道具 溶液显血红色,所以可以在影视剧中用作替代血液的道具 |
| D.钛合金因为其生物相容性好,所以可以用作人造骨骼 |
您最近一年使用:0次
2024-02-20更新
|
145次组卷
|
2卷引用:重庆市巴蜀中学校2023-2024学年高一上学期1月期末化学试题
4 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为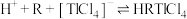 .
.
请回答下列问题:
(1)基态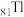 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
(6)通过沉淀法也可以去除工业废水中的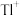 和
和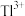 .
.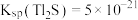 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中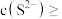
________  (假设污水中铊全部以
(假设污水中铊全部以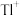 形式存在).
形式存在).
②向含铊废水中加入溴水,使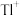 充分氧化成
充分氧化成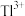 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: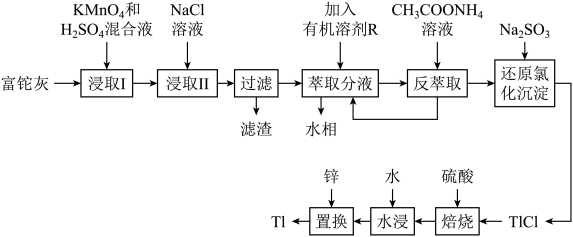
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
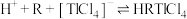 .
.请回答下列问题:
(1)基态
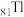 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
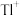 和
和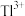 .
.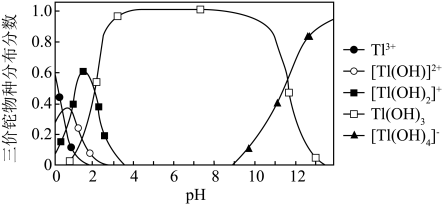
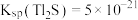 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中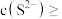
 (假设污水中铊全部以
(假设污水中铊全部以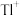 形式存在).
形式存在).②向含铊废水中加入溴水,使
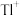 充分氧化成
充分氧化成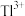 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
解题方法
5 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)氯碱工业的反应原理为 ,该反应中的氧化剂是
,该反应中的氧化剂是___________ 。
(2)为了防止食品变质而添加的抗氧化剂应具有___________ 性。(填“氧化”或“还原”)
(3)电子工业中常用 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为___________ 。
(4) 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性___________ (填“>”或“<”) 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为___________ 。
(1)氯碱工业的反应原理为
 ,该反应中的氧化剂是
,该反应中的氧化剂是(2)为了防止食品变质而添加的抗氧化剂应具有
(3)电子工业中常用
 溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为
溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板,其反应的离子方程式为(4)
 可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应:
可用于制备铬矾、铬颜料等,也是制造火柴头的原料之一。已知反应: ,由此可知
,由此可知 的氧化性
的氧化性 。该反应中氧化剂与还原剂的物质的量之比为
。该反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
6 . 生活中用途广泛的各类“水”中,常表现氧化性的是
| A.卤水 | B.双氧水 |
| C.生理盐水 | D.苏打水 |
您最近一年使用:0次
名校
解题方法
7 . 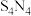 具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: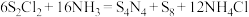 [已知
[已知 (分子结构为
(分子结构为 是硫单质中最稳定的]。下列说法错误的是
是硫单质中最稳定的]。下列说法错误的是

A.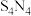 属于分子晶体, 属于分子晶体,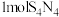 中含有 中含有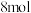 极性键 极性键 |
B.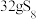 中含有 中含有 非极性键 非极性键 |
C.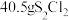 参与上述制备反应,转移 参与上述制备反应,转移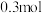 电子 电子 |
D. 的VSEPR模型均为四面体形 的VSEPR模型均为四面体形 |
您最近一年使用:0次
2024-03-03更新
|
387次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
8 . 铁及其化合物在生产生活中有极其重要的用途,请回答下列问题:
(1) 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为________ 。
(2)要实现 转化为
转化为 ,可选用足量的
,可选用足量的________ (填字母)。
①亚硫酸钠溶液 ②稀盐酸 ③酸性 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
(3)某补铁口服液中含有 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加________ ,若溶液变为_____ 色,则说明其已变质。向该口服液中加入维生素C可防止其被氧化变质,利用了维生素C的_____ 性。
(4)激光打印机的墨粉中含有 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为___________ 。往反应后的溶液中滴加少量酸性 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色,_____ (填“能或不能”)说明反应后的溶液中含 。若不能,请说明原因:
。若不能,请说明原因:___________ 。
(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。
①高铁酸钠 中Fe的化合价为
中Fe的化合价为_____ 。
②配平制备 的离子方程式:
的离子方程式:______
__ +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g ,转移电子的数目为
,转移电子的数目为_____ 。
③已知 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因___________ 。
(1)
 溶液可用于刻蚀铜制电路板,该反应的离子方程式为
溶液可用于刻蚀铜制电路板,该反应的离子方程式为(2)要实现
 转化为
转化为 ,可选用足量的
,可选用足量的①亚硫酸钠溶液 ②稀盐酸 ③酸性
 溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液
溶液 ④铁粉 ⑤碘化钾溶液 ⑥过氧化氢溶液(3)某补铁口服液中含有
 ,为检验其是否被氧化变质,可取少量该口服液,向其中滴加
,为检验其是否被氧化变质,可取少量该口服液,向其中滴加(4)激光打印机的墨粉中含有
 。
。 溶于过量的稀盐酸,反应的离子方程式为
溶于过量的稀盐酸,反应的离子方程式为 溶液,酸性
溶液,酸性 溶液褪色,
溶液褪色, 。若不能,请说明原因:
。若不能,请说明原因:(5)高铁酸盐可作为饮用水的消毒剂和净水剂,工业上以
 、
、 、
、 为原料制备高铁酸钾。
为原料制备高铁酸钾。①高铁酸钠
 中Fe的化合价为
中Fe的化合价为②配平制备
 的离子方程式:
的离子方程式:__
 +__
+__ +__=__
+__=__ +__
+__ +__
+__
每生成39.6g
 ,转移电子的数目为
,转移电子的数目为③已知
 ,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
,说明高铁酸盐既可作饮用水的消毒剂又可作净水剂的原因
您最近一年使用:0次
解题方法
9 . 碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如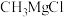 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。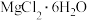 受热分解最终生成MgO。
受热分解最终生成MgO。
碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如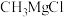 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。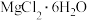 受热分解最终生成MgO。
受热分解最终生成MgO。碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
A.侯氏制碱法中的物质转化: |
B.由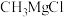 制备乙酸的物质转化: 制备乙酸的物质转化: |
C.电解饱和NaCl溶液的阴极反应: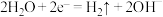 |
D. 与 与 共熔的反应: 共熔的反应: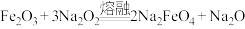 |
您最近一年使用:0次
名校
解题方法
10 . 硫酸亚铁晶体 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。
回答下列问题:
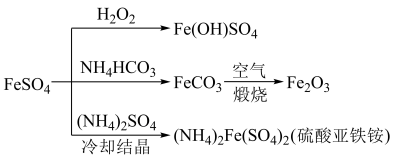
(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是___________ ,通过做实验发现,用 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是___________ 。
(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为___________ 。请写出 一种用途是
一种用途是___________ 。查阅资料知,在不同温度下 被
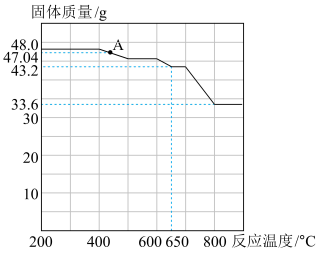
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为___________ 。
(3)实验室还可以利用如图所示装置制备并较长时间观察 白色沉淀。
白色沉淀。
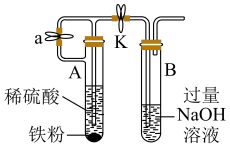
①为了完成实验目的,则装置 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是___________ (填“实线”或“虚线”);
②向装置 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是___________ 。
 俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的
俗称绿矾,是浅蓝绿色单斜晶体,溶于水后显酸性。在空气中逐渐风化,同时被氧化为黄褐色的 。硫酸亚铁的用途广泛,可以制备如下图所示物质。
。硫酸亚铁的用途广泛,可以制备如下图所示物质。回答下列问题:

(1)实验室保存硫酸亚铁溶液时,往往加入一定量的铁粉,其目的是
 氧化硫酸亚铁获得
氧化硫酸亚铁获得 比在空气中被氧化速率快很多,但是
比在空气中被氧化速率快很多,但是 的用量比理论值高很多,其原因是
的用量比理论值高很多,其原因是(2)获取氧化铁过程中,向硫酸亚铁溶液逐滴加入
 溶液,控制
溶液,控制 小于6,经过滤、洗涤、干燥获取纯净的
小于6,经过滤、洗涤、干燥获取纯净的 ,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使
,在空气中煅烧时,需要采用逆流式投料,增大接触面积,加快反应速率同时使 充分反应,则该反应中氧化剂与还原剂的物质的量之比为
充分反应,则该反应中氧化剂与还原剂的物质的量之比为 一种用途是
一种用途是 被
被 还原的产物不同。固体质量与反应温度的关系如图所示。则
还原的产物不同。固体质量与反应温度的关系如图所示。则 点时对应固体化学式为
点时对应固体化学式为
(3)实验室还可以利用如图所示装置制备并较长时间观察
 白色沉淀。
白色沉淀。
①为了完成实验目的,则装置
 中长玻璃管伸到的位置是
中长玻璃管伸到的位置是②向装置
 先加入铁粉,再加入稀硫酸,在装置
先加入铁粉,再加入稀硫酸,在装置 端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
端收集氢气,并检验纯度,当氢气纯度满足实验要求后,进行的操作是
您最近一年使用:0次



