名校
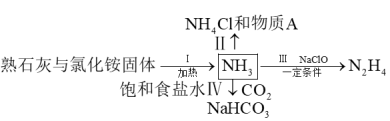
1 .  是重要的化工原料,下列流程涉及
是重要的化工原料,下列流程涉及 的制备与用途。有关说法正确的是
的制备与用途。有关说法正确的是
 是重要的化工原料,下列流程涉及
是重要的化工原料,下列流程涉及 的制备与用途。有关说法正确的是
的制备与用途。有关说法正确的是
| A.过程Ⅰ中,实验室制氨可用氢氧化钠代替熟石灰 |
| B.过程Ⅱ中,物质A是一种高效氮肥 |
| C.过程Ⅲ中,参加反应的氧化剂与还原剂的物质的量之比为2:1 |
D.过程Ⅳ中,反应的离子方程式为: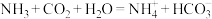 |
您最近一年使用:0次
2 . Ⅰ.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图是硫元素的价类二维图,回答下列问题:

(1) 为
为______ (填物质的类别); 的化学式为
的化学式为______ ;
(2)某同学欲选用如图的部分装置和药品探究: 的性质。
的性质。
上述装置中能体现 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为______________________________________ 。
(3)下图是工业上用黄铁矿(主要成分 )为原料制取绿矾(
)为原料制取绿矾(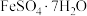 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式:______ 以及反应室中发生的化学方程式:______ ;实验小组在实验室模拟该工艺流程,用75g的黄铁矿制备出了139g绿矾,黄铁矿中 的质量分数约为
的质量分数约为______ 。

Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为:
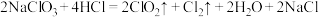
①氧化性:
______ (填“>”或“<”) 。
。
② 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为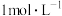 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为______ 。
(5)将下述氧化还原反应配平___________
______ +______
+______ +______
+______
 ______
______ +______
+______ +______
+______

(1)
 为
为 的化学式为
的化学式为(2)某同学欲选用如图的部分装置和药品探究:
 的性质。
的性质。
|
|
|
|
|
A | B | C | D | E |
 具有氧化性的化学反应方程式为
具有氧化性的化学反应方程式为(3)下图是工业上用黄铁矿(主要成分
 )为原料制取绿矾(
)为原料制取绿矾(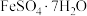 )的工艺流程,已知炉渣的主要成分是
)的工艺流程,已知炉渣的主要成分是 。请写出沸腾炉中发生的化学方程式:
。请写出沸腾炉中发生的化学方程式: 的质量分数约为
的质量分数约为
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(4)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: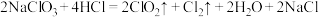
①氧化性:

 。
。②
 和
和 是常见的消毒剂,且还原产物均为
是常见的消毒剂,且还原产物均为 。现将二者的混合气体用足量的
。现将二者的混合气体用足量的 溶液吸收后得到1L的吸收液,并取10mL吸收液检验出
溶液吸收后得到1L的吸收液,并取10mL吸收液检验出 浓度为
浓度为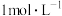 、
、 的浓度为
的浓度为 ,则原混合气体的物质的量为
,则原混合气体的物质的量为(5)将下述氧化还原反应配平
______
 +______
+______ +______
+______
 ______
______ +______
+______ +______
+______
您最近一年使用:0次
3 . 周期表第ⅤA族元素及其化合物用途广泛。 在强碱性条件下能被NaClO氧化生成肼(
在强碱性条件下能被NaClO氧化生成肼( ),常温下
),常温下 呈液态,是常用的火箭燃料。
呈液态,是常用的火箭燃料。 的燃烧热为624kJ/mol,
的燃烧热为624kJ/mol, 可被NaClO氧化生成
可被NaClO氧化生成 ,也可被
,也可被 氧化生成
氧化生成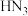 ,
,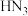 是一种弱酸,酸性与醋酸相当。
是一种弱酸,酸性与醋酸相当。 与
与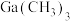 高温条件下可制备半导体材料砷化镓,
高温条件下可制备半导体材料砷化镓,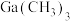 的沸点为55℃。下列化学反应或说法不正确的是
的沸点为55℃。下列化学反应或说法不正确的是
 在强碱性条件下能被NaClO氧化生成肼(
在强碱性条件下能被NaClO氧化生成肼( ),常温下
),常温下 呈液态,是常用的火箭燃料。
呈液态,是常用的火箭燃料。 的燃烧热为624kJ/mol,
的燃烧热为624kJ/mol, 可被NaClO氧化生成
可被NaClO氧化生成 ,也可被
,也可被 氧化生成
氧化生成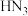 ,
,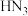 是一种弱酸,酸性与醋酸相当。
是一种弱酸,酸性与醋酸相当。 与
与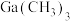 高温条件下可制备半导体材料砷化镓,
高温条件下可制备半导体材料砷化镓,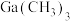 的沸点为55℃。下列化学反应或说法不正确的是
的沸点为55℃。下列化学反应或说法不正确的是A.制备 时,应将 时,应将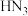 缓缓通入NaClO溶液中 缓缓通入NaClO溶液中 |
B. 与 与 反应方程式为 反应方程式为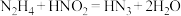 |
C.向 溶液中通入HCl可以制得 溶液中通入HCl可以制得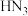 |
D. 燃烧的热化学方程式为: 燃烧的热化学方程式为: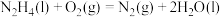  |
您最近一年使用:0次
名校
4 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: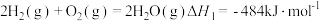
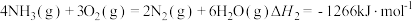
则 的
的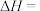
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为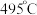 时,
时,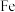 的温度为
的温度为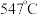 ,而
,而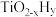 的温度为
的温度为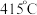 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性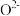 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为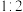 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中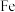 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的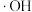 (羟基自由基),
(羟基自由基),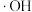 能将
能将 快速氧化为
快速氧化为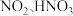 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
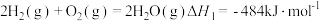
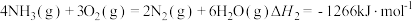
则
 的
的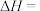
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为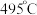 时,
时,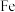 的温度为
的温度为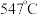 ,而
,而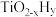 的温度为
的温度为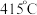 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是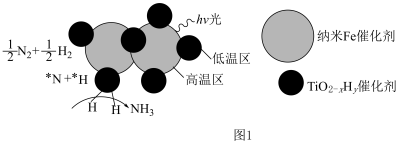
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性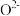 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。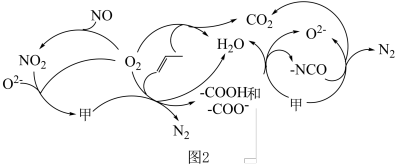
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为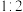 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中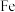 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的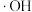 (羟基自由基),
(羟基自由基),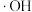 能将
能将 快速氧化为
快速氧化为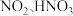 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: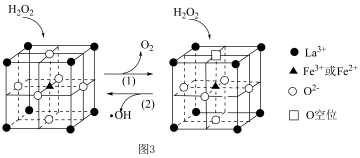
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
5 . 现有下列物质(括号内为对应物质的主要成分):a.熔融NaOH;b.医用酒精;c.蔗糖晶体;d.加碘盐(NaCl和KIO3);e.“84”消毒液(NaClO);f.小苏打(NaHCO3);g.洁厕灵(HCl),回答下列问题:
(1)上述状态下的物质中,属于电解质且能导电的是_______ (填字母,下同);d和f均为厨房中的常用物质,可用于区分两者的物质是________ 。
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:________ 。
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:___________ ;该反应中被氧化的Ⅰ原子与被还原的Ⅰ原子的个数之比为___________ 。
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:_____ ,__NaClO2+__NaHSO4=___ClO2+___NaCl+__Na2SO4+____H2O;若每片泡腾片中NaClO2的质量分数≥17%为合格品,上述所得ClO2溶液的物质的量浓度为0.002mol/L,则所用泡腾片____ (填“属于”或“不属于”)合格品。
(1)上述状态下的物质中,属于电解质且能导电的是
(2)生活中若将“84”消毒液和洁厕灵混合易产生黄绿色有毒气体,写出该反应的离子方程式:
(3)碘酸钾(KIO3)可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另—种化合物,写出该反应的化学方程式:
(4)二氧化氯泡腾片(有效成分为NaClO2和NaHSO4)也是一种用途广泛的消毒用品,将1片(规格为1g/片)二氧化氯泡腾片溶于1L水中,得到ClO2溶液(假设ClO2全部溶于水且反应后溶液体积仍为1L)。补全生成ClO2的化学方程式:
您最近一年使用:0次
名校
6 . 钠及其化合物在生活和生产中有重要用途。
(1) 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: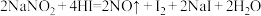 。请回答:
。请回答:
①上述反应中,氧化产物是___________ (填化学式),其中HI在反应中体现出的性质为___________ (填字母)。
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ (填字母)。
A.NaClO B. C.
C. D.
D.
(2) 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
①写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为___________ 。
③将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是___________ (填离子符号)。
(3) 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
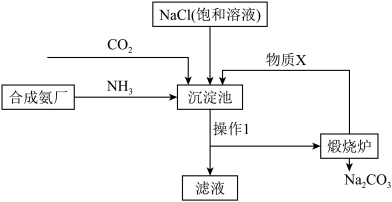
①上述流程中,物质X是___________ (填化学式)。
②写出沉淀池的化学反应方程式___________ 。
③下列关于侯德榜“联合制碱法”说法错误的是___________ (填字母)。
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
(1)
 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: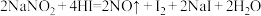 。请回答:
。请回答:①上述反应中,氧化产物是
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.NaClO B.
 C.
C. D.
D.
(2)
 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。①写出
 与
与 反应的化学方程式
反应的化学方程式②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的
 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为③将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是(3)
 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
①上述流程中,物质X是
②写出沉淀池的化学反应方程式
③下列关于侯德榜“联合制碱法”说法错误的是
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通
 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
您最近一年使用:0次
名校
解题方法
7 . 砷及其化合物有着广泛的用途,但也会严重危害环境安全和人体健康。
(1)雌黄( )和雄黄(
)和雄黄(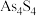 )都是提取砷的主要矿物原料。砷元素有
)都是提取砷的主要矿物原料。砷元素有 、
、 、
、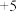 等常见价态。
等常见价态。
①如图为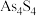 分子的空间结构模型。已知
分子的空间结构模型。已知 分子中没有π键,其结构式可表示为
分子中没有π键,其结构式可表示为______ 。

②将含砷废渣(主要成分是 )制成浆料再通入
)制成浆料再通入 氧化,转化为
氧化,转化为 和单质硫,是工业提取砷元素的途径之一、写出
和单质硫,是工业提取砷元素的途径之一、写出 转化为
转化为 的化学方程式
的化学方程式___________ ;该反应需要在加压下进行,原因是___________ 。
(2) 可转化为用于治疗白血病的亚砷酸(
可转化为用于治疗白血病的亚砷酸( )。
)。 在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图所示。
在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图所示。

① 的电离常数分别为
的电离常数分别为 、
、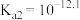 、
、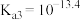 ,则a点
,则a点
___________ 。
②工业含 废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生
废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中
胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中 的去除率如图所示。在
的去除率如图所示。在 溶液中,pH越大,铁盐混凝剂去除水中
溶液中,pH越大,铁盐混凝剂去除水中 的速率越快,原因是
的速率越快,原因是___________ 。

(3)水体中 的毒性远高于
的毒性远高于 且
且 更易除去,常用的处理方法是先将废水中的
更易除去,常用的处理方法是先将废水中的 氧化为
氧化为 ,再通过一定方法除去
,再通过一定方法除去 。
。
① 可被
可被 进一步氧化为
进一步氧化为 。
。 的酸性
的酸性___________  的酸性(填“>”或“<”)。
的酸性(填“>”或“<”)。
②在 的水溶液中,以
的水溶液中,以 为沉淀剂,可将
为沉淀剂,可将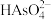 转化为
转化为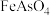 沉淀除去,其离子方程式为
沉淀除去,其离子方程式为___________ 。[已知: ,
, ]
]
(1)雌黄(
 )和雄黄(
)和雄黄(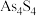 )都是提取砷的主要矿物原料。砷元素有
)都是提取砷的主要矿物原料。砷元素有 、
、 、
、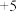 等常见价态。
等常见价态。①如图为
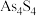 分子的空间结构模型。已知
分子的空间结构模型。已知 分子中没有π键,其结构式可表示为
分子中没有π键,其结构式可表示为
②将含砷废渣(主要成分是
 )制成浆料再通入
)制成浆料再通入 氧化,转化为
氧化,转化为 和单质硫,是工业提取砷元素的途径之一、写出
和单质硫,是工业提取砷元素的途径之一、写出 转化为
转化为 的化学方程式
的化学方程式(2)
 可转化为用于治疗白血病的亚砷酸(
可转化为用于治疗白血病的亚砷酸( )。
)。 在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图所示。
在水溶液中存在多种微粒形态,各种微粒的物质的量分数与溶液pH关系如图所示。
①
 的电离常数分别为
的电离常数分别为 、
、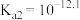 、
、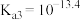 ,则a点
,则a点
②工业含
 废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生
废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中
胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中 的去除率如图所示。在
的去除率如图所示。在 溶液中,pH越大,铁盐混凝剂去除水中
溶液中,pH越大,铁盐混凝剂去除水中 的速率越快,原因是
的速率越快,原因是
(3)水体中
 的毒性远高于
的毒性远高于 且
且 更易除去,常用的处理方法是先将废水中的
更易除去,常用的处理方法是先将废水中的 氧化为
氧化为 ,再通过一定方法除去
,再通过一定方法除去 。
。①
 可被
可被 进一步氧化为
进一步氧化为 。
。 的酸性
的酸性 的酸性(填“>”或“<”)。
的酸性(填“>”或“<”)。②在
 的水溶液中,以
的水溶液中,以 为沉淀剂,可将
为沉淀剂,可将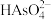 转化为
转化为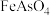 沉淀除去,其离子方程式为
沉淀除去,其离子方程式为 ,
, ]
]
您最近一年使用:0次
2024-01-01更新
|
540次组卷
|
3卷引用:江苏省南京师范大学附属中学2023-2024学年高三上学期期中考试 化学试卷
名校
8 . 氮、磷元素的单质和它们的化合物用途广泛,与生产、生活有密切关系。请回答下列问题。
(1)下列属于氮的固定的是________ 。
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为_____________ 。
(3)三氟化氮( )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。
①写出该反应的化学方程式:___________ ,反应中生成0.2 mol  ,转移的电子数目为
,转移的电子数目为___________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
② 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是___________ 。
(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途______ 。
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是_________________ (填“正盐”或“酸式盐”)。
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为_____________ 。
(1)下列属于氮的固定的是
a. 工业上N2和H2合成NH3 b. NH3催化氧化生成NO
c. N2和O2放电条件下生成NO d. NH3与灼热的氧化铜反应生成N2
(2)N2H4(联氨)可用作喷气式发动机推进剂、火箭燃料,可由次氯酸钠与氨反应制取,其化学反应方程式为
(3)三氟化氮(
 )是一种无色、无味的气体,是微电子工业技术的关键原料之一,
)是一种无色、无味的气体,是微电子工业技术的关键原料之一, 在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和
在潮湿的空气中与水蒸气能发生氧化还原反应,该反应的产物有:HF、NO和 。
。①写出该反应的化学方程式:
 ,转移的电子数目为
,转移的电子数目为 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。②
 无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是
无色、无臭,可一旦在空气中泄漏,却易于发现,判断该气体泄漏的现象是(4)Si3N4是一种性能优异的无机非金属材料,它的熔点高硬度大,电绝缘性好,化学性质稳定,但生产成本较高。根据以上描述推测Si3N4可能有哪些用途
a. 制作坩埚 b. 用作建筑陶瓷 c. 制作耐高温轴承 d. 制作切削刀具
(5)磷元素可以形成多种含氧酸。
①已知4.0g NaOH最多可中和100 mL 1mol·L−1 H3PO2溶液,则NaH2PO2是
②已知常温下酸性:H3PO3 > CH3COOH > H2PO3-,则H3PO3与足量CH3COONa溶液混合的离子反应方程式为
您最近一年使用:0次
解题方法
9 . 纳米 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
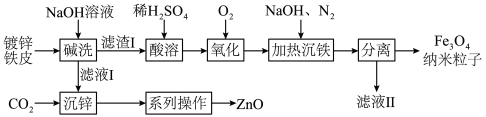
查阅资料: 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。
回答下列问题:
(1)“碱洗”时, 溶液的作用是
溶液的作用是___________________ 。
(2)“沉锌”时,选用 而不用盐酸的依据是
而不用盐酸的依据是___________________ ,该反应的离子方程式为__________________________ 。
(3)“系列操作”包括过滤、____________ 。
(4)“氧化”后的溶液中所含金属阳离子有________________________ (填离子符号)。
(5)文献表明,若“氧化”时,溶液 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______________________ 。
(6)检验“分离”得到的 是否洗净的操作为
是否洗净的操作为______________________ 。
(7)某化学兴趣小组用 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为______ (保留三位有效数字)。
 在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含
在生物医学等方面具有广泛的用途。利用废旧镀锌铁皮(含 、
、 、
、 、
、 )制备纳米
)制备纳米 及副产物
及副产物 的流程如下:
的流程如下:
查阅资料:
 、
、 、
、 的化学性质与铝及其化合物类似。
的化学性质与铝及其化合物类似。回答下列问题:
(1)“碱洗”时,
 溶液的作用是
溶液的作用是(2)“沉锌”时,选用
 而不用盐酸的依据是
而不用盐酸的依据是(3)“系列操作”包括过滤、
(4)“氧化”后的溶液中所含金属阳离子有
(5)文献表明,若“氧化”时,溶液
 过低,
过低, 容易转化为
容易转化为 ,该反应的化学方程式为
,该反应的化学方程式为(6)检验“分离”得到的
 是否洗净的操作为
是否洗净的操作为(7)某化学兴趣小组用
 废旧镀锌铁皮(
废旧镀锌铁皮( 元素的质量分数为
元素的质量分数为 )制备纳米
)制备纳米 ,最终得到
,最终得到 产品,则产率为
产品,则产率为
您最近一年使用:0次
10 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近一年使用:0次