名校
1 . 含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺( 、
、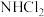 和
和 )等。
)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________ (填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________ 。
②将
 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为________  。
。
(2) 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________ 。
(3)把 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________ 。
(4)二氧化氯( )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式_________________ 。
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(
 、
、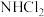 和
和 )等。
)等。①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于
②将

 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为 。
。(2)
 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为(3)把
 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为(4)二氧化氯(
 )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式
您最近一年使用:0次
解题方法
2 . 碱金属和碱土金属元素分别位于元素周期表的ⅠA族和ⅡA族,它们的化合物应用广泛。历史上曾以NaCl为原料生产NaOH作为化学工业开端的标志。 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如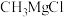 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。
碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
 可由侯氏制碱法获得。
可由侯氏制碱法获得。 是强氧化剂,熔融条件下可将
是强氧化剂,熔融条件下可将 氧化为
氧化为 。格氏试剂(如
。格氏试剂(如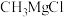 )在有机化学中有重要用途,但易与空气中的
)在有机化学中有重要用途,但易与空气中的 等发生反应。盐卤水中含有
等发生反应。盐卤水中含有 ,常用于豆制品加工。
,常用于豆制品加工。 受热分解最终生成MgO。
受热分解最终生成MgO。碱金属及碱土金属元素及其化合物的转化具有重要应用。下列说法不正确的是
A.侯氏制碱法中的物质转化: |
B.由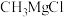 制备乙酸的物质转化: 制备乙酸的物质转化: |
C.电解饱和NaCl溶液的阴极反应: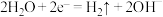 |
D. 与 与 共熔的反应: 共熔的反应: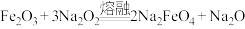 |
您最近一年使用:0次
3 . 氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)已知铋(Bi)为+3价时较稳定,铋酸钠( )溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰(
)溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰( )溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
则 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
(2)碘酸钾( )是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备
)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备 的方法是将
的方法是将 与KOH溶液共热,生成
与KOH溶液共热,生成 、
、 和另一种化合物。
和另一种化合物。
①该反应中被氧化的I原子与被还原的I原子的个数之比为___________ 。
②已知 ,则检验食盐中含
,则检验食盐中含 时,除食盐外至少还需要下列试剂中的哪几种
时,除食盐外至少还需要下列试剂中的哪几种___________ (填字母)
a.稀硝酸 b.食醋 c.淀粉溶液 d.蒸馏水 e.KI固体 f.KI-淀粉试纸
③碘酸钾在酸性环境下可以与亚硫酸钠反应制备碘单质,完成下面的离子方程式:______________ 。
 。
。
(3)某反应体系有反应物和生成物共7种: 、
、 、
、 、
、 、
、 、
、 、
、 。已知该反应过程中产生气泡,试回答下列问题:
。已知该反应过程中产生气泡,试回答下列问题:
①该反应中,还原剂是___________ (填化学式)。
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移方向和数目___________ 。
(1)已知铋(Bi)为+3价时较稳定,铋酸钠(
 )溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰(
)溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰( )溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)碘酸钾(
 )是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备
)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备 的方法是将
的方法是将 与KOH溶液共热,生成
与KOH溶液共热,生成 、
、 和另一种化合物。
和另一种化合物。①该反应中被氧化的I原子与被还原的I原子的个数之比为
②已知
 ,则检验食盐中含
,则检验食盐中含 时,除食盐外至少还需要下列试剂中的哪几种
时,除食盐外至少还需要下列试剂中的哪几种a.稀硝酸 b.食醋 c.淀粉溶液 d.蒸馏水 e.KI固体 f.KI-淀粉试纸
③碘酸钾在酸性环境下可以与亚硫酸钠反应制备碘单质,完成下面的离子方程式:
 。
。(3)某反应体系有反应物和生成物共7种:
 、
、 、
、 、
、 、
、 、
、 、
、 。已知该反应过程中产生气泡,试回答下列问题:
。已知该反应过程中产生气泡,试回答下列问题:①该反应中,还原剂是
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移方向和数目
您最近一年使用:0次
名校
解题方法
4 . 铁的化合物在生活、生产中用途十分广泛。回答下列问题:
(1)高铁酸钠( )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:
i.向 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;
ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得 。
。
已知:H2O2溶液可将 氧化为
氧化为 。
。
① 中铁元素的化合价为
中铁元素的化合价为___________ ,其在处理水时既能起到杀菌消毒作用,又能起到净水作用的原因是___________ 。
②加入H2O2溶液时发生反应的离子方程式为___________ ,该步反应不能在较高温度下进行的原因是___________ 。
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为___________ ,用单线桥标出电子转移的方向和数目:___________ 。
(2)无水 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):

①在E处收集产物是利用了
___________ 的性质。
②实验过程中若D、E之间出现堵塞,可通过___________ (填简单操作),使实验能继续进行。
③某同学用5.60g干燥铁粉制得无水 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是___________ 。
④无水 的作用是
的作用是___________ 。
(1)高铁酸钠(
 )是一种新型绿色消毒剂,能以
)是一种新型绿色消毒剂,能以 溶液为原料,经氧化制得,步骤如下:
溶液为原料,经氧化制得,步骤如下:i.向
 溶液中加入稀硫酸酸化;
溶液中加入稀硫酸酸化;ii.在30℃左右加入H2O2溶液搅拌;
iii.再依次向其中加入NaOH溶液、NaClO溶液;
iv.经分离可得
 。
。已知:H2O2溶液可将
 氧化为
氧化为 。
。①
 中铁元素的化合价为
中铁元素的化合价为②加入H2O2溶液时发生反应的离子方程式为
③加入NaOH溶液后,再加入NaClO溶液时发生反应的化学方程式为
(2)无水
 (易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水
(易与H2O反应而变质、易升华)是常用的芳香烃取代反应催化剂。铁粉与氯气反应制备无水 的实验装置如图所示(E用来收集产物):
的实验装置如图所示(E用来收集产物):
①在E处收集产物是利用了

②实验过程中若D、E之间出现堵塞,可通过
③某同学用5.60g干燥铁粉制得无水
 13.00g,该次实验的产率(
13.00g,该次实验的产率( )是
)是④无水
 的作用是
的作用是
您最近一年使用:0次
名校
解题方法
5 . 物质类别和元素价态是我们分析、预测、探究元素化合物性质的两大基本角度。
I.现有混有少量 杂质的
杂质的 气体,若要除去
气体,若要除去 杂质,我们需要了解
杂质,我们需要了解 和
和 在性质方面的联系与区别。
在性质方面的联系与区别。
(1)从物质类别角度分析, 和
和 均属于酸性氧化物。预测
均属于酸性氧化物。预测 具有酸性氧化物的共性,如可与
具有酸性氧化物的共性,如可与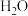 反应。
反应。
①请再列举1例,并写出反应的化学方程式_______ 。
②已知酸性: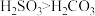 。若要除去
。若要除去 中的
中的 杂质,可选择的试剂是
杂质,可选择的试剂是_______ 。
A.稀 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液
(2)从元素化合价角度分析, 中硫元素为
中硫元素为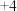 价,可升高至
价,可升高至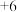 价,预测
价,预测 具有还原性。请选用适当的试剂和必要的实验装置,阴去
具有还原性。请选用适当的试剂和必要的实验装置,阴去 中的
中的 杂质,并收集纯净干燥的
杂质,并收集纯净干燥的 。(资料显示,还原性:
。(资料显示,还原性: )
)
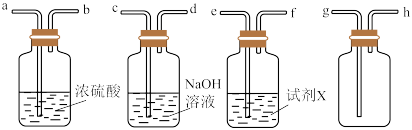
①试剂X可以选择下列哪种试剂_______ 。
A.酸性 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
写出所选试剂与 反应的离子方程式
反应的离子方程式_______ 。
②按气流从左到右,各接口连接顺序为_______ 。
Ⅱ.是一种白色粉末,微溶于水,广泛用于水产养殖、污水处理等领域
(3) 中O的化合价为
中O的化合价为_______ ,预测 可用作
可用作_______ (答一点用途)。 遇
遇 会反应变质,反应的化学方程式为
会反应变质,反应的化学方程式为_______ 。
(4)利用下图装置制 (难溶于冷水)。(已知:过氧化氢是一种极弱的酸,因此金属过氧化物可视作是过氧化氢对应的盐)
(难溶于冷水)。(已知:过氧化氢是一种极弱的酸,因此金属过氧化物可视作是过氧化氢对应的盐)

书写制备 的离子方程式
的离子方程式_______ 。
I.现有混有少量
 杂质的
杂质的 气体,若要除去
气体,若要除去 杂质,我们需要了解
杂质,我们需要了解 和
和 在性质方面的联系与区别。
在性质方面的联系与区别。(1)从物质类别角度分析,
 和
和 均属于酸性氧化物。预测
均属于酸性氧化物。预测 具有酸性氧化物的共性,如可与
具有酸性氧化物的共性,如可与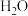 反应。
反应。①请再列举1例,并写出反应的化学方程式
②已知酸性:
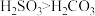 。若要除去
。若要除去 中的
中的 杂质,可选择的试剂是
杂质,可选择的试剂是A.稀
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液(2)从元素化合价角度分析,
 中硫元素为
中硫元素为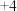 价,可升高至
价,可升高至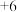 价,预测
价,预测 具有还原性。请选用适当的试剂和必要的实验装置,阴去
具有还原性。请选用适当的试剂和必要的实验装置,阴去 中的
中的 杂质,并收集纯净干燥的
杂质,并收集纯净干燥的 。(资料显示,还原性:
。(资料显示,还原性: )
)
①试剂X可以选择下列哪种试剂
A.酸性
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液写出所选试剂与
 反应的离子方程式
反应的离子方程式②按气流从左到右,各接口连接顺序为
Ⅱ.是一种白色粉末,微溶于水,广泛用于水产养殖、污水处理等领域
(3)
 中O的化合价为
中O的化合价为 可用作
可用作 遇
遇 会反应变质,反应的化学方程式为
会反应变质,反应的化学方程式为(4)利用下图装置制
 (难溶于冷水)。(已知:过氧化氢是一种极弱的酸,因此金属过氧化物可视作是过氧化氢对应的盐)
(难溶于冷水)。(已知:过氧化氢是一种极弱的酸,因此金属过氧化物可视作是过氧化氢对应的盐)
书写制备
 的离子方程式
的离子方程式
您最近一年使用:0次
2023-11-24更新
|
109次组卷
|
2卷引用:河北省石家庄市第二中学2023-2024学年高一上学期期中考试化学试题
解题方法
6 .  是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺流程如图所示。
水合物的工艺流程如图所示。
 是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺流程如图所示。
水合物的工艺流程如图所示。
| A.反应釜1需在隔绝空气条件下进行 |
| B.适当升温和搅拌,可提高反应釜中的反应速率 |
C.进入反应釜1和2的 的物质的量之比宜为2∶1 的物质的量之比宜为2∶1 |
D.实验室进行“滤液 水合物”的操作为加热浓缩、冷却结晶、过滤等 水合物”的操作为加热浓缩、冷却结晶、过滤等 |
您最近一年使用:0次
名校
解题方法
7 . 硅及其化合物在生产生活中有重要用途。
(1)用氮化硅 陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为
陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为 。
。
① 的电子式为
的电子式为___________ 。
②若该反应转移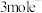 ,生成
,生成 的质量为
的质量为___________ g。
(2)芯片制作中的部分流程如图: 溶液与单晶硅反应生成
溶液与单晶硅反应生成 溶液,
溶液, 溶液俗称水玻璃,水玻璃可用作
溶液俗称水玻璃,水玻璃可用作___________ 。
②扩散制结过程发生反应I. ;反应Ⅱ.
;反应Ⅱ.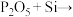
 。
。
配平反应Ⅱ.___________ 
___________ Si=___________ SiO2+___________ P,该反应的反应类型为___________ (填四大基本反应类型)。
③去除磷硅玻璃即除去扩散制结过程中产生的 ,下列试剂合适的为
,下列试剂合适的为___________ (填标号),写出其化学方程式:___________ 。
a.浓硫酸 b.氢氟酸 c.稀硝酸
(1)用氮化硅
 陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为
陶瓷制造发动机,能大幅度提高发动机的热效率。工业上制备氮化硅的原理为 。
。①
 的电子式为
的电子式为②若该反应转移
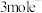 ,生成
,生成 的质量为
的质量为(2)芯片制作中的部分流程如图:

 溶液与单晶硅反应生成
溶液与单晶硅反应生成 溶液,
溶液, 溶液俗称水玻璃,水玻璃可用作
溶液俗称水玻璃,水玻璃可用作②扩散制结过程发生反应I.
 ;反应Ⅱ.
;反应Ⅱ.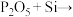
 。
。配平反应Ⅱ.

③去除磷硅玻璃即除去扩散制结过程中产生的
 ,下列试剂合适的为
,下列试剂合适的为a.浓硫酸 b.氢氟酸 c.稀硝酸
您最近一年使用:0次
2024-04-28更新
|
60次组卷
|
2卷引用:辽宁省部分高中2023-2024学年高一下学期4月月考化学试题
名校
8 . 卤素化合物在生产生活中具有广泛的用途。碘酸钾( )常用于调节缺碘的添加剂。碘酸
)常用于调节缺碘的添加剂。碘酸 易溶于水,不溶于有机溶剂,用作分析试剂与制造药物。
易溶于水,不溶于有机溶剂,用作分析试剂与制造药物。
(1)制取 :先将一定量
:先将一定量 固体与碘水或盐酸其中一种浴液混合后加入三颈瓶(如下图)。再用分液漏斗将另一种溶液缓慢滴加至三颈瓶中,充分反应,该溶液是
固体与碘水或盐酸其中一种浴液混合后加入三颈瓶(如下图)。再用分液漏斗将另一种溶液缓慢滴加至三颈瓶中,充分反应,该溶液是___________ (填名称)。 水浴加热,反应生成
水浴加热,反应生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。

(2)制备 :
:

①用上图所示的装置制取碘酸。 的作用
的作用___________ 。
②三颈瓶中发生反应的离子方程式为___________ 。
③除去 溶液中少量的
溶液中少量的 的实验操作是:
的实验操作是:___________ 。
 )常用于调节缺碘的添加剂。碘酸
)常用于调节缺碘的添加剂。碘酸 易溶于水,不溶于有机溶剂,用作分析试剂与制造药物。
易溶于水,不溶于有机溶剂,用作分析试剂与制造药物。(1)制取
 :先将一定量
:先将一定量 固体与碘水或盐酸其中一种浴液混合后加入三颈瓶(如下图)。再用分液漏斗将另一种溶液缓慢滴加至三颈瓶中,充分反应,该溶液是
固体与碘水或盐酸其中一种浴液混合后加入三颈瓶(如下图)。再用分液漏斗将另一种溶液缓慢滴加至三颈瓶中,充分反应,该溶液是 水浴加热,反应生成
水浴加热,反应生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为
(2)制备
 :
:
①用上图所示的装置制取碘酸。
 的作用
的作用②三颈瓶中发生反应的离子方程式为
③除去
 溶液中少量的
溶液中少量的 的实验操作是:
的实验操作是:
您最近一年使用:0次
2023-09-10更新
|
195次组卷
|
2卷引用:江苏省泗阳中学2022-2023学年高一上学期1月期末化学试题
名校
解题方法
9 . 铁及其化合物在生产生活中有着广泛的用途。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式: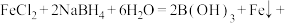
______ 。
②相同条件下,向水样Ⅰ和Ⅱ(含少量( )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中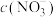 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是______ 。
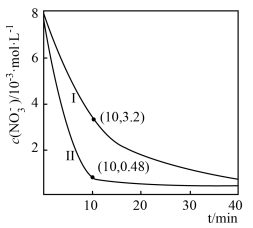
③在0~10 min内,Ⅱ中 的平均反应速率为
的平均反应速率为______ 。
(2)KSCN溶液可检验水样中的 .发生的反应为
.发生的反应为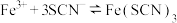 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。
(3)邻苯二酚类配体( )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、 、
、 、
、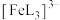 、
、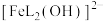 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
已知: 及
及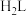 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,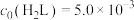 mol⋅L
mol⋅L 。
。
常温下,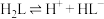
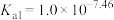 ,
,
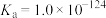 。
。
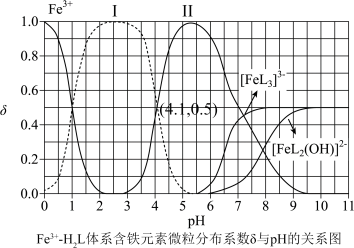
①苯酚酸性比邻甲基苯酚______ (填“强”“弱”或“无法判断”),邻苯二酚的熔点比对苯二酚低的原因为______ 。
②图中代表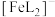 的曲线是
的曲线是______ (填“Ⅰ”或“Ⅱ”)。计算该温度下溶液中反应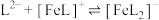 的平衡常数
的平衡常数
______ (写出计算过程)。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式:
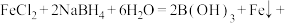
②相同条件下,向水样Ⅰ和Ⅱ(含少量(
 )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中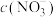 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
③在0~10 min内,Ⅱ中
 的平均反应速率为
的平均反应速率为(2)KSCN溶液可检验水样中的
 .发生的反应为
.发生的反应为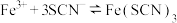 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。| A.增大KSCN溶液的浓度,平衡常数增大 |
B.加入少量铁粉,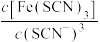 减小 减小 |
| C.加水稀释,平衡向左移动,溶液颜色变浅 |
D.加入少量 固体,平衡向右移动 固体,平衡向右移动 |
 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、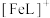 、
、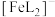 、
、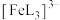 、
、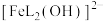 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。已知:
 及
及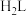 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,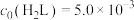 mol⋅L
mol⋅L 。
。常温下,
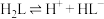
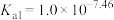 ,
,
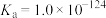 。
。
①苯酚酸性比邻甲基苯酚
②图中代表
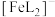 的曲线是
的曲线是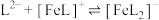 的平衡常数
的平衡常数
您最近一年使用:0次
2023-09-08更新
|
437次组卷
|
3卷引用:广东省广州市第六中学2024届高中毕业班第一次调研考试化学试题
10 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即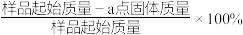 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即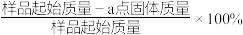 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为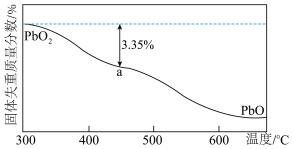
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次



