名校
解题方法
1 . 氟硅酸钾(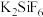 )常用于木材防腐和陶瓷制造,一种以石英砂和氢氟酸为原料制备氟硅酸钾的工艺流程如图所示。
)常用于木材防腐和陶瓷制造,一种以石英砂和氢氟酸为原料制备氟硅酸钾的工艺流程如图所示。
(1)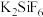 中Si元素的化合价为
中Si元素的化合价为_______ 。
(2)“还原1”中,发生反应的化学方程式为_______ 。
(3)“还原2”中,发生反应的 与
与 的物质的量之比为
的物质的量之比为_______ 。
(4)“转化2”中发生反应的化学方程式为_______ 。
(5)“沉淀”后,分离出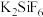 的操作为
的操作为_______ ,该操作需要使用的玻璃仪器有_______ 。
(6)该工艺中可循环使用的物质除 外,还有
外,还有_______ (填化学式)。
(7)写出氢氟酸的一种用途:_______ 。
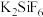 )常用于木材防腐和陶瓷制造,一种以石英砂和氢氟酸为原料制备氟硅酸钾的工艺流程如图所示。
)常用于木材防腐和陶瓷制造,一种以石英砂和氢氟酸为原料制备氟硅酸钾的工艺流程如图所示。
(1)
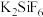 中Si元素的化合价为
中Si元素的化合价为(2)“还原1”中,发生反应的化学方程式为
(3)“还原2”中,发生反应的
 与
与 的物质的量之比为
的物质的量之比为(4)“转化2”中发生反应的化学方程式为
(5)“沉淀”后,分离出
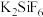 的操作为
的操作为(6)该工艺中可循环使用的物质除
 外,还有
外,还有(7)写出氢氟酸的一种用途:
您最近一年使用:0次
2024-09-17更新
|
92次组卷
|
2卷引用:山西省部分学校2024-2025学年高二上学期开学考试化学试题
名校
解题方法
2 . FeCl3是一种用途广泛的工业原料,主要用于污水处理、五金刻蚀、建筑工业制备混凝土等,有机工业中可用作催化剂、氧化剂等。某化学兴趣小组从含有FeCl2、FeCl3、CuCl2的废液中回收铜并制备氯化铁晶体,其流程如图所示:
(1)用离子方程式表示反应①中所涉及的反应:_______ 。
(2)操作Ⅰ中玻璃棒的作用是_______ 。
(3)滤渣Y的主要成分是_______ (填化学式,下同),试剂b是_______ 。
(4)①加入试剂c的目的是_______ 。
②试剂c可选择下列物质中的_______ (填字母)。
A.KMnO4 B.Cl2 C.Zn D.HCl E.H2O2
③根据②中所选试剂,写出反应③的离子方程式:_______ (任写一个)。
(5)该化学兴趣小组利用废液制得了一定质量的FeCl3•6H2O晶体(不考虑杂质),并将其配成250mL溶液。取25.0mL该溶液与物质的量浓度为0.50mol•L-1的Na2SO3溶液恰好反应,此时消耗Na2SO3溶液的体积为20.0mL,反应原理:_______Fe3++_______SO +_______H2O——_______Fe2++_______SO
+_______H2O——_______Fe2++_______SO +_______H+。
+_______H+。_______
请配平以上离子方程式,并计算FeCl3•6H2O晶体的质量_______ (写出计算表达式和计算结果)。
(1)用离子方程式表示反应①中所涉及的反应:
(2)操作Ⅰ中玻璃棒的作用是
(3)滤渣Y的主要成分是
(4)①加入试剂c的目的是
②试剂c可选择下列物质中的
A.KMnO4 B.Cl2 C.Zn D.HCl E.H2O2
③根据②中所选试剂,写出反应③的离子方程式:
(5)该化学兴趣小组利用废液制得了一定质量的FeCl3•6H2O晶体(不考虑杂质),并将其配成250mL溶液。取25.0mL该溶液与物质的量浓度为0.50mol•L-1的Na2SO3溶液恰好反应,此时消耗Na2SO3溶液的体积为20.0mL,反应原理:_______Fe3++_______SO
 +_______H2O——_______Fe2++_______SO
+_______H2O——_______Fe2++_______SO +_______H+。
+_______H+。请配平以上离子方程式,并计算FeCl3•6H2O晶体的质量
您最近一年使用:0次
2024-09-12更新
|
133次组卷
|
2卷引用:广东省清远市2023-2024学年高一上学期期末教学质量检测化学试题
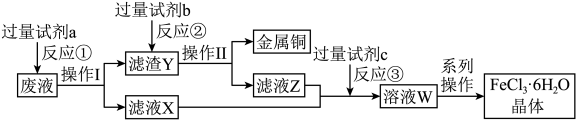
3 . 磷酸铁(FePO4)可作为新能源汽车锂离子电池的正极材料。一种以副产硫酸亚铁(主要成分为)FeSO4,杂质含Mn2+、Al3+、TiO2+)为原料合成磷酸铁的工艺如图所示。
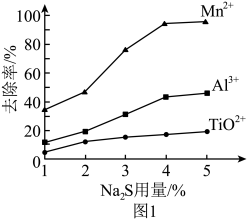
(1)滤渣1最主要成分为_______ (写化学式),在“除锰”过程中,杂质的去除率与Na2S的用量关系如图1所示,则Na2S的最适用量为_______ %。_______ (填化学式),其与NaOH溶液发生反应的离子方程式为_______ 。
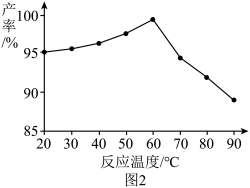
(3)“转化”步骤中,加入H2O2的目的是_______ (用离子方程式表示)。该步骤中,一定时间内反应温度与产率的关系如图2所示,则60℃以后,随温度升高该反应产率降低的原因可能为_______ 。_______ 。欲检验“沉淀”是否完全,具体的操作与现象是_______ 。
(5)滤液1中的主要溶质可回收,写出其中一种用途_______ 。
(1)滤渣1最主要成分为
(3)“转化”步骤中,加入H2O2的目的是
(5)滤液1中的主要溶质可回收,写出其中一种用途
您最近一年使用:0次
解题方法
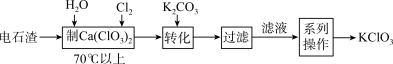
4 . 废物利用是实现绿色化学和节能减排的重要措施。电石渣[主要成分为Ca(OH)2]是氯碱工业的废料,某同学在实验室以电石渣为原料制取KClO3的流程如图所示: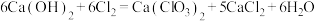 。
。
回答下列问题:
(1)KClO3中氯元素的化合价为___________ 价。
(2) KClO3可用于制备Cl2:KClO3+6HCl(浓)= +3Cl2↑+3H2O
①请补充完整反应方程式:___________ 。
②该反应的还原剂是___________ 。
(3)上述流程中,“转化”时发生反应的离子方程式为___________ 。
(4)一定量石灰乳中持续通入氯气发生反应,生成物中含氯离子仅有 、
、 、
、 ,且反应过程中不断释放热量。其中
,且反应过程中不断释放热量。其中 、
、 物质的量(n)与反应时间(t)曲线如图所示:
物质的量(n)与反应时间(t)曲线如图所示:___________ 。
②写出Ca(ClO)2的一种用途___________ 。
③若提高石灰乳中通入氯气的速度,则反应后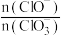
___________ 2(填“>”、“<”或“=”)。
④该石灰乳中Ca(OH)2的物质的量是___________ 。
A.1.5mol B.3mol C.5mol D.10mol
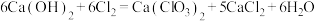 。
。回答下列问题:
(1)KClO3中氯元素的化合价为
(2) KClO3可用于制备Cl2:KClO3+6HCl(浓)= +3Cl2↑+3H2O
①请补充完整反应方程式:
②该反应的还原剂是
(3)上述流程中,“转化”时发生反应的离子方程式为
(4)一定量石灰乳中持续通入氯气发生反应,生成物中含氯离子仅有
 、
、 、
、 ,且反应过程中不断释放热量。其中
,且反应过程中不断释放热量。其中 、
、 物质的量(n)与反应时间(t)曲线如图所示:
物质的量(n)与反应时间(t)曲线如图所示: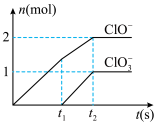
②写出Ca(ClO)2的一种用途
③若提高石灰乳中通入氯气的速度,则反应后
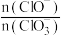
④该石灰乳中Ca(OH)2的物质的量是
A.1.5mol B.3mol C.5mol D.10mol
您最近一年使用:0次
解题方法
5 . 硼及其化合物在工业上用途广泛。以硼镁矿(主要成分为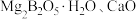 ,还含有少量的
,还含有少量的 及
及 等)为原料制备硼酸
等)为原料制备硼酸 并得到
并得到 的工艺流程如下:
的工艺流程如下:___________ 。
(2)①为提高“酸浸”速率,可采取的措施有___________ (任写一条)。
②补充“酸浸”时 发生反应的化学方程式:
发生反应的化学方程式: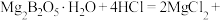
___________ 。
(3)在“氧化”步骤中,化合价发生变化的金属离子是___________ (填离子符号)。
(4)“滤渣3”的主要成分为___________ (填化学式)。
(5)“沉钙”后的滤液,可在该工艺的___________ 步骤中循环使用。
(6)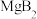 具有超导电性。利用
具有超导电性。利用 受热脱水得到
受热脱水得到 ,再利用高温下
,再利用高温下 和
和 (物质的量之比为
(物质的量之比为 )的反应制得
)的反应制得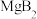 。
。
① 分三步脱水,过程如下:
分三步脱水,过程如下: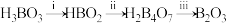
则第ⅱ步的失重率为___________ (已知:失重率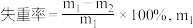 为失重前质量,
为失重前质量, 为失重后质量;结果保留两位有效数字)。
为失重后质量;结果保留两位有效数字)。
②写出利用 制备
制备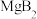 的化学方程式
的化学方程式___________ 。
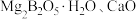 ,还含有少量的
,还含有少量的 及
及 等)为原料制备硼酸
等)为原料制备硼酸 并得到
并得到 的工艺流程如下:
的工艺流程如下: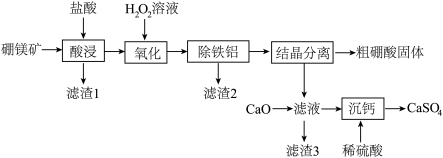
(2)①为提高“酸浸”速率,可采取的措施有
②补充“酸浸”时
 发生反应的化学方程式:
发生反应的化学方程式: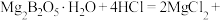
(3)在“氧化”步骤中,化合价发生变化的金属离子是
(4)“滤渣3”的主要成分为
(5)“沉钙”后的滤液,可在该工艺的
(6)
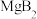 具有超导电性。利用
具有超导电性。利用 受热脱水得到
受热脱水得到 ,再利用高温下
,再利用高温下 和
和 (物质的量之比为
(物质的量之比为 )的反应制得
)的反应制得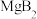 。
。①
 分三步脱水,过程如下:
分三步脱水,过程如下: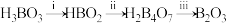
则第ⅱ步的失重率为
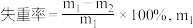 为失重前质量,
为失重前质量, 为失重后质量;结果保留两位有效数字)。
为失重后质量;结果保留两位有效数字)。②写出利用
 制备
制备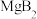 的化学方程式
的化学方程式
您最近一年使用:0次
6 . 钾铬矾[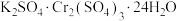 ],
],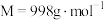 ,在鞣革、纺织等工业上有广泛的用途,可通过
,在鞣革、纺织等工业上有广泛的用途,可通过 还原重铬酸盐的酸性溶液制得,某小组按图1所示装置模拟钾铬矾的制备。回答下列问题:
还原重铬酸盐的酸性溶液制得,某小组按图1所示装置模拟钾铬矾的制备。回答下列问题: 装置可制备
装置可制备 ,其反应的化学方程式为
,其反应的化学方程式为___________ 。选择质量分数为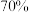 的
的 而不是稀硫酸进行实验的理由是
而不是稀硫酸进行实验的理由是___________ 。
(2)B装置采用冰水浴,充分反应后为得到更多钾铬矾晶体,有同学认为可加入少量乙醇降低产品的溶解度而便于析出,该方法不合理的原因是___________ 。
(3)对反应后C中的溶液组成进行探究,实验小组认为吸收液中的溶质可能被氧化,可加入___________ (填试剂)进行检验。
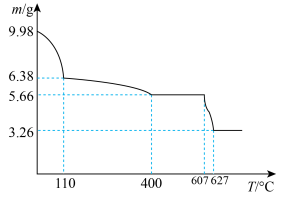
(4)研究钾铬矾的热分解反应及产物,取9.98g纯品进行热重分析,残留固体的质量与温度的关系如图所示。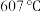 加热至
加热至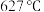 时,固体分解产生无色气体,过程中无电子转移。将剩余固体溶于水中部分溶解。
时,固体分解产生无色气体,过程中无电子转移。将剩余固体溶于水中部分溶解。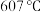 加热至
加热至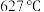 时所发生反应的化学方程式为
时所发生反应的化学方程式为___________ 。
(5)往含铬废水中加入适量可溶性钡盐可使铬元素转化为 沉淀而除去。要使
沉淀而除去。要使 的排放达到安全标准(
的排放达到安全标准( 含量
含量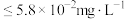 ),应保证水体中
),应保证水体中 的最低浓度为
的最低浓度为___________  (
( ,写出计算过程)。
,写出计算过程)。
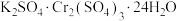 ],
],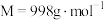 ,在鞣革、纺织等工业上有广泛的用途,可通过
,在鞣革、纺织等工业上有广泛的用途,可通过 还原重铬酸盐的酸性溶液制得,某小组按图1所示装置模拟钾铬矾的制备。回答下列问题:
还原重铬酸盐的酸性溶液制得,某小组按图1所示装置模拟钾铬矾的制备。回答下列问题: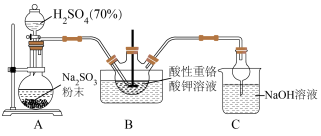
 装置可制备
装置可制备 ,其反应的化学方程式为
,其反应的化学方程式为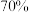 的
的 而不是稀硫酸进行实验的理由是
而不是稀硫酸进行实验的理由是(2)B装置采用冰水浴,充分反应后为得到更多钾铬矾晶体,有同学认为可加入少量乙醇降低产品的溶解度而便于析出,该方法不合理的原因是
(3)对反应后C中的溶液组成进行探究,实验小组认为吸收液中的溶质可能被氧化,可加入
(4)研究钾铬矾的热分解反应及产物,取9.98g纯品进行热重分析,残留固体的质量与温度的关系如图所示。
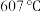 加热至
加热至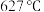 时,固体分解产生无色气体,过程中无电子转移。将剩余固体溶于水中部分溶解。
时,固体分解产生无色气体,过程中无电子转移。将剩余固体溶于水中部分溶解。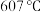 加热至
加热至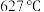 时所发生反应的化学方程式为
时所发生反应的化学方程式为(5)往含铬废水中加入适量可溶性钡盐可使铬元素转化为
 沉淀而除去。要使
沉淀而除去。要使 的排放达到安全标准(
的排放达到安全标准( 含量
含量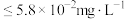 ),应保证水体中
),应保证水体中 的最低浓度为
的最低浓度为 (
( ,写出计算过程)。
,写出计算过程)。
您最近一年使用:0次
名校
7 . 氧及其化合物具有广泛用途。 是常用的氧化剂,能氧化甲醛转变成无毒气体,
是常用的氧化剂,能氧化甲醛转变成无毒气体, 与
与 生成
生成 的反应是氢能源应用的重要途径。
的反应是氢能源应用的重要途径。 的燃烧热为
的燃烧热为 。在新型催化剂
。在新型催化剂 作用下,
作用下, 氧化
氧化 可获得
可获得 。氯元素能形成多种强弱不等的酸。请完成下列小题:
。氯元素能形成多种强弱不等的酸。请完成下列小题:
1.对于反应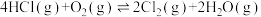
 下列说法正确的是
下列说法正确的是
2.下列化学反应表示正确的是
3. 与
与 在羟基磷灰石(
在羟基磷灰石( )表面催化氧化生成
)表面催化氧化生成 和
和 的历程,该历程示意图如题8图所示(图中只画出了
的历程,该历程示意图如题8图所示(图中只画出了 的部分结构)。下列说法
的部分结构)。下列说法不正确 的是
 是常用的氧化剂,能氧化甲醛转变成无毒气体,
是常用的氧化剂,能氧化甲醛转变成无毒气体, 与
与 生成
生成 的反应是氢能源应用的重要途径。
的反应是氢能源应用的重要途径。 的燃烧热为
的燃烧热为 。在新型催化剂
。在新型催化剂 作用下,
作用下, 氧化
氧化 可获得
可获得 。氯元素能形成多种强弱不等的酸。请完成下列小题:
。氯元素能形成多种强弱不等的酸。请完成下列小题:1.对于反应
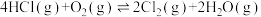
 下列说法正确的是
下列说法正确的是A.升高温度,可提高 平衡转化率 平衡转化率 |
B.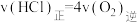 时,该反应达到平衡状态 时,该反应达到平衡状态 |
C. 与 与 混合后反应,转移电子数约为 混合后反应,转移电子数约为 |
D. 的使用能改变该反应的焓变 的使用能改变该反应的焓变 |
A.太阳光催化分解水制氧: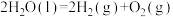 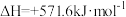 |
B.氨气的催化氧化: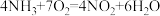 |
C.过量 通入 通入 溶液中: 溶液中: |
D.用惰性电极电解饱和 溶液: 溶液: |
 与
与 在羟基磷灰石(
在羟基磷灰石( )表面催化氧化生成
)表面催化氧化生成 和
和 的历程,该历程示意图如题8图所示(图中只画出了
的历程,该历程示意图如题8图所示(图中只画出了 的部分结构)。下列说法
的部分结构)。下列说法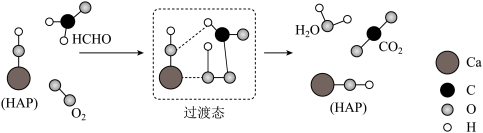
A. 能提高 能提高 与 与 的反应速率的原因是降低了反应的活化能 的反应速率的原因是降低了反应的活化能 |
B. 在反应过程中,有极性共价键的断裂和形成 在反应过程中,有极性共价键的断裂和形成 |
C.根据图示信息, 分子中的氧原子全部来自 分子中的氧原子全部来自 |
D. 的空间构型为直线形 的空间构型为直线形 |
您最近一年使用:0次
解题方法
8 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
i)最高价铬酸根离子在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;
ii) 时,硅元素以
时,硅元素以 形式存在;
形式存在;
iii) 在
在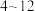 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。
回答下列问题:
(1)基态 基态原子共有
基态原子共有_______ 种空间运动状态的电子。
(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为_______ 。
(3)水浸渣中主要物质为_______ (填化学式)。
(4)“沉淀”步骤调 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以 和
和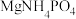 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是_______ (填标号)。
a.若 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀
b.若 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质
d.若 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀
(6)“分离钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或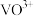 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有_______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。

i)最高价铬酸根离子在酸性介质中以
 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;ii)
 时,硅元素以
时,硅元素以 形式存在;
形式存在;iii)
 在
在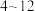 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。回答下列问题:
(1)基态
 基态原子共有
基态原子共有(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调
 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为(5)“除硅磷”步骤中,使硅、磷分别以
 和
和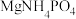 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是a.若
 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀b.若
 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀c.若
 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质d.若
 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀(6)“分离钒”步骤中,将溶液
 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或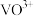 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
9 . 高铁酸钾 是一种环保、高效、多功能饮用水处理剂。一种制备高铁酸钾的流程如下图所示。
是一种环保、高效、多功能饮用水处理剂。一种制备高铁酸钾的流程如下图所示。___________ ,检验产物中铁元素价态的方法是:取少量产物溶于水,___________ ,观察现象。
(2)反应Ⅱ的离子方程式为___________ ,该反应的氧化剂与还原剂物质的量之比为___________ 。
(3)反应Ⅲ的反应类型是___________ 。
(4)反应Ⅰ中的尾气用 溶液吸收的优点是
溶液吸收的优点是___________ 。
(5)性质决定用途。在水处理的过程中,高铁酸钾可以作絮凝剂,是因为它可转化为 胶体,从而吸附水中的悬浮物;高铁酸钾还可以作消毒剂,是因为它具有
胶体,从而吸附水中的悬浮物;高铁酸钾还可以作消毒剂,是因为它具有___________ 。
 是一种环保、高效、多功能饮用水处理剂。一种制备高铁酸钾的流程如下图所示。
是一种环保、高效、多功能饮用水处理剂。一种制备高铁酸钾的流程如下图所示。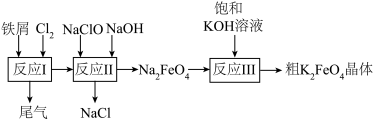
(2)反应Ⅱ的离子方程式为
(3)反应Ⅲ的反应类型是
(4)反应Ⅰ中的尾气用
 溶液吸收的优点是
溶液吸收的优点是(5)性质决定用途。在水处理的过程中,高铁酸钾可以作絮凝剂,是因为它可转化为
 胶体,从而吸附水中的悬浮物;高铁酸钾还可以作消毒剂,是因为它具有
胶体,从而吸附水中的悬浮物;高铁酸钾还可以作消毒剂,是因为它具有
您最近一年使用:0次
名校
解题方法
10 . 铁及其化合物在生产、生活和生命中具有广泛而重要的应用。
I.硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁红、铁系催化剂等。以绿矾(主要成分 ,部分
,部分 已被氧化为
已被氧化为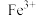 )为原料,生产铁红(
)为原料,生产铁红( ),工艺流程如下:
),工艺流程如下: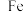 粉时发生反应的离子方程式为
粉时发生反应的离子方程式为_____________ 。
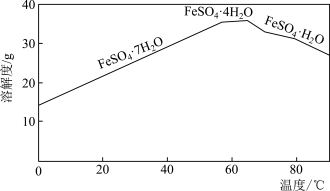
(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是____________ (填化学式)。 还原为
还原为 ,然后投加石灰乳,使
,然后投加石灰乳,使 转化为
转化为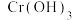 ,理论上完全反应消耗的
,理论上完全反应消耗的
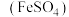 :
:
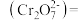
___________ 。
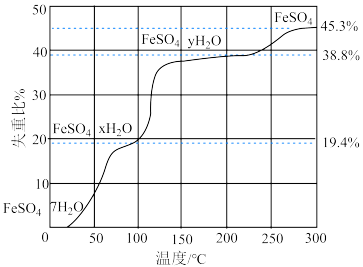
II. 在气氛中,的脱水热分解过程如下图所示: )
)
(4)上述 的脱水热分解过程,选择在
的脱水热分解过程,选择在 气氛中进行,而非空气。其目的是
气氛中进行,而非空气。其目的是_________ 。
(5)根据上述实验结果,可知x=______ 。
(6)将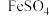 置入真空刚性容器中,“煅烧”生成铁红和两种硫的气态氧化物。其化学方程式为
置入真空刚性容器中,“煅烧”生成铁红和两种硫的气态氧化物。其化学方程式为______________ 。
III.高铁酸盐(其中Fe元素显+6价)具有极强的氧化性,可作水处理剂。
已知:将溶液酸化时, 迅速分解而转化为
迅速分解而转化为 并放出
并放出 ;酸性溶液中
;酸性溶液中 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。
(7)工业上将过氧化钠和硫酸亚铁依次投入反应釜中,发生反应的化学方程式为 ,上述反应每生成1mol
,上述反应每生成1mol ,转移
,转移_______ mol 。
。
(8)工业上用KClO与 溶液在碱性条件下反应制得
溶液在碱性条件下反应制得 。发生反应的离子方程式为
。发生反应的离子方程式为___________ 。
(9)高铁酸盐可用于氧化去除高氯(含高浓度 )废水中的有机物。以
)废水中的有机物。以 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是____________ 。
I.硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁红、铁系催化剂等。以绿矾(主要成分
 ,部分
,部分 已被氧化为
已被氧化为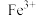 )为原料,生产铁红(
)为原料,生产铁红( ),工艺流程如下:
),工艺流程如下: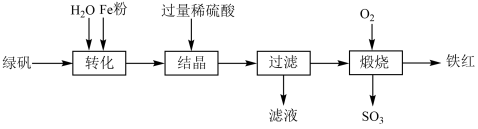
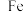 粉时发生反应的离子方程式为
粉时发生反应的离子方程式为(2)“结晶”时,控制温度在75℃左右进行(相关物质的溶解度见下图),从溶液中析出的晶体是
 还原为
还原为 ,然后投加石灰乳,使
,然后投加石灰乳,使 转化为
转化为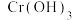 ,理论上完全反应消耗的
,理论上完全反应消耗的
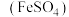 :
:
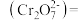
II. 在气氛中,的脱水热分解过程如下图所示:
 )
)(4)上述
 的脱水热分解过程,选择在
的脱水热分解过程,选择在 气氛中进行,而非空气。其目的是
气氛中进行,而非空气。其目的是(5)根据上述实验结果,可知x=
(6)将
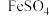 置入真空刚性容器中,“煅烧”生成铁红和两种硫的气态氧化物。其化学方程式为
置入真空刚性容器中,“煅烧”生成铁红和两种硫的气态氧化物。其化学方程式为III.高铁酸盐(其中Fe元素显+6价)具有极强的氧化性,可作水处理剂。
已知:将溶液酸化时,
 迅速分解而转化为
迅速分解而转化为 并放出
并放出 ;酸性溶液中
;酸性溶液中 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。(7)工业上将过氧化钠和硫酸亚铁依次投入反应釜中,发生反应的化学方程式为
 ,上述反应每生成1mol
,上述反应每生成1mol ,转移
,转移 。
。(8)工业上用KClO与
 溶液在碱性条件下反应制得
溶液在碱性条件下反应制得 。发生反应的离子方程式为
。发生反应的离子方程式为(9)高铁酸盐可用于氧化去除高氯(含高浓度
 )废水中的有机物。以
)废水中的有机物。以 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是
您最近一年使用:0次



