名校
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系: 的电子式为
的电子式为________ ;将 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为________ 。
(2)S粉与热的Z浓溶液反应可转化为________ ,反应的化学方程式为________ 。
(3)配平下列反应:_____
____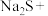 ____
____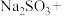 ____
____ ____
____ ____
____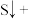 ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。________ 。
②C的作用是________ ,装置D中试管口放置的棉花应浸有一种液体,这种液体是________ 。
 的电子式为
的电子式为 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为(2)S粉与热的Z浓溶液反应可转化为
(3)配平下列反应:
____
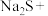 ____
____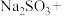 ____
____ ____
____ ____
____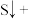 ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
| A.X能使溴水褪色,证明X有漂白性 | B.将X通入 溶液中有白色沉淀生成 溶液中有白色沉淀生成 |
C.硫在过量的 中燃烧可以生成Y 中燃烧可以生成Y | D.若N为钠盐,则N与Z的稀溶液反应可生成 |
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。

②C的作用是
您最近一年使用:0次
2 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:

(1)根据A对应的化合价和物质类别,A为_______ (写分子式)。
(2)氨及其化合物中常用作保护气(如填充灯泡、焊接保护等)的物质是_______ (写电子式),原因是_______ 。
(3)从硫元素化合价变化的角度分析,图中硫元素不能表现出氧化性的物质是_______ (填化学式)。
(4)胆矾放在盛浓硫酸的干燥器中变成白色粉末,体现了浓硫酸的_______ (填“脱水”“吸水”或“强氧化”,下同)性;浓硫酸在加热条件下与木炭反应,体现了浓硫酸的_______ 性;用浓硫酸在纸上书写的字迹变黑,体现了浓硫酸的_______ 性。
(5)含-3价氮元素的物质可以是 ,也可以是铵盐。只用一种试剂,将
,也可以是铵盐。只用一种试剂,将 、
、 、
、 、NaCl这4种盐的溶液区分开(可加热),这种试剂可以是_______(填序号)。
、NaCl这4种盐的溶液区分开(可加热),这种试剂可以是_______(填序号)。

(1)根据A对应的化合价和物质类别,A为
(2)氨及其化合物中常用作保护气(如填充灯泡、焊接保护等)的物质是
(3)从硫元素化合价变化的角度分析,图中硫元素不能表现出氧化性的物质是
(4)胆矾放在盛浓硫酸的干燥器中变成白色粉末,体现了浓硫酸的
(5)含-3价氮元素的物质可以是
 ,也可以是铵盐。只用一种试剂,将
,也可以是铵盐。只用一种试剂,将 、
、 、
、 、NaCl这4种盐的溶液区分开(可加热),这种试剂可以是_______(填序号)。
、NaCl这4种盐的溶液区分开(可加热),这种试剂可以是_______(填序号)。| A.NaOH溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
3 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
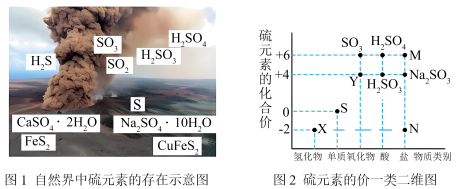
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。
(2) 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(4)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与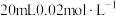 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(5) 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:

请回答下列问题:
①反应b的化学方程式为:___________ 。
②在一段时间内连续不断测定溶液 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:___________ 。
③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:___________ 。
(6)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成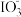 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(7)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
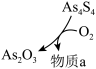
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为___________ ,消耗氧气___________  。
。

(1)图1中与图2中M、N对应的物质分别是
(2)
 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与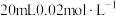 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)
 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
请回答下列问题:
①反应b的化学方程式为:
②在一段时间内连续不断测定溶液
 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:
(6)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成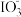 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(7)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为 。
。
您最近一年使用:0次
名校
4 . 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是
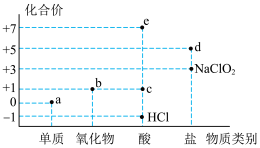
| A.c在光照条件下很容易分解 |
| B.b不是酸性氧化物,因为它没有对应的含氧酸 |
| C.图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 |
D.将a通入 溶液中,已知生成 溶液中,已知生成 、 、 和d的混合物,若 和d的混合物,若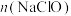 与 与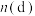 之比为 之比为 ,则氧化剂与还原剂的物质的量之比为 ,则氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
2023-11-21更新
|
393次组卷
|
5卷引用:湖南省衡阳市衡南县第一次联考2023-2024学年高三上学期11月期中化学试题
5 . 回答下列问题
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为_______ 。
(2)X与Z反应中氧化剂与还原剂的物质的量之比为_______ 。
(3) 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为_______ 。
(4)铜和M的浓溶液反应生成Z的化学方程式为_______ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是_______ 。
(Ⅱ)氮氧化物( )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。
方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式_______ 。
方案2:
在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
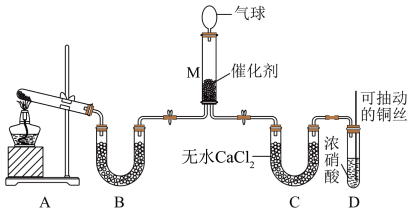
(6)用装置A制备 ,反应的化学方程式为
,反应的化学方程式为_______ ;装置B内的试剂是_______ 。
(7)装置D中发生反应的离子方程式是_______ ;可抽动铜丝的优点是_______ 。
(8)在装置M中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为_______ 。
方案3:
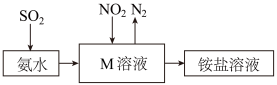
(9)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是_______ 。
(Ⅰ)自然界中硫元素的存在如图1,硫元素的常见化合价与部分物质类别的对应关系如图2,回答下列问题:

(1)图2中的N对应图1中物质的化学式为
(2)X与Z反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易被氧化,检验
溶液易被氧化,检验 溶液变质的试剂为
溶液变质的试剂为(4)铜和M的浓溶液反应生成Z的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(Ⅱ)氮氧化物(
 )是大气污染物之一,处理
)是大气污染物之一,处理 对于环境保护具有重要的意义。
对于环境保护具有重要的意义。方案l:
(5)汽车排气管上装有催化转化器,可减少尾气对环境的污染,有害气体CO和NO反应可转化为无害气体排放,写出反应的化学方程式
方案2:
在一定条件下
 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
(6)用装置A制备
 ,反应的化学方程式为
,反应的化学方程式为(7)装置D中发生反应的离子方程式是
(8)在装置M中
 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中 和
和 的物质的量之比为
的物质的量之比为方案3:
(9)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是
您最近一年使用:0次
解题方法
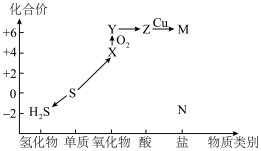
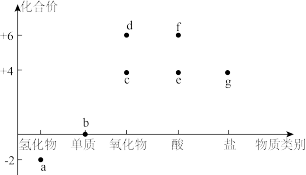
6 . 利用元素化合价和物质类别推测物质的性质是化学研究的重要手段。如图是硫元素常见化合价与部分物质类别的对应关系。
(1)按物质性质分类,c、d均属于____ 氧化物。据此类物质的性质列举一种消除c对空气污染的方法____ 。
(2)a中硫元素处于最低化合价,其有____ 性。a溶液久置于空气中会生成b。使溶液变浑浊。写出发生反应的化学方程式____ 。
(3)从化合价的角度看c、e、g既有氧化性又有还原性,写出一个c表现氧化性的化学方程式____ ;用离子方程式表示g与绿色氧化剂的反应____ 。
(4)c→e→f是硫酸型酸雨的形成途径之一。某地收集的雨水样品在不同时间测得pH如表所示,请分析该雨水样品随时间变化酸性逐渐增强的原因____ 。
(1)按物质性质分类,c、d均属于
(2)a中硫元素处于最低化合价,其有
(3)从化合价的角度看c、e、g既有氧化性又有还原性,写出一个c表现氧化性的化学方程式
(4)c→e→f是硫酸型酸雨的形成途径之一。某地收集的雨水样品在不同时间测得pH如表所示,请分析该雨水样品随时间变化酸性逐渐增强的原因
| 时间/h | 0 | 2 | 4 | 6 | 8 | 10 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
您最近一年使用:0次
2022-09-02更新
|
320次组卷
|
2卷引用:山东省青岛市2021-2022学年高一上学期期末考试化学试题
7 . 下表是元素周期表的一部分,回答下列有关问题:

(1)在①—⑩元素中,最活泼的金属元素是_______ (填元素名称),①的最高价氧化物的水化物为_______ (填“强”或“弱”)酸,④的最高价氧化物的水化物的电子式为_______ ,②③④的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)⑥的单质与⑩的最高价氧化物的水化物反应的离子方程式为_______
(3)⑧号元素的化合价与部分物质类别的对应关系如下图所示,回答相关问题:

①X的电离方程式为_______ 。
②Y可用于实验室制O2,其焰色反应为紫色,则Y含有的化学键类型有_______ ;写出实验室在催化剂作用下用Y制氧气的化学方程式_______ 。Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,生成的两种盐的化学式分别为_______ 。

(1)在①—⑩元素中,最活泼的金属元素是
(2)⑥的单质与⑩的最高价氧化物的水化物反应的离子方程式为
(3)⑧号元素的化合价与部分物质类别的对应关系如下图所示,回答相关问题:

①X的电离方程式为
②Y可用于实验室制O2,其焰色反应为紫色,则Y含有的化学键类型有
您最近一年使用:0次
8 . 氨元素是动植物生长不可缺少的元素,图1是自然界中氨元素的循环示意图,图2是氨元素的常见化合价与部分物质类别的对应关系。回答下列问题:
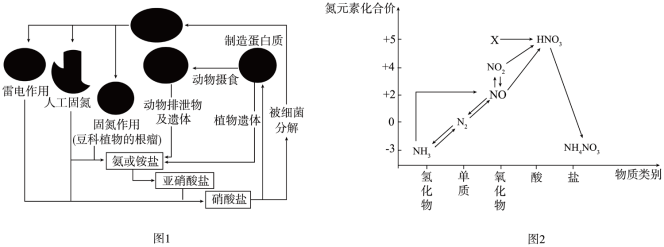
(1)图1中属于固氮过程的是_______ (写两种即可)。
(2) 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。
①下列各装置中常用于实验室制备氨气的是_______ (填字母),利用该装置制备氨气的化学方程式为_______ 。
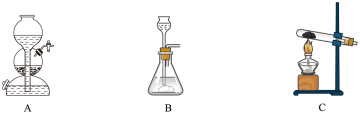
② 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
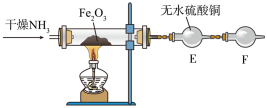
写出氨气与氧化铁反应的化学方程式:_______ 。干燥管F中装有无水氯化钙,其作用是_______ 。
(3)图2中物质X的化学式是_______ ,其与水反应生成 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为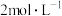 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为_______ (假设只生成一种气体),最多可收集到标准状况下的该气体的体积为_______ L。

(1)图1中属于固氮过程的是
(2)
 可以将
可以将 还原为Fe,自身被氧化为
还原为Fe,自身被氧化为 。某学习小组欲制备氨气以还原氧化铁。
。某学习小组欲制备氨气以还原氧化铁。①下列各装置中常用于实验室制备氨气的是

②
 还原
还原 并检验有水生成的实验装置如图所示:
并检验有水生成的实验装置如图所示:
写出氨气与氧化铁反应的化学方程式:
(3)图2中物质X的化学式是
 。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为
。某硝酸和硫酸的混合溶液200mL,其中硫酸的浓度为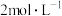 ,硝酸的浓度为
,硝酸的浓度为 ,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
,现向其中加入9.6g铜粉,充分反应生成气体的化学式为
您最近一年使用:0次
名校
9 . 如图是硫元素的常见化合价与部分物质类别的对应关系。请回答下列问题。
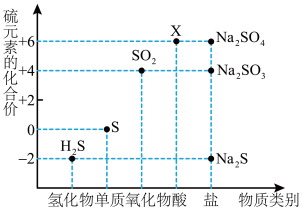
(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的_______ 性。
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有_______ (填化学式)。
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为_______ 。
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目______ 。
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
(6)设 NA为阿伏加德罗常数的值。下列说法正确的是
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
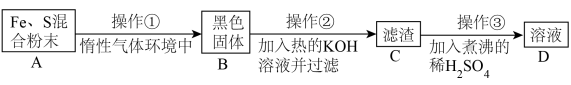
请回答以下问题:
(7)操作②的作用是_______ ,也可改用_______ 。
(8)混合粉末 A 中硫粉过量的原因是_______ 。
(9)下列溶液中通入SO2一定不会产生沉淀的是
(10)区别浓H2SO4和稀H2SO4,既简单又可靠的方法是

(1)X 的浓溶液与碳在一定条件下可以发生反应,体现了 X 的
(2)仅从硫元素化合价变化的角度分析,图中只有还原性的物质有
(3)将 H2S 与 SO2混合可生成淡黄色沉淀。该反应中氧化产物与还原产物的物质的量之比为
(4)配平下列反应,并用单线桥法标出电子转移的方向和数目
Na2S+_______Na2SO3+_______H2SO4=_______Na2SO4+_______S↓+_______H2O
(5)下列关于硫及其化合物的叙述正确的是
| A.试管内壁残留的硫可用酒精洗涤 | B.SO2的水溶液长期放置,酸性会增强 |
| C.SO2有毒,不可以做食品添加剂 | D.浓硫酸在空气中敞口放置,质量会减小 |
| A.1mol 铁单质与足量的硫单质充分反应,转移电子的数目为3NA |
| B.常温下,22.4LSO2与足量的O2反应,生成的SO3分子数为NA |
| C.常温下,将5.6g铁片投入足量的浓硫酸中,铁失去的电子数为0.3NA |
| D.1 molNa2O2与足量H2O反应,转移的电子数为NA |
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请回答以下问题:
(7)操作②的作用是
(8)混合粉末 A 中硫粉过量的原因是
(9)下列溶液中通入SO2一定不会产生沉淀的是
| A.Ba(OH)2 | B.澄清石灰水 | C.Na2S | D.BaCl2 |
| A.各取少许溶液分别放入铜片 | B.分别与石蕊试液作用 |
| C.用玻璃棒各蘸少许液涂在纸上 | D.观察溶液的颜色 |
您最近一年使用:0次
名校
解题方法
10 . I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
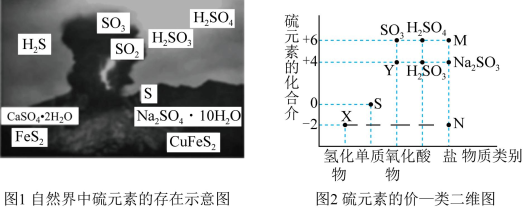
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次



