1 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近一年使用:0次
名校
解题方法
2 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: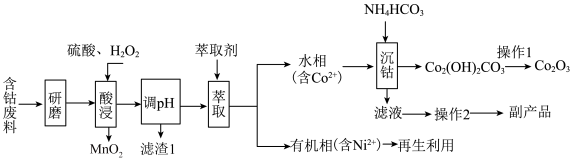
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近一年使用:0次
解题方法
3 . 钠元素在自然界中以多种化合物的形式存在。
(1)Na2O2、Na2CO3、NaHCO3是重要的化工原料,具有多种用途。
①Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式_______ 。
②将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有_______ (填离子符号),上述离子中有一种离子数目明显减少,减少的原因是_______ (用离子方程式表示)。
③查阅资料知:Na2O2在一定条件下可以转化为NaNO2,亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,误食NaNO2后可服用维生素C解毒。下列分析错误的是_______ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(2)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要工艺流程如下图所示(部分物质已略去)。
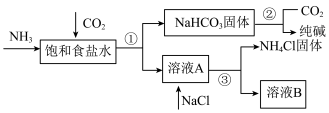
①实验室模拟“侯氏制碱法”,下列操作未涉及的是_______ (填字母)。
A. B.
B. C.
C. D.
D.
②下列联合制碱法流程说法正确的是_______ (填字母)。
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH 、Cl-
、Cl-
③该工艺制得的纯碱中往往会含有杂质NaCl,为检验杂质的存在,简单的检验方案是:取少量试样溶于水后,_______ 。
④为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,取5.00gNa2CO3样品充分加热,当固体质量不再变化时,再次称量固体质量为4.69g,写出加热时发生反应的化学方程式_______ ,该样品中Na2CO3的纯度是_______ 。
(1)Na2O2、Na2CO3、NaHCO3是重要的化工原料,具有多种用途。
①Na2O2可在呼吸面具和潜水艇中作为氧气的来源,请写出Na2O2与CO2反应的化学方程式
②将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO
 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有③查阅资料知:Na2O2在一定条件下可以转化为NaNO2,亚硝酸钠外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,误食NaNO2后可服用维生素C解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(2)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要工艺流程如下图所示(部分物质已略去)。

①实验室模拟“侯氏制碱法”,下列操作未涉及的是
A.
 B.
B. C.
C. D.
D.
②下列联合制碱法流程说法正确的是
a.CO2可以循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH
 、Cl-
、Cl-③该工艺制得的纯碱中往往会含有杂质NaCl,为检验杂质的存在,简单的检验方案是:取少量试样溶于水后,
④为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,取5.00gNa2CO3样品充分加热,当固体质量不再变化时,再次称量固体质量为4.69g,写出加热时发生反应的化学方程式
您最近一年使用:0次
名校
解题方法
4 . 草酸是一种用途广泛的二元有机中强酸,某同学通过查阅资料设计了如图所示的装置(夹持仪器省略)制备一定量的草酸晶体(H2C2O4·2H2O),并验证其具有的某些性质。回答下列问题:
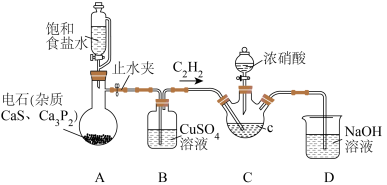
(1)仪器C的名称是_________ 。有人经分析后认为,用质量分数为70%的酒精溶液代替饱和食盐水(20℃时NaCl溶解度为36g)可获得更为平稳的气流,他得出这种结论的依据是_______ 。
(2)装置B的作用是_______________ ,若实验中使用上述酒精溶液代替食盐水,并且利用酸性KMnO4溶液检验有乙炔生成,则气体通过B后应先通入到盛有__________ 的洗气瓶,最后通入到酸性KMnO4溶液中。
(3)草酸在装置C中生成,反应的化学方程式为__________ ,装置D的作用是___________ 。
(4)待反应结束后,从C中分离出草酸晶体,然后用0.1000mol/L的酸性KMnO4溶液进行滴定以测定其纯度。
①称量3.500g草酸晶体配制100mL溶液,下 列配制操作中错误的是________ (填标号)。
a. b.
b. c.
c. d.
d. 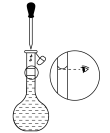
②三次平行滴定实验中消耗KMnO4溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示。
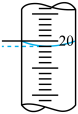
则V=_____ mL,样品中草酸晶体的质量分数为___________ 。

(1)仪器C的名称是
(2)装置B的作用是
(3)草酸在装置C中生成,反应的化学方程式为
(4)待反应结束后,从C中分离出草酸晶体,然后用0.1000mol/L的酸性KMnO4溶液进行滴定以测定其纯度。
①称量3.500g草酸晶体配制100mL溶液,下 列配制操作中错误的是
a.
 b.
b. c.
c. d.
d. 
②三次平行滴定实验中消耗KMnO4溶液的体积如下表所示,其中第一次实验滴定后的液面位置如图所示。

| 滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液的体积/mL | ||
| 第一次 | 20.00 | 0.20 | V1 | |
| 第二次 | 20.00 | 2.56 | 23.40 | |
| 第三次 | 20.00 | 0.22 | 20.32 | |
您最近一年使用:0次
5 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,下图物质转化中实现了循环,减少了有害物质向环境的排放,回答下列问题。

(1)Na2Cr2O7中Cr元素的化合价是___________ ,在上述转化中,Cr元素化合价不变的步骤是___________ (填序号)。
(2)下列物质中能实现反应①转化的是___________ 。(填字母)
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生___________ 反应(填“氧化”或“还原”),该反应有黄绿色气体生成,写出反应的化学方程式:___________ 。
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:___________ 。
(4)反应④在碱性条件下发生,反应的离子方程式为: ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式___________ 。

(1)Na2Cr2O7中Cr元素的化合价是
(2)下列物质中能实现反应①转化的是
a.KMnO4 b.HCl c.O2
所选物质参与反应①转化中,Na2Cr2O7发生
(3)向Cr(OH)3中加入NaOH浓溶液可实现反应③,写出该反应的化学方程式:
(4)反应④在碱性条件下发生,反应的离子方程式为:
 ,请将
,请将 所缺的物质补充完整并配平方程式
所缺的物质补充完整并配平方程式
您最近一年使用:0次
6 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是______(填字母)。
(2)检验司机是否酒后驾车利用了下列反应: ,(已知:
,(已知: 与
与 中H元素为
中H元素为 价,O元素为
价,O元素为 价:
价: 和
和 在溶液中的颜色分別为橙色和绿色),在该反应中,氧化剂是
在溶液中的颜色分別为橙色和绿色),在该反应中,氧化剂是______ (填化学式),若司机醉酒驾车,检测器的现象是______ 。
(3)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为: ,被还原的元素是
,被还原的元素是______ ,当生成28g的 时,转移电子的数目为
时,转移电子的数目为______ 。
(4)在肉制品加工中,使用的护色剂——亚硝酸钠 必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是______。
必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是______。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是______(填字母)。
A.煤的形成 | B.卫星上的太阳能电池工作 |
C.简单机械织布 | D.我国古代烧制陶器 |
(2)检验司机是否酒后驾车利用了下列反应:
 ,(已知:
,(已知: 与
与 中H元素为
中H元素为 价,O元素为
价,O元素为 价:
价: 和
和 在溶液中的颜色分別为橙色和绿色),在该反应中,氧化剂是
在溶液中的颜色分別为橙色和绿色),在该反应中,氧化剂是(3)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:
 ,被还原的元素是
,被还原的元素是 时,转移电子的数目为
时,转移电子的数目为(4)在肉制品加工中,使用的护色剂——亚硝酸钠
 必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是______。
必须严格控制用量,以确保食用安全。若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是______。| A.亚硝酸钠是还原剂 | B.维生素C是氧化剂 |
| C.亚硝酸钠被还原 | D.维生素C能把铁离子还原成为亚铁离子 |
您最近一年使用:0次
名校
7 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原料。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
(6)实验室中
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近一年使用:0次
解题方法
8 . 贵金属银有广泛用途。工业上用银锰精矿(主要含 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。
(1)“浸锰”步骤中产生的浸锰液主要含有 ,生成气体的主要成分为
,生成气体的主要成分为_______ ;用惰性电极电解浸锰液制 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式_______ 。
(2)已知“浸铁”步骤中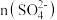 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=_______ ;浸铁滤饼的主要成分为S和_______ 。
(3)“浸银”时发生反应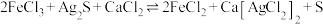 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是_______ ;结合离子方程式,从平衡角度分析选用氯化物浓溶液的原因是_______ 。
(4)“沉银”步骤中,生成单质银的离子反应方程式为_______ ,沉银液经处理可再利用,方法是向沉银液中通入_______ (写化学式),通过一步转化后循环再用。
 、MnS、
、MnS、 等)制备银,同时获得二氧化锰的流程如下。
等)制备银,同时获得二氧化锰的流程如下。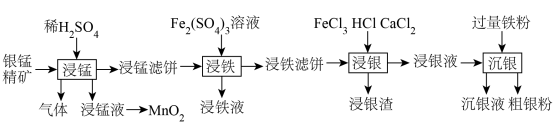
(1)“浸锰”步骤中产生的浸锰液主要含有
 ,生成气体的主要成分为
,生成气体的主要成分为 ,写出电解总反应的化学方程式
,写出电解总反应的化学方程式(2)已知“浸铁”步骤中
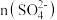 保持不变,反应中n(氧化剂):n(还原剂)=
保持不变,反应中n(氧化剂):n(还原剂)=(3)“浸银”时发生反应
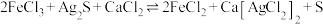 ,其中
,其中 在溶液中是一种稳定配合物。加入
在溶液中是一种稳定配合物。加入 的作用是
的作用是(4)“沉银”步骤中,生成单质银的离子反应方程式为
您最近一年使用:0次
9 . 锰及其化合物在工业生产中具有重要用途。某兴趣小组用软锰矿(主要成分是 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 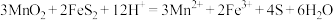
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是_______ 。
(2)离子反应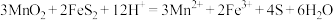 中,被氧化的元素是
中,被氧化的元素是_______ 和_______ 。
(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是_______ ,所需要的玻璃仪器除烧杯和玻璃棒外,还需要_______ 。
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:______ 。
 _______
_______
 ,含少量
,含少量 、
、 )和黄铁矿(主要成分是
)和黄铁矿(主要成分是 ,含少量)为原料制备
,含少量)为原料制备 ,实验流程如下:
,实验流程如下: 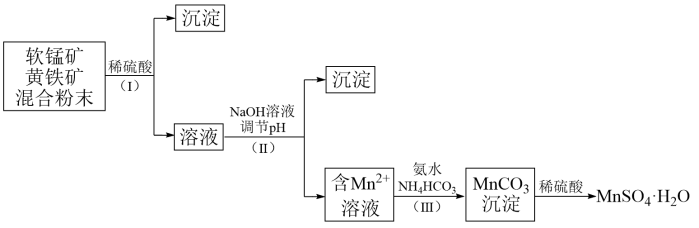
(1)与稀硫酸反应前,将黄铁矿和软锰矿混合研磨的目的是
(2)离子反应
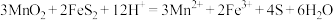 中,被氧化的元素是
中,被氧化的元素是(3)步骤(Ⅰ)中分离溶液和沉淀的操作名称是
(4)步骤(Ⅱ)中加入NaOH溶液调节pH,是为了完全沉淀
 、
、 ,写出生成
,写出生成 沉淀的离子方程式:
沉淀的离子方程式:(5)将步骤(Ⅲ)中发生反应的离子方程式补充完整:
 _______
_______
您最近一年使用:0次
2024-03-29更新
|
153次组卷
|
2卷引用:福建省厦门英才学校2023-2024学年高一下学期3月月考化学试卷(学考)
10 . 氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)已知铋(Bi)为+3价时较稳定,铋酸钠( )溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰(
)溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰( )溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
则 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ 。
(2)碘酸钾( )是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备
)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备 的方法是将
的方法是将 与KOH溶液共热,生成
与KOH溶液共热,生成 、
、 和另一种化合物。
和另一种化合物。
①该反应中被氧化的I原子与被还原的I原子的个数之比为___________ 。
②已知 ,则检验食盐中含
,则检验食盐中含 时,除食盐外至少还需要下列试剂中的哪几种
时,除食盐外至少还需要下列试剂中的哪几种___________ (填字母)
a.稀硝酸 b.食醋 c.淀粉溶液 d.蒸馏水 e.KI固体 f.KI-淀粉试纸
③碘酸钾在酸性环境下可以与亚硫酸钠反应制备碘单质,完成下面的离子方程式:______________ 。
 。
。
(3)某反应体系有反应物和生成物共7种: 、
、 、
、 、
、 、
、 、
、 、
、 。已知该反应过程中产生气泡,试回答下列问题:
。已知该反应过程中产生气泡,试回答下列问题:
①该反应中,还原剂是___________ (填化学式)。
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移方向和数目___________ 。
(1)已知铋(Bi)为+3价时较稳定,铋酸钠(
 )溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰(
)溶液呈无色,淀粉溶液遇碘单质变蓝。现取一定量的硫酸锰( )溶液,向其中依次滴加下列溶液,对应的现象如下表所示:
)溶液,向其中依次滴加下列溶液,对应的现象如下表所示:| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI-淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
 、
、 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)碘酸钾(
 )是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备
)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备 的方法是将
的方法是将 与KOH溶液共热,生成
与KOH溶液共热,生成 、
、 和另一种化合物。
和另一种化合物。①该反应中被氧化的I原子与被还原的I原子的个数之比为
②已知
 ,则检验食盐中含
,则检验食盐中含 时,除食盐外至少还需要下列试剂中的哪几种
时,除食盐外至少还需要下列试剂中的哪几种a.稀硝酸 b.食醋 c.淀粉溶液 d.蒸馏水 e.KI固体 f.KI-淀粉试纸
③碘酸钾在酸性环境下可以与亚硫酸钠反应制备碘单质,完成下面的离子方程式:
 。
。(3)某反应体系有反应物和生成物共7种:
 、
、 、
、 、
、 、
、 、
、 、
、 。已知该反应过程中产生气泡,试回答下列问题:
。已知该反应过程中产生气泡,试回答下列问题:①该反应中,还原剂是
②请正确书写反应的化学方程式并用单线桥法标出反应中电子转移方向和数目
您最近一年使用:0次



