1 . Ⅰ.下面两个方法都可以用来制氯气:①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
(1)反应①的离子方程式为___________ 。
(2)浓盐酸在反应①中表现出来的性质是___________。
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为___________ 。
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为___________ 。
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。___________ (填名称)。
(6)装置③中现象是___________ ,装置④中有一处错误,更正为___________ 。
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为___________ 。
 MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:(1)反应①的离子方程式为
(2)浓盐酸在反应①中表现出来的性质是___________。
| A.只有还原性 | B.只有氧化性 | C.只有酸性 | D.既表还原性和又表酸性 |
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。
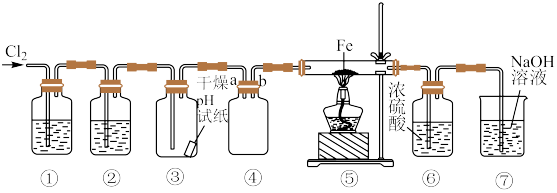
(6)装置③中现象是
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
3 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
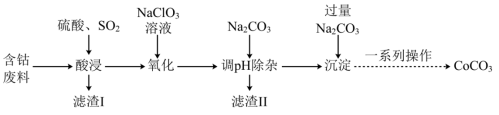
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
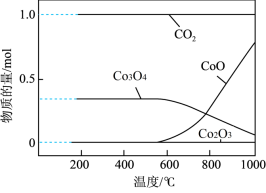
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
名校
解题方法
4 . 守恒是重要的科学原理,我们在学习化学的过程中接触过很多守恒:质量守恒、原子守恒、电子守恒、电荷守恒等。请回答以下问题:
(1)某溶液中只有 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(2)同温同压下,某集气瓶充满 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为___________ 。
(3)在浓盐酸中 与
与 反应的离子方程式为:
反应的离子方程式为: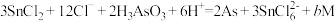 ,则b的数值为
,则b的数值为___________ 。
(4)在100mL 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(5)已知:1mol 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是___________ mol。
(1)某溶液中只有
 、
、 、
、 和
和 四种离子,已知
四种离子,已知 、
、 、
、 的物质的量浓度分别2mol/L、1mol/L、1mol/L,则
的物质的量浓度分别2mol/L、1mol/L、1mol/L,则 的物质的量浓度为
的物质的量浓度为(2)同温同压下,某集气瓶充满
 时为116g,充满
时为116g,充满 时为122g,充满气体A时为114g,则A的相对分子质量为
时为122g,充满气体A时为114g,则A的相对分子质量为(3)在浓盐酸中
 与
与 反应的离子方程式为:
反应的离子方程式为: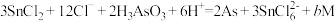 ,则b的数值为
,则b的数值为(4)在100mL
 溶液中通入2.24L氯气(标准状况);溶液中有1/2的
溶液中通入2.24L氯气(标准状况);溶液中有1/2的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为(5)已知:1mol
 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、NO和
、NO和 ,表现氧化性的硝酸的物质的量是
,表现氧化性的硝酸的物质的量是
您最近一年使用:0次
名校
解题方法
5 . 《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠( ,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为
,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为 ,
,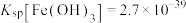 。下列叙述正确的是
。下列叙述正确的是
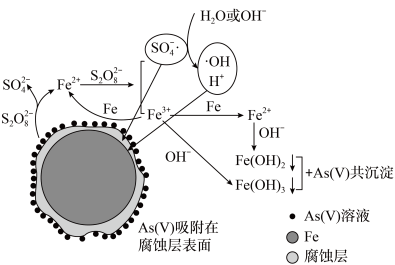
A.1 mol过硫酸钠( )含 )含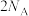 个过氧键 个过氧键 |
B.若56 g Fe参加反应,共有 个 个 被还原 被还原 |
C.室温下,中间产物 溶于水所得饱和溶液中 溶于水所得饱和溶液中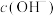 为 为 mol⋅L mol⋅L |
| D.pH越小,越有利于去除废水中的正五价砷 |
您最近一年使用:0次
6 . 实验室制取A并进一步制取无水FeCl3的实验装置如图所示。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。
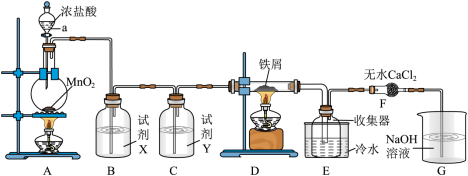
回答下列问题:
(1)仪器a的名称是_______ ,装置A所发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)试剂X是_______ 。
(3)装置F中无水CaCl2的作用是_______
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______ 。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。

回答下列问题:
(1)仪器a的名称是
(2)试剂X是
(3)装置F中无水CaCl2的作用是
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO
 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次
解题方法
7 .  是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾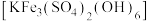 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
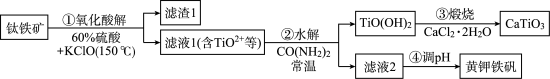
部分原料价格表:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)步骤①滤渣1的主要成分是_______ ,若氧化酸解的氧化剂用 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为_______ ,相同条件下,用 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是_______ 。
(3)已知 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为_______ ;常温下,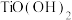
 为
为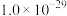 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为_______ 。
(4)步骤③反应的化学方程式为_______ ,若在实验室煅烧,用到的实验仪器除了玻璃棒、酒精灯、三脚架及泥三角外,还需要_______ 。
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
 是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾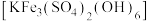 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
| 物质 | 纯碱(99% ) ) | 氢氧化钾(90% ) ) | 碳酸钾(99% ) ) | 液氨(99.9%) |
| 价格(元/吨) | 1800 | 4000 | 4500 | 25000 |
 中Ti的化合价为
中Ti的化合价为(2)步骤①滤渣1的主要成分是
 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是(3)已知
 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为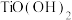
 为
为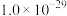 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为(4)步骤③反应的化学方程式为
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
A. | B. | C. | D. |
您最近一年使用:0次
2024-03-28更新
|
111次组卷
|
3卷引用:2024届四川省雅安市高三上学期第一次诊断性考试理综试题
8 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
解题方法
9 .  是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是

 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
A.每个 晶胞中 晶胞中 个数为x 个数为x |
B.每个 晶胞中0价Cu原子个数为 晶胞中0价Cu原子个数为 |
C.每个 晶胞完全转化为 晶胞完全转化为 晶胞,转移电子数为2 晶胞,转移电子数为2 |
D.当 转化为 转化为 时,每转移 时,每转移 电子,产生 电子,产生 原子 原子 |
您最近一年使用:0次
10 . 固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
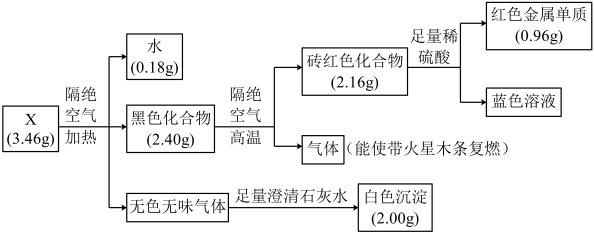
| A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族 |
| B.固体化合物X为Cu2(OH)2CO3 |
| C.黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 |
| D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 |
您最近一年使用:0次



