1 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以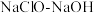 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(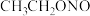 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以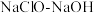 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(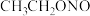 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入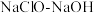 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成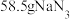 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
名校
2 . 二氧化硫对环境有一定的负面影响,对 的处理和利用是科学研究的重要课题之一。
的处理和利用是科学研究的重要课题之一。
 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下: 的一种常用方法,其总反应的化学方程式为
的一种常用方法,其总反应的化学方程式为___________ 。
②研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。___________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(2)生产中,需要向反应的溶液中加入适量强还原剂,其目的是___________ 。
(3)反应 所得的滤液中所含阳离子的电子式为
所得的滤液中所含阳离子的电子式为___________ ,检验该滤液中所含阴离子的方法是:取少量滤液于试管中,___________ 。
(4)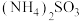 可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用
可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用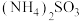 溶液吸收NO的离子方程式
溶液吸收NO的离子方程式___________ 。
 .
. 还原法也是处理硫酸厂废气的方法之一、400℃时,将
还原法也是处理硫酸厂废气的方法之一、400℃时,将 和含
和含 的尾气按一定比例混合,以一定流速通过装有
的尾气按一定比例混合,以一定流速通过装有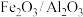 的负载型催化剂(
的负载型催化剂( 为催化剂,
为催化剂, 为载体),发生反应。
为载体),发生反应。
(5)该反应生成s单质和水,其中氧化剂和还原剂的物质的量之比为___________ 。
 的处理和利用是科学研究的重要课题之一。
的处理和利用是科学研究的重要课题之一。 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
 的一种常用方法,其总反应的化学方程式为
的一种常用方法,其总反应的化学方程式为②研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。

a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(2)生产中,需要向反应的溶液中加入适量强还原剂,其目的是
(3)反应
 所得的滤液中所含阳离子的电子式为
所得的滤液中所含阳离子的电子式为(4)
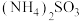 可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用
可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用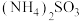 溶液吸收NO的离子方程式
溶液吸收NO的离子方程式 .
. 还原法也是处理硫酸厂废气的方法之一、400℃时,将
还原法也是处理硫酸厂废气的方法之一、400℃时,将 和含
和含 的尾气按一定比例混合,以一定流速通过装有
的尾气按一定比例混合,以一定流速通过装有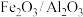 的负载型催化剂(
的负载型催化剂( 为催化剂,
为催化剂, 为载体),发生反应。
为载体),发生反应。(5)该反应生成s单质和水,其中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
3 . 实验室用磷矿脱镁废液制备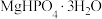 的实验过程可表示为
的实验过程可表示为 及少量
及少量 、
、 、
、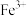 、
、 和
和 。
。
①向废液中加入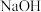 溶液调节
溶液调节 为
为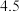 ,可达到
,可达到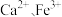 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为_________ 。
②将除杂净化后的清液控制在一定温度,加入 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是_______ 。 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是_______ 。
(2)实验室用如下方案测定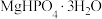 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取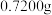 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成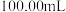 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用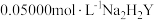 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗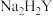 标准液
标准液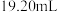 。计算该产品中
。计算该产品中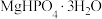 的纯度
的纯度_______ (写出计算过程)。
(3)恒温转化后的母液中主要含 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下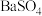 、
、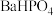 的溶度积常数依次为
的溶度积常数依次为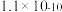 和
和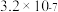 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中_______ ,过滤、用无水乙醇洗涤,干燥。
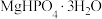 的实验过程可表示为
的实验过程可表示为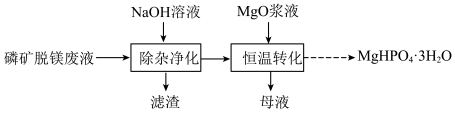
 及少量
及少量 、
、 、
、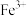 、
、 和
和 。
。①向废液中加入
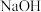 溶液调节
溶液调节 为
为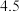 ,可达到
,可达到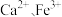 和
和 的最佳沉淀效果。其中
的最佳沉淀效果。其中 转化为
转化为 的离子方程式为
的离子方程式为②将除杂净化后的清液控制在一定温度,加入
 浆液搅拌即可获得
浆液搅拌即可获得 固体。实验测得镁回收率、产品纯度与反应后溶液
固体。实验测得镁回收率、产品纯度与反应后溶液 关系如图所示。
关系如图所示。 小于6时,随着
小于6时,随着 增大,镁回收率上升,其原因是
增大,镁回收率上升,其原因是
 大于6时,随着
大于6时,随着 增大,产品纯度逐渐下降,其可能原因是
增大,产品纯度逐渐下降,其可能原因是(2)实验室用如下方案测定
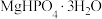 产品(含有
产品(含有 杂质)的纯度:准确称取
杂质)的纯度:准确称取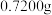 磷酸氢镁产品,加入足量稀硫酸溶解后配成
磷酸氢镁产品,加入足量稀硫酸溶解后配成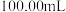 溶液。准确移取
溶液。准确移取 于锥形瓶中,用
于锥形瓶中,用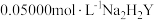 标准液滴定(离子方程式为
标准液滴定(离子方程式为 )至终点,平行滴定三次,平均消耗
)至终点,平行滴定三次,平均消耗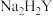 标准液
标准液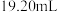 。计算该产品中
。计算该产品中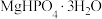 的纯度
的纯度(3)恒温转化后的母液中主要含
 和
和 。已知:水溶液中各含磷微粒的分布如图-2所示,
。已知:水溶液中各含磷微粒的分布如图-2所示, 和
和 的溶解度曲线如图-3所示;常温下
的溶解度曲线如图-3所示;常温下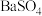 、
、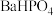 的溶度积常数依次为
的溶度积常数依次为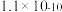 和
和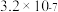 。请补充完整由恒温转化后的母液制备
。请补充完整由恒温转化后的母液制备 晶体的实验方案:用比浊法测定母液中
晶体的实验方案:用比浊法测定母液中 的浓度后,在搅拌下向一定体积的母液中
的浓度后,在搅拌下向一定体积的母液中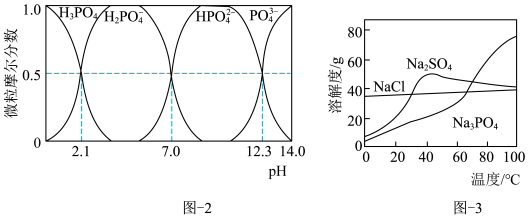
您最近一年使用:0次
4 . 工业上处理含铬( )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:
Ⅰ. 还原法:含铬酸性废水
还原法:含铬酸性废水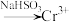 (含
(含 等)
等) 沉淀(含
沉淀(含 等沉淀)
等沉淀)
Ⅱ.电解法:含铬酸性废水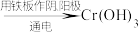 沉淀[含
沉淀[含 等沉淀]
等沉淀]
下列说法错误的是
 )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:Ⅰ.
 还原法:含铬酸性废水
还原法:含铬酸性废水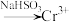 (含
(含 等)
等)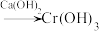 沉淀(含
沉淀(含 等沉淀)
等沉淀)Ⅱ.电解法:含铬酸性废水
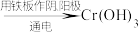 沉淀[含
沉淀[含 等沉淀]
等沉淀]下列说法错误的是
A. 和 和 中的S原子都采用 中的S原子都采用 杂化 杂化 |
B.Ⅰ和Ⅱ中,等量的 发生还原反应时消耗的 发生还原反应时消耗的 的量不同 的量不同 |
C.Ⅰ中参加反应的 |
D.Ⅱ中处理含 的废水转移6mol电子 的废水转移6mol电子 |
您最近一年使用:0次
5 . 12.8gCu和0.1L硝酸溶液反应,铜固体完全溶解,反应后生成标准状况下4.48L的NO和 气体(忽略溶液体积变化),向反应后的溶液中加入
气体(忽略溶液体积变化),向反应后的溶液中加入 的氢氧化钠溶液至
的氢氧化钠溶液至 沉淀完全,消耗氢氧化钠溶液0.2L,则该硝酸的浓度为
沉淀完全,消耗氢氧化钠溶液0.2L,则该硝酸的浓度为
 气体(忽略溶液体积变化),向反应后的溶液中加入
气体(忽略溶液体积变化),向反应后的溶液中加入 的氢氧化钠溶液至
的氢氧化钠溶液至 沉淀完全,消耗氢氧化钠溶液0.2L,则该硝酸的浓度为
沉淀完全,消耗氢氧化钠溶液0.2L,则该硝酸的浓度为A.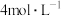 | B. | C.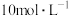 | D.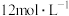 |
您最近一年使用:0次
2024·湖南长沙·三模
名校
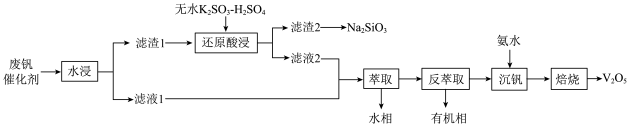
6 . 钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含V2O5、VOSO4、K2SO4、SiO2以及少量的Fe2O3等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下: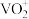 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是___________ 。
(2)“滤渣2”转化为Na2SiO3的化学方程式是___________ 。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是___________ 。
②过程中除了有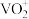 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为___________ 。
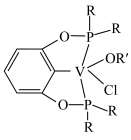
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供___________ (选填“孤对电子”或“空轨道”)。 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在___________ 环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2______ mol。
 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。(1)“水浸”前,通常需要将催化剂粉碎,其目的是
(2)“滤渣2”转化为Na2SiO3的化学方程式是
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是
②过程中除了有
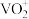 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供
 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2
您最近一年使用:0次
7 . I.某些常见无机物质存在如图的化学转化关系(部分生成物和反应条件略去),回答下列问题:________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为________ ,当 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为________ 。
(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式________ 。戊是氢氧化物,既能和强酸反应又能和强碱反应,则甲的化学式为________ 。
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:____________ 。
(5)X的化学式为________ ,X能和浓盐酸反应生成黄绿色气体,X在反应中作________ (填“氧化剂”或“还原剂”),若反应了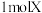 ,该反应转移电子的个数为
,该反应转移电子的个数为________ 。
(2)若甲是一种淡黄色固体,丙是一种温室气体,则X的化学式为
 甲和水生成乙和戊时,反应转移电子的物质的量为
甲和水生成乙和戊时,反应转移电子的物质的量为(3)若甲是由两种常见的元素组成的化合物,乙是气体且水溶液呈碱性,X为大气中的一种主要成分,写出丁与水反应的化学方程式
Ⅱ.固体化合物X由3种元素组成,其转化关系如图,混合气体经过无水
 时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题:
时,固体变蓝,碱性溶液焰色反应为黄色。回答下列问题: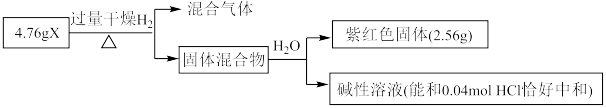
(5)X的化学式为
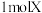 ,该反应转移电子的个数为
,该反应转移电子的个数为
您最近一年使用:0次
8 . 二氧化铈(CeO2)作为一种脱硝催化剂,能在Ce4+和Ce3+之间改变氧化状态,将NO氧化为NO2,并引起氧空位的形成,得到新的铈氧化物[Cex(Ⅲ)Cey(Ⅳ)Oz]。当二氧化铈晶胞发生如下图变化时,有关说法错误的是
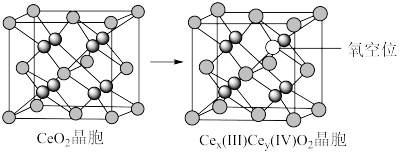
| A.铈位于氧原子形成的八面体空隙中 |
| B.生成新的铈氧化物中x、y、z的最简整数比为2:2:7,当1 mol CeO2发生变化时,可吸收标况下NO的体积为5.6 L |
C.晶胞的俯视图为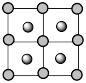 |
D.若晶胞边长为a pm,则CeO2晶体的密度为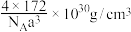 (NA表示阿伏加德罗常数的值) (NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
名校
解题方法
9 . 乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i: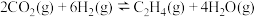
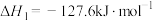
反应ii: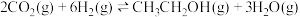
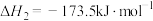
反应iii: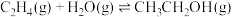
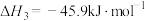
请回答下列问题:
(1)已知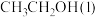 的燃烧热(
的燃烧热( )为
)为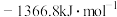 ,表示
,表示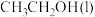 燃烧热的热化学方程式为
燃烧热的热化学方程式为________ 。
(2)在一定温度下,向2L恒容密闭容器中充入 和
和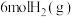 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如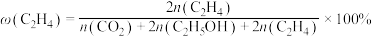 ]与时间的关系如图所示。
]与时间的关系如图所示。
①表示乙烯占比的曲线是________ (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数K=________ (保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为 、
、 ,适当升温后,
,适当升温后,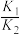
________ (填“增大”“减小”或“无法判断”),理由是________ 。
(3)近日,中国科学技术大学某课题组以Pd掺杂的 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)(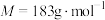 )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。________ ,CD段发生反应的化学方程式为________ 。
反应i:
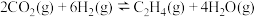
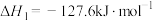
反应ii:
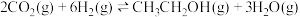
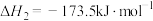
反应iii:
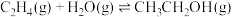
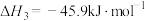
请回答下列问题:
(1)已知
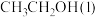 的燃烧热(
的燃烧热( )为
)为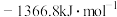 ,表示
,表示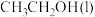 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)在一定温度下,向2L恒容密闭容器中充入
 和
和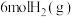 ,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如
,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如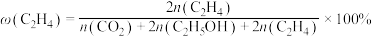 ]与时间的关系如图所示。
]与时间的关系如图所示。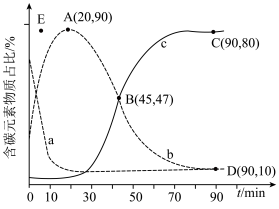
①表示乙烯占比的曲线是
②若选择对反应i催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应iii的平衡常数K=
④设反应i和反应ii的化学平衡常数分别为
 、
、 ,适当升温后,
,适当升温后,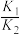
(3)近日,中国科学技术大学某课题组以Pd掺杂的
 原子层为原型,在温和条件下,通过
原子层为原型,在温和条件下,通过 光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴(
光还原合成乙酸,获得选择性近100%的好成绩。草酸钴是制备钻的氧化物的重要原料,二水合草酸钴( )(
)( )在空气中受热时固体质量随温度变化的曲线如图所示。
)在空气中受热时固体质量随温度变化的曲线如图所示。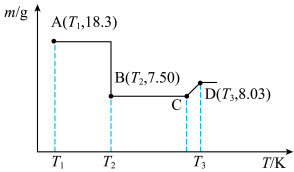
您最近一年使用:0次
名校
解题方法
10 . 某课题组利用工业废气中的NO制备NH4NO3的工艺流程如图所示,若装置Ⅰ和装置Ⅱ中反应后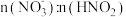 都为
都为 (不考虑HNO2电离),下列说法错误的是
(不考虑HNO2电离),下列说法错误的是
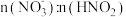 都为
都为 (不考虑HNO2电离),下列说法错误的是
(不考虑HNO2电离),下列说法错误的是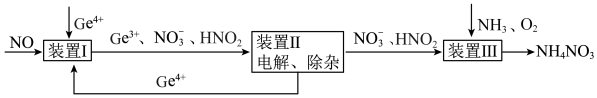
A.装置Ⅰ中反应的离子方程式为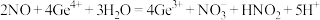 |
| B.装置Ⅰ中若有5.6L(标准状况下)NO参与反应,则转移0.5mol电子 |
C.装置Ⅲ中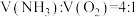 ,可实现原子利用率最大化 ,可实现原子利用率最大化 |
D.装置Ⅲ发生的氧化还原反应中氧化剂和还原剂物质的量之比为 |
您最近一年使用:0次



