名校
解题方法
1 . 工业上利用石煤矿粉(主要含 及少量
及少量 、
、 )为原料生产
)为原料生产 ,工艺流程如下:
,工艺流程如下:

已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为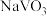 、
、 、
、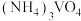 ;
;
②不同pH下,V(V)在溶液中的主要存在形式见下表:
③25℃时, 。
。
回答下列问题:
(1)“焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(2)滤液Ⅰ的成分为_______ (填化学式);先“转沉”后“转化”的目的是_______ 。
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到_______ 操作单元中循环使用。
(4)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是①
,其原因是①_______ 。②_______ ;25℃时,测得“转化”后,滤液中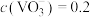 mol·L
mol·L ,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中
,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中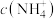 至少
至少_______ mol·L 。
。
(5)“煅烧”时, 制得产品
制得产品 。但反应体系中,若不及时分离气体Ⅱ,部分
。但反应体系中,若不及时分离气体Ⅱ,部分 会转化成
会转化成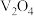 ,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为_______ 。
 及少量
及少量 、
、 )为原料生产
)为原料生产 ,工艺流程如下:
,工艺流程如下:
已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为
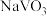 、
、 、
、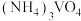 ;
;②不同pH下,V(V)在溶液中的主要存在形式见下表:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  | 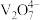 | 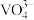 |
 。
。回答下列问题:
(1)“焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(2)滤液Ⅰ的成分为
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到
(4)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是①
,其原因是①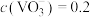 mol·L
mol·L ,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中
,为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中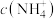 至少
至少 。
。(5)“煅烧”时,
 制得产品
制得产品 。但反应体系中,若不及时分离气体Ⅱ,部分
。但反应体系中,若不及时分离气体Ⅱ,部分 会转化成
会转化成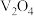 ,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
您最近一年使用:0次
2023-02-08更新
|
2139次组卷
|
4卷引用:山东省济南市2023届高三下学期学情检测(一模)化学试题
名校
解题方法
2 . 工业上以黄铁矿(主要成分为FeS2,含有少量NiS、CuS、SiO2等杂质)为原料制备K4[Fe(CN)6]•3H2O,工艺流程如图:
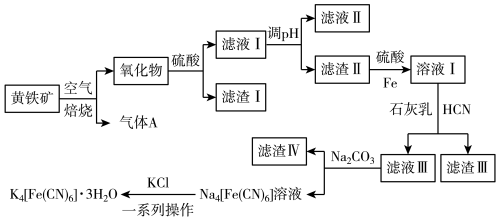
下列说法错误的是

下列说法错误的是
| A.“焙烧”时氧化产物有Fe2O3和SO2 |
| B.“调pH”分离Fe3+与Cu2+、Ni2+是利用了它们氢氧化物Ksp的不同 |
| C.“溶液Ⅰ”中主要反应的离子方程式为6OH-+6HCN+Fe2+=[Fe(CN)6]4-+6H2O |
| D.“一系列操作”为过滤、洗涤、干燥 |
您最近一年使用:0次
2022-03-22更新
|
2180次组卷
|
12卷引用:山东省济南市2022届高三3月高考模拟考试(一模)化学试题
山东省济南市2022届高三3月高考模拟考试(一模)化学试题山东省济南第一中学2023届高三上学期开学考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(不定项选择题)湖北省枣阳市第一中学2022届高三下学期5月第三次模拟考试化学试题(已下线)专题13 物质的反应和转化-2022年高考真题模拟题分项汇编(已下线)2022年山东省高考真题变式题(不定项选择题)湖南省湘西自治州古丈县第一中学2021-2022学年高三下学期第二次模拟化学试题湖南省邵阳市第二中学2022-2023学年高三上学期第五次月考化学试题湖南省怀化市会同县第一中学2021-2022学年高三下学期第二次调研考试化学试题湖南省怀化市沅陵县第二中学2021-2022学年高三下学期四月第一次调研考试化学试题(已下线)学科特色7 工艺流程推断湖南省衡阳市第一中学2023届高三下学期第四次月考化学试题
名校
3 . 下列有关Fe3+、Fe2+的性质及应用的说法正确的是
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
①向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液,黄色逐渐消失,加KSCN后溶液颜色不变
②将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
③向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
④将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体
⑤向Fe2(SO4)3溶液中加入过量铁粉的离子方程式:Fe3++Fe=2Fe2+
⑥Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
| A.①②⑥ | B.①②③ | C.①④⑤ | D.②④⑥ |
您最近一年使用:0次
2021-12-18更新
|
4233次组卷
|
10卷引用:山东省济南第三中学2022-2023学年高一上学期12月月考化学试题
山东省济南第三中学2022-2023学年高一上学期12月月考化学试题吉林省洮南市第一中学2021-2022学年高一上学期第三次月考化学试题黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期12月月考化学试题江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题天津市南开区崇化中学2022-2023学年高一上学期期末质量检测化学试题江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题广东省汕尾华大实验学校2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题新疆乌鲁木齐市高级中学2023-2024学年高一上学期1月期末化学试题山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
真题
名校
4 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________ 、_______________ 。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________ 。
②将下列实验操作步骤正确排序___________________ (填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________ (列式表示)。若实验时按a、d次序操作,则使x__________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
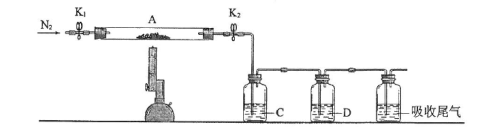
①C、D中的溶液依次为_________ (填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是
②将下列实验操作步骤正确排序
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式
您最近一年使用:0次
2017-08-08更新
|
9178次组卷
|
30卷引用:山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题
山东济南市历城第二中学2020-2021学年高二上学期开学考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)安徽省六安市第一中学2017-2018学年高二上学期开学考试化学试题四川省双流中学2017-2018学年高二上学期开学考试化学试题江西省上高二中2018届高三上学期第三次月考化学试题(已下线)《考前20天终极攻略》-5月27日 综合实验设计、探究和评价(已下线)解密18 物质的制备、实验方案的设计与评价——备战2018年高考化学之高频考点解密百所名校联考-金属及其化合物吉林省延边市第二中学2020届高三入学考试化学试题安徽省黄山市屯溪第一中学2019-2020学年高二上学期入学摸底考试化学试题2020届高考化学二轮复习大题精准训练——定量分析化学实验中物质含量的测定2020届高考化学二轮复习大题精准训练——化学实验方案的设计及评价河北省衡水中学2020届高三四月份质量监测理综化学试题湖南省长沙市长郡中学2020届高三4月份教学质量监测理综化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题河北省石家庄市第二中学2020届高中毕业班二月份网络教学质量监测卷理科综合化学部分河南省郑州市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题2020届湖南省长沙市礼雅中学高中毕业班四月份网络教学质量监测卷理科综合化学部分贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)第3章 第2节 硫的转化 高考帮福建省福州市第二中学2021届高三上学期第一次月考化学试题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第一节 硫及其化合物云南省保山第九中学2021届高三上学期开学考试化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题(已下线)【教材实验热点】04 Fe(OH)2与Fe(OH)3胶体的制备云南省普洱市第一中学2021-2022学年高三下学期3月份考试理综化学试题(已下线)专题26 定量测定类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型31 Fe2+、Fe3+的检验与性质探究
名校
5 . 实验室利用钴渣[含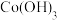 、
、 等]制备
等]制备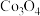 的流程如图所示:
的流程如图所示:

已知: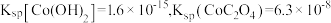
下列说法正确的是
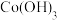 、
、 等]制备
等]制备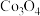 的流程如图所示:
的流程如图所示:
已知:
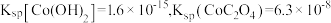
下列说法正确的是
A.“溶解还原”过程中得到的 与消耗的 与消耗的 物质的量之比为 物质的量之比为 |
B.“沉钴”时,不用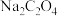 溶液是为了防止溶液碱性太强而生成 溶液是为了防止溶液碱性太强而生成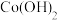 沉淀 沉淀 |
C.可以用氢氧化钠溶液检验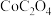 固体是否洗涤干净 固体是否洗涤干净 |
D.“焙烧”的方程式为 |
您最近一年使用:0次
2023-04-21更新
|
915次组卷
|
5卷引用:山东省济南市2023届高三下学期学情检测(二模)化学试题
名校
解题方法
6 . 钌(Ru)是一种极其昂贵的稀有贵金属,广泛应用于电子、航空航天、石油化工、有机合成等领域。钌的矿产资源很少,因此从含钌废液中回收钌尤为重要。某含钌的废渣主要成分为Ru、 、
、 、
、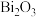 ,回收钌的工艺流程如下:
,回收钌的工艺流程如下:
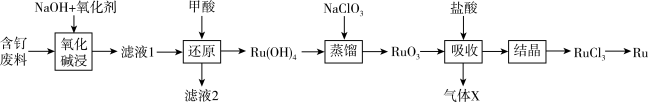
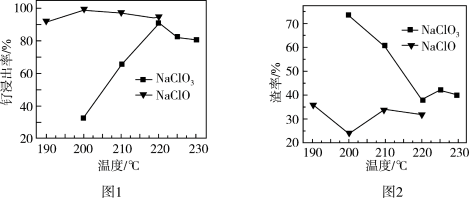
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为_______ ;最佳反应温度为_______ 。
(2)滤液1中溶质的主要成分包括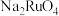 、
、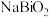 、
、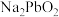 等,其中Si的存在形式为
等,其中Si的存在形式为_______ (填化学式); 转化为
转化为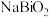 的化学方程式为
的化学方程式为_______ 。
(3)滤液1先用盐酸调节滤液pH,后用甲酸“还原”提取钌并同时生成 ,则该过程的离子方程式为
,则该过程的离子方程式为_______ ;“蒸馏”过程中氧化剂与还原剂的物质的量之比为_______ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为_______ 、_______ 。
(5)可用氢气还原重量法测定产品中 的纯度,所得实验数据记录如下:
的纯度,所得实验数据记录如下:
则产品的纯度为_______ (保留小数点后一位)。
 、
、 、
、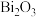 ,回收钌的工艺流程如下:
,回收钌的工艺流程如下:
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为

(2)滤液1中溶质的主要成分包括
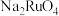 、
、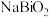 、
、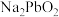 等,其中Si的存在形式为
等,其中Si的存在形式为 转化为
转化为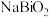 的化学方程式为
的化学方程式为(3)滤液1先用盐酸调节滤液pH,后用甲酸“还原”提取钌并同时生成
 ,则该过程的离子方程式为
,则该过程的离子方程式为(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢气还原重量法测定产品中
 的纯度,所得实验数据记录如下:
的纯度,所得实验数据记录如下:| 实验序号 | 产品的质量/g | 固体Ru的质量/g |
| ① | 2.4225 | 1.0110 |
| ② | 2.4225 | 1.0090 |
| ③ | 2.4225 | 1.0100 |
您最近一年使用:0次
2022-08-03更新
|
919次组卷
|
4卷引用:山东省历城第二中学等学校2023届高三上学期10月月考联合考试化学试题
山东省历城第二中学等学校2023届高三上学期10月月考联合考试化学试题 青海省海东市第一中学2022届高三第二次模拟考试理科综合化学试题(已下线)专题讲座(八) 无机化工流程题的解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)山东省泰安新泰市第一中学(实验部)2023-2024学年高三上学期第一次质量检测化学试题
名校
解题方法
7 . 利用物质类别及核心元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系。回答下列问题:

(1)质量相同的a和b,物质的量之比为_______ 。将H2S与a混合,发生反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为_______ 。
(3)将足量的a通入BaCl2溶液中,下列说法正确的是_______ (填标号)。
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
(5)已知e为正盐,且能被酸性K2Cr2O7氧化为Na2SO4,Cr2O 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:_______ 。

(1)质量相同的a和b,物质的量之比为
(2)c的浓溶液能与S反应产生一种气体,该气体的化学式为
(3)将足量的a通入BaCl2溶液中,下列说法正确的是
A.溶液中出现白色沉淀
B.溶液没有明显变化
C.若再通入Cl2或NH3,则溶液中均会出现白色沉淀
(4)宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理:4Ag+2H2S+O2=2Ag2S + 2H2O。H2S在该反应中_______(填标号)。
| A.是氧化剂 | B.是还原剂 |
| C.既是氧化剂也是还原剂 | D.既不是氧化剂也不是还原剂 |
 被还原为Cr3+,写出此反应的离子方程式:
被还原为Cr3+,写出此反应的离子方程式:
您最近一年使用:0次
2022-02-22更新
|
930次组卷
|
3卷引用:山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题(已下线)第03讲 硫酸根离子的检验 含硫物质的转化(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册) 辽宁省朝阳市建平县实验中学2021-2022学年高一下学期期中考试化学试题
8 . 玻璃仪器内壁残留的硫单质可用热NaOH溶液洗涤除去,发生如下反应:
①3S+ 6NaOH 2Na2S+ Na2SO3+ 3H2O
2Na2S+ Na2SO3+ 3H2O
②(x-1)S+Na2S Na2Sx (x=2~6)
Na2Sx (x=2~6)
③S+ Na2SO3 Na2S2O3
Na2S2O3
下列说法正确的是
①3S+ 6NaOH
 2Na2S+ Na2SO3+ 3H2O
2Na2S+ Na2SO3+ 3H2O②(x-1)S+Na2S
 Na2Sx (x=2~6)
Na2Sx (x=2~6)③S+ Na2SO3
 Na2S2O3
Na2S2O3下列说法正确的是
| A.反应①②③中,硫单质的作用相同 |
| B.反应①中,每消耗1 mol硫单质转移4 mol电子 |
| C.0.96g硫单质与amL2mol·L-1热NaOH溶液恰好完全反应,只生成Na2S和Na2SO3,则a= 60 |
| D.1.28 g硫单质与10 mL 2 mol·L-1热NaOH溶液恰好完全反应,只生成Na2Sx和Na2S2O3,则x=5 |
您最近一年使用:0次
2022-05-21更新
|
1614次组卷
|
9卷引用:山东省济南市2022届高三下学期5月模拟考试(三模)化学试题
山东省济南市2022届高三下学期5月模拟考试(三模)化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第06讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(全国通用)山东省潍坊五县市2022-2023学年高三上学期10月质量检测联考化学试题山东省济宁市育才中学2022-2023学年高三10月线上阶段性检测化学试题山东省济宁市第一中学2022-2023学年高三上学期第一次月考化学试题福建省厦门双十中学2022-2023学年高三上学期期中考试化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省济宁市第一中学2024届高三下学期4月份定时检测化学试题
名校
9 . 草酸镍 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
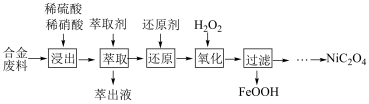
已知:①“浸出”液含有的离子主要有 ;
;
② 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。
③草酸的

回答下列问题:
(1)生产时为提高合金废料浸出率,常采取的措施有___________ (填字母)。
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是___________ 。
(3)“氧化”过程中,控制 、pH小于3的条件下进行。
、pH小于3的条件下进行。
① 的电子式为
的电子式为___________ ②“氧化”过程的离子方程式为___________ 。
③ 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是___________ 。
(4)“过滤”后的滤液中加入 溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是
溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是___________ 。已知常温下 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度
___________ 。
(5)在空气中加热二水合草酸镍得到如下 热分解曲线如图所示,已知:
热分解曲线如图所示,已知: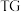 指的是在程序控制温度下测量待测样品的质量与温度变化关系,
指的是在程序控制温度下测量待测样品的质量与温度变化关系, 指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为___________ 。二水合草酸镍分解的整个反应是___________ (填“吸热”或“放热”)反应。
 是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
是一种不溶于水的浅绿色粉末,常用于制镍催化剂和镍粉等。以铜镍合金废料(主要成分为镍和铜,含有一定量的铁和硅)为原料生产草酸镍的工艺流程如图:
已知:①“浸出”液含有的离子主要有
 ;
;②
 增大,
增大, 被氧化的速率加快,同时生成的
被氧化的速率加快,同时生成的 水解形成更多的胶体能吸附
水解形成更多的胶体能吸附 。
。③草酸的


回答下列问题:
(1)生产时为提高合金废料浸出率,常采取的措施有
a.适当延长浸出时间 b.高温浸出 c.分批加入混酸浸取并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是
(3)“氧化”过程中,控制
 、pH小于3的条件下进行。
、pH小于3的条件下进行。①
 的电子式为
的电子式为③
 为3~4时,镍的回收率降低的原因是
为3~4时,镍的回收率降低的原因是(4)“过滤”后的滤液中加入
 溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是
溶液反应得到草酸镍,过滤得到的草酸镍需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是 ,当溶液
,当溶液 时,
时, 沉淀完全[
沉淀完全[ 时认为完全沉淀],则此时溶液中草酸的浓度
时认为完全沉淀],则此时溶液中草酸的浓度
(5)在空气中加热二水合草酸镍得到如下
 热分解曲线如图所示,已知:
热分解曲线如图所示,已知: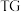 指的是在程序控制温度下测量待测样品的质量与温度变化关系,
指的是在程序控制温度下测量待测样品的质量与温度变化关系, 指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则
指通过单独的加热器补偿样品在加热过程中发生的热量变化,以保持样品和参比物的温差为零。这种补偿能量即样品吸收(峰向下)或放出(峰向上)的热量。则 时,反应的化学方程式为
时,反应的化学方程式为
您最近一年使用:0次
2023-06-04更新
|
642次组卷
|
2卷引用:山东师范大学附属中学2023届高三下学期6月模拟考试化学试题
名校
解题方法
10 . 利用工业钒铬废液(主要成分为NaVO3和Na2CrO4)制备NH4VO3和Na2CrO4晶体的流程如下:
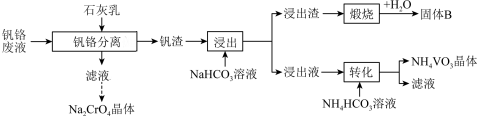
已知:I.“钒渣”的主要成分为Ca3(VO4)2;NH4VO3在pH=7~8时溶解度最小。
Ⅱ.随pH的变化,含铬微粒的变化存在2CrO +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。
回答下列问题:
(1)“钒铬分离”时,为了提高石灰乳的利用率,可采取的措施是___________ 。
(2)获取Na2CrO4晶体后,含铬废水需经过“酸化→还原→沉降”方可排放。“还原”使用Na2S2O4溶液,所得还原产物为Cr3+,反应的离子方程式为___________ ;为了使c(Cr3+)不高于1.0×10-5mol·L-1,“沉降”时应调节pH至少___________ [该温度下Cr(OH)3的Ksp约为1.0×10-29.6]。
(3)“浸出”时反应的离子方程式为___________ ;“转化”中析出NH4VO3晶体时,需加入过量NH4HCO3,原因是___________ ;选用NH4HCO3溶液不选用NH4C1溶液的原因是___________
(4)该流程中可循环利用的物质有___________ 。

已知:I.“钒渣”的主要成分为Ca3(VO4)2;NH4VO3在pH=7~8时溶解度最小。
Ⅱ.随pH的变化,含铬微粒的变化存在2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。回答下列问题:
(1)“钒铬分离”时,为了提高石灰乳的利用率,可采取的措施是
(2)获取Na2CrO4晶体后,含铬废水需经过“酸化→还原→沉降”方可排放。“还原”使用Na2S2O4溶液,所得还原产物为Cr3+,反应的离子方程式为
(3)“浸出”时反应的离子方程式为
(4)该流程中可循环利用的物质有
您最近一年使用:0次
2022-06-24更新
|
698次组卷
|
2卷引用:山东省实验中学2022届高三打靶化学试题



