解题方法
1 . 下列有关电极方程式或离子方程式错误的是
A.铅蓄电池放电时,正极反应: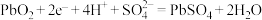 |
B.向碘化亚铁溶液中滴加少量稀硝酸: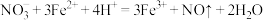 |
C.向0.1mol·L NaHA溶液( NaHA溶液( )加入NaOH溶液: )加入NaOH溶液: |
D.铜片上电镀银的总反应(银作阳极,硝酸银溶液作电镀液):Ag(阳极) (阴极) (阴极) |
您最近一年使用:0次
2024-01-13更新
|
824次组卷
|
5卷引用:陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷
陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷 陕西省渭南市2023-2024学年高三教学质量检测(Ⅰ)化学试题(已下线)化学(九省联考考后提升卷,吉林、黑龙江卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点03 离子方程式的正误判断、离子共存(已下线)专题01 基本概念-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
2 . 下列离子方程式书写正确的是
| A.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+ |
| B.向H2O2溶液中滴加少量FeCl3:2Fe3++H2O2=O2↑+2H++2Fe2+ |
C.室温下用稀HNO3溶解铜:Cu+2NO +2H+=Cu2++2NO2↑+H2O +2H+=Cu2++2NO2↑+H2O |
| D.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=ClO-+Cl-+H2O |
您最近一年使用:0次
2023-08-29更新
|
172次组卷
|
2卷引用:陕西省渭南市2023-2024学年高三上学期期中检测化学试题
名校
解题方法
3 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
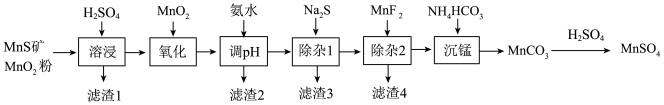
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)为了加快溶浸效果,可采取的措施有_______ (任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______ 。
(3)滤渣2除了含有Al(OH)3还含有_______ 。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(5)写出“沉锰”的离子方程式_______ 。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式
(3)滤渣2除了含有Al(OH)3还含有
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)写出“沉锰”的离子方程式
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2023-08-27更新
|
211次组卷
|
3卷引用:陕西省渭南市2023-2024学年高三上学期期中检测化学试题
名校
解题方法
4 . 某兴趣小组查阅资料发现:Cl2与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐(杀菌消毒能力较差)。他们利用如图装置以Cl2制备NaClO3和NaClO。已知:

 。回答下列问题:
。回答下列问题:

(1)a中盛放浓盐酸的仪器名称为___________ ;a装置中发生反应的离子方程式为___________ 。
(2)b装置的作用是___________ 。若没有b装置,会导致c中产生大量的副产物___________ (填化学式)。
(3)资料显示:工业上制备“84”消毒液时,采用的是从吸收塔下部通入Cl2,从上部喷淋循环冷却的NaOH溶液(15~20%)。其制备反应的化学方程式为___________ ,NaOH需要循环冷却的目的是___________ 。
(4)该兴趣小组在60℃条件下,将一定量的Cl2通入500 mL 1.00 mol·L-1NaOH溶液中,NaOH恰好反应,得到产物中含有NaCl、NaClO和NaClO3,则参加反应Cl2的物质的量为___________ mol 。


 。回答下列问题:
。回答下列问题:
(1)a中盛放浓盐酸的仪器名称为
(2)b装置的作用是
(3)资料显示:工业上制备“84”消毒液时,采用的是从吸收塔下部通入Cl2,从上部喷淋循环冷却的NaOH溶液(15~20%)。其制备反应的化学方程式为
(4)该兴趣小组在60℃条件下,将一定量的Cl2通入500 mL 1.00 mol·L-1NaOH溶液中,NaOH恰好反应,得到产物中含有NaCl、NaClO和NaClO3,则参加反应Cl2的物质的量为
您最近一年使用:0次
2023-05-04更新
|
348次组卷
|
2卷引用:陕西省渭南市澄城县2022-2023学年高一下学期期末检测化学试题
解题方法
5 . N、O、Na、S、Cl的单质及其化合物在工农业生产中用途广泛,回答下列问题:
(1) 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为_______ ,由该反应原理可知 的一种用途为
的一种用途为_______ 。
(2)大苏打( )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为_______ 。
(3)氮化钠(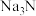 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。
①当温度超过150℃时,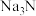 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为_______ 。
②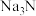 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为_______ (填序号)。
A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为_______ 。
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是_______ 。
(1)
 是一种淡黄色固体,其与
是一种淡黄色固体,其与 反应的化学方程式为
反应的化学方程式为 的一种用途为
的一种用途为(2)大苏打(
 )具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量
)具有较强的还原性,可用于除去棉织物中残留的氯气。将棉织物浸入水中,加入少量 充分反应。取少量反应后的浸取液,滴入
充分反应。取少量反应后的浸取液,滴入 溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。
溶液,产生白色沉淀,再加入过量稀盐酸,白色沉淀不溶解。 和
和 的反应中,二者的物质的量之比为
的反应中,二者的物质的量之比为(3)氮化钠(
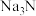 )是一种红色固体,常用作炸药及化学分析试剂。
)是一种红色固体,常用作炸药及化学分析试剂。①当温度超过150℃时,
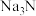 即分解为金属钠和氮气,对应的化学方程式为
即分解为金属钠和氮气,对应的化学方程式为②
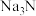 与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为
与水反应生成NaOH和一种碱性气体,检验该气体成分的试纸可以为A.湿润的淀粉-KI试纸 B.湿润的红色石蕊试纸 C.湿润的酚酞试纸
(4)氯及其化合物是重要的化工原料,在疫情防控、污水处理等方面发挥重要的作用。
①NaClO溶液能有效地灭杀新冠病毒,常用于环境的消毒,工业上制备NaClO溶液的化学方程式为
②氨氮废水的处理是当前科学研究的热点问题之一,工业上常用
 将酸性氨氮废水中
将酸性氨氮废水中 转化为无毒无害的气体和水,发生反应的离子方程式是
转化为无毒无害的气体和水,发生反应的离子方程式是
您最近一年使用:0次
解题方法
6 . 酸性 溶液能与草酸(
溶液能与草酸( )溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响化学反应速率的因素。
)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响化学反应速率的因素。
Ⅰ、实验前首先用浓度为0.1000mol·L 酸性
酸性 标准溶液滴定未知浓度的草酸溶液。
标准溶液滴定未知浓度的草酸溶液。
(1)在酸性条件下能够发生上述反应,请写出该反应的离子方程式:___________ 。
(2)取25.00mL待测草酸溶液于锥形瓶中加入适量稀硫酸,用0.1000mol·L 酸性
酸性 溶液滴定,消耗
溶液滴定,消耗 溶液20.00mL。
溶液20.00mL。
①滴定过程中操作滴定管的图示正确的是___________ (填字母)。

②滴定到达终点的判断标志是___________ 。
③下列操作可能造成测得草酸溶液浓度偏高的是___________ (填字母)。
A.滴定终点时俯视读数 B.滴定前有气泡,滴定后气泡消失
C.没有润洗锥形瓶 D.滴定过程中加入少量蒸馏水冲洗瓶壁
④该草酸溶液的物质的量浓度为___________ mol·L (精确到0.0001)。
(精确到0.0001)。
Ⅱ、用2mL0.1000mol·L
 溶液与4mL上述草酸溶液,研究不同条件对化学反应速率的影响。
溶液与4mL上述草酸溶液,研究不同条件对化学反应速率的影响。
(3)如果研究催化剂对化学反应速率的影响,使用实验②和___________ (用①~④表示,下同);如果研究温度对化学反应速率的影响,使用实验③和___________ 。
(4)某同学对实验①进行了三次实验,测得溶液褪色时间如表:
则实验①中
___________ mol·L ·min
·min (忽略反应前后溶液体积的变化)。
(忽略反应前后溶液体积的变化)。
 溶液能与草酸(
溶液能与草酸( )溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响化学反应速率的因素。
)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响化学反应速率的因素。Ⅰ、实验前首先用浓度为0.1000mol·L
 酸性
酸性 标准溶液滴定未知浓度的草酸溶液。
标准溶液滴定未知浓度的草酸溶液。(1)在酸性条件下能够发生上述反应,请写出该反应的离子方程式:
(2)取25.00mL待测草酸溶液于锥形瓶中加入适量稀硫酸,用0.1000mol·L
 酸性
酸性 溶液滴定,消耗
溶液滴定,消耗 溶液20.00mL。
溶液20.00mL。①滴定过程中操作滴定管的图示正确的是

②滴定到达终点的判断标志是
③下列操作可能造成测得草酸溶液浓度偏高的是
A.滴定终点时俯视读数 B.滴定前有气泡,滴定后气泡消失
C.没有润洗锥形瓶 D.滴定过程中加入少量蒸馏水冲洗瓶壁
④该草酸溶液的物质的量浓度为
 (精确到0.0001)。
(精确到0.0001)。Ⅱ、用2mL0.1000mol·L

 溶液与4mL上述草酸溶液,研究不同条件对化学反应速率的影响。
溶液与4mL上述草酸溶液,研究不同条件对化学反应速率的影响。| 组别 | 10%硫酸体积/mL | 温度/℃ | 加入其他物质 |
| ① | 2 | 20 | |
| ② | 2 | 20 | 10滴饱和溶液 |
| ③ | 2 | 30 | |
| ④ | 1 | 20 |
(4)某同学对实验①进行了三次实验,测得溶液褪色时间如表:
| 溶液褪色所需时间t/min | ||
| 第一次 | 第二次 | 第三次 |
| 4.9 | 5.1 | 6.8 |

 ·min
·min (忽略反应前后溶液体积的变化)。
(忽略反应前后溶液体积的变化)。
您最近一年使用:0次
名校
解题方法
7 . 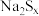 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中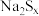 ,与
,与 的物质的量之比为
的物质的量之比为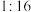 ,则x的值为
,则x的值为
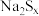 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中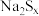 ,与
,与 的物质的量之比为
的物质的量之比为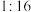 ,则x的值为
,则x的值为| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-02-08更新
|
632次组卷
|
36卷引用:陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题
陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)(已下线)2012届黑龙江省大庆实验中学高三上学期期中考试化学试卷(已下线)2011-2012学年湖南衡阳一、八中高一下学期期中联考化学试卷(已下线)2013届河北省邯郸一中高三9月月考化学化学试卷(已下线)2014届浙江省湖州市八校高三上学期第二次联考化学试卷福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题黑龙江省齐齐哈尔市实验中学2017-2018学年高一上学期期中考试化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期段考化学试题辽宁省辽河油田第二高级中学2020届高三12月考试化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题(已下线)【南昌新东方】2019 南昌五中 高一上期中辽宁省丹东市2020届高三总复习阶段测试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题山东省济南市历城第一中学2021届高三上学期10月月考化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练山西省运城市稷山中学2022届高三上学期月考(一)化学试题河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市树德中学2021-2022学年高一上学期11月阶段性测试(期中)化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题重庆市璧山中学校2021-2022学年高一上学期期中考试化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题陕西省宝鸡市千阳县千阳中学2020-2021学年高一上学期期中考试化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)专题05 氧化还原反应方程式的配平与计算(一题多问)
解题方法
8 . 氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
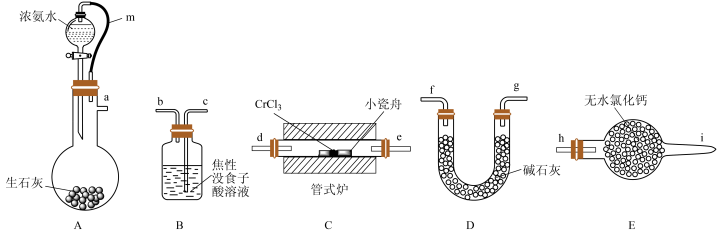
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:
(1)装置A中橡皮管m的作用是____ ,盛生石灰的仪器名称是____ 。
(2)装置A中CaO可用NaOH固体代替,其原因是____ 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为____ 。
(4)制备氮化铬时,装置的接口连接顺序依次为a____ (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为_____ 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为____ 。

已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:
(1)装置A中橡皮管m的作用是
(2)装置A中CaO可用NaOH固体代替,其原因是
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为
(4)制备氮化铬时,装置的接口连接顺序依次为a
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为
您最近一年使用:0次
2022-10-29更新
|
360次组卷
|
2卷引用:陕西省渭南市大荔县2023届高三一模化学试题
名校
9 . 利用钒钛磁铁矿冶炼后产生的钒渣(主要含 、
、 、
、 及少量可溶性磷酸盐)生产
及少量可溶性磷酸盐)生产 的工艺流程如下,回答下列问题:
的工艺流程如下,回答下列问题:

已知: 、
、 、
、 可与
可与 、NaCl组成的混合钠盐在高温下反应,并转化为
、NaCl组成的混合钠盐在高温下反应,并转化为 、
、 、
、 等可溶性钠盐。
等可溶性钠盐。
(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得 ,写出氧化过程中
,写出氧化过程中 发生反应的化学方程式
发生反应的化学方程式_______ ;废渣Ⅰ的主要成分是_______ 。
(2)精制Ⅰ加入 后,写出相关的离子反应方程式:
后,写出相关的离子反应方程式:_______ 、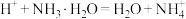 ,溶液中
,溶液中
_______ 。[已知 ]
]
(3)精制Ⅱ中加入 溶液除去磷酸盐,pH过小时影响除磷效果的原因是
溶液除去磷酸盐,pH过小时影响除磷效果的原因是_______ 。
(4)沉钒所得 沉淀需进行洗涤,洗涤时除去的阴离子主要是
沉淀需进行洗涤,洗涤时除去的阴离子主要是_______ 。 在500℃时焙烧脱氨制得产品,反应方程式为
在500℃时焙烧脱氨制得产品,反应方程式为 。但脱氨过程中,部分
。但脱氨过程中,部分 会被
会被 转化成
转化成 ,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为_______ 。
 、
、 、
、 及少量可溶性磷酸盐)生产
及少量可溶性磷酸盐)生产 的工艺流程如下,回答下列问题:
的工艺流程如下,回答下列问题:
已知:
 、
、 、
、 可与
可与 、NaCl组成的混合钠盐在高温下反应,并转化为
、NaCl组成的混合钠盐在高温下反应,并转化为 、
、 、
、 等可溶性钠盐。
等可溶性钠盐。(1)焙烧Ⅰ包括氧化和钠化成盐两个过程,氧化的目的是获得
 ,写出氧化过程中
,写出氧化过程中 发生反应的化学方程式
发生反应的化学方程式(2)精制Ⅰ加入
 后,写出相关的离子反应方程式:
后,写出相关的离子反应方程式: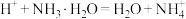 ,溶液中
,溶液中
 ]
](3)精制Ⅱ中加入
 溶液除去磷酸盐,pH过小时影响除磷效果的原因是
溶液除去磷酸盐,pH过小时影响除磷效果的原因是(4)沉钒所得
 沉淀需进行洗涤,洗涤时除去的阴离子主要是
沉淀需进行洗涤,洗涤时除去的阴离子主要是 在500℃时焙烧脱氨制得产品,反应方程式为
在500℃时焙烧脱氨制得产品,反应方程式为 。但脱氨过程中,部分
。但脱氨过程中,部分 会被
会被 转化成
转化成 ,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
,反应中氧化剂与还原剂物质的量之比为3∶2,该反应的化学方程式为
您最近一年使用:0次
10 . 以焙烧黄铁矿 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下:
(1)红渣的主要成分为_______ (填化学式),滤渣①的主要成分为_______ (填化学式)。
(2)黄铁矿研细的目的是_______ 。
(3)还原工序中,不生成S单质的反应的化学方程式为_______ 。
(4)工序①的名称为_______ ,所得母液循环使用。
(5)沉铁工序产生的白色沉淀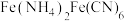 中
中 的化合价为
的化合价为_______ ,氧化工序发生反应的离子方程式为_______ 。
(6)若用还原工序得到的滤液制备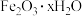 和
和 ,所加试剂为
,所加试剂为_______ 和_______ (填化学式,不引入杂质)。
 (杂质为石英等)产生的红渣为原料制备铵铁蓝
(杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料。工艺流程如下:
颜料。工艺流程如下: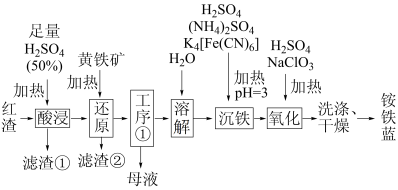
(1)红渣的主要成分为
(2)黄铁矿研细的目的是
(3)还原工序中,不生成S单质的反应的化学方程式为
(4)工序①的名称为
(5)沉铁工序产生的白色沉淀
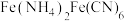 中
中 的化合价为
的化合价为(6)若用还原工序得到的滤液制备
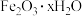 和
和 ,所加试剂为
,所加试剂为
您最近一年使用:0次
2022-07-01更新
|
10284次组卷
|
20卷引用:陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题
陕西省渭南市2023届高三第一次教学质量检测(一模)化学试题(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编(已下线)2022年新高考河北省高考真题化学试题(部分试题)(已下线)第09讲 铁及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题17 化工流程综合题-备战2023年高考化学母题题源解密(广东卷)2022年河北省高考真题化学试题(已下线)易错点32 物质的分离、提纯与检验-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题十 工艺流程中的新工艺河北省衡水阳光中学2022-2023学年高二上学期第一次阶段考试化学试题(已下线)2022年河北省高考真题变式题(14-18)第一部分 命题热点剖析——知晓高考新方向 剖析工艺流程题命题热点 构建高效解题思维模型(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第6讲 铁及其重要化合物(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题(已下线)工业流程题吉林省通化市辉南县第六中学2023-2024学年高一下学期3月半月考化学试卷



