名校
1 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.
(1)提高“酸溶”速率的措施有______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______ 。
(3)“水解”操作中, 转化为
转化为 的离子方程式是
的离子方程式是______ 。分析化学上,测定 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,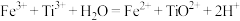 。反应②的滴定实验可选用
。反应②的滴定实验可选用______ (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,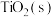 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:
(4) 与C、
与C、 反应的化学方程式为
反应的化学方程式为______ 。
(5)平衡常数表达式
______ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______ 。
A.混合气体的压强保持不变B.
C.混合气体的密度保持不变D. 和CO物质的量相等
和CO物质的量相等
(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则 的平均反应速率为
的平均反应速率为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
Ⅰ.
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水解”操作中,
 转化为
转化为 的离子方程式是
的离子方程式是 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,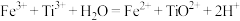 。反应②的滴定实验可选用
。反应②的滴定实验可选用Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为
 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,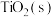 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:| 物质 |  | CO |  |  |
| 分压(MPa) | 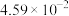 | 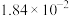 |  |  |
(4)
 与C、
与C、 反应的化学方程式为
反应的化学方程式为(5)平衡常数表达式

A.混合气体的压强保持不变B.

C.混合气体的密度保持不变D.
 和CO物质的量相等
和CO物质的量相等(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
2023-11-28更新
|
113次组卷
|
2卷引用:河南省洛阳市2023-2024学年高二上期期中考试化学试题
名校
解题方法
2 . 作为重要的战略金属,镍(Ni)、钼(Mo)在钢铁、化工等领域得到了广泛的应用。一种以镍钼矿为原料,制备碳酸镍和四钼酸铵的工艺流程如图甲所示:

已知:①NaClO受热易分解;②“酸浸”后,镍以 形式存在。
形式存在。
回答下列问题:
(1)NaClO的电子式为_____ , 中钼元素的化合价为
中钼元素的化合价为_____ 。
(2)“浸出”步骤,原料中MoS2被氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为_____ ;该步骤需在冷水浴中进行,原因是_____ 。
(3)选用阴离子交换树脂(可用ROH表示,“解吸”时可选择一种碱使阴离子交换树脂再生,循环利用)进行吸附,过程中可采用单柱吸附或串柱吸附,吸附曲线如图乙所示,选择_____ 效果更好(填“单柱吸附”或“串柱吸附”);“解吸”过程加入的试剂A为_____ (填溶质化学式)。

(4)“沉镍”步骤中反应的离子方程式为_____ 。

已知:①NaClO受热易分解;②“酸浸”后,镍以
 形式存在。
形式存在。回答下列问题:
(1)NaClO的电子式为
 中钼元素的化合价为
中钼元素的化合价为(2)“浸出”步骤,原料中MoS2被氧化为
 和
和 ,该反应的离子方程式为
,该反应的离子方程式为(3)选用阴离子交换树脂(可用ROH表示,“解吸”时可选择一种碱使阴离子交换树脂再生,循环利用)进行吸附,过程中可采用单柱吸附或串柱吸附,吸附曲线如图乙所示,选择

(4)“沉镍”步骤中反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 实验室利用钴渣[含Co(OH)3、Fe(OH)3等]制备磁性材料Co3O4。
(1)浸取。将一定量的钴渣粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(装置见图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是___________ ;Co(OH)3转化为Co2+的离子方程式为___________ 。
已知: ,
, ,H2C2O4的电离常数分别为
,H2C2O4的电离常数分别为 、
、 ,NH3·H2O的电离常数为Kb=1.8×10-5。
,NH3·H2O的电离常数为Kb=1.8×10-5。
①向除杂后含0.100mol·L-1CoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀,继续滴加NaOH溶液至pH=___________ 时,Co2+沉淀完全[c(Co2+)≤10-5mol·L-1]。
②向除杂后CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4.反应 的平衡常数K的数值为
的平衡常数K的数值为___________ ;不能用同浓度的Na2C2O4溶液代替(NH4)2C2O4溶液的原因是___________ 。
(3)制备Co3O4。以CoCl2为原料先制得CoCO3;然后再制备Co3O4。
已知:①尿素水溶液呈弱碱性,70℃以上能缓慢水解产生 ,pH为1~3时水解速率对生成CoCO3沉淀较为适宜。
,pH为1~3时水解速率对生成CoCO3沉淀较为适宜。
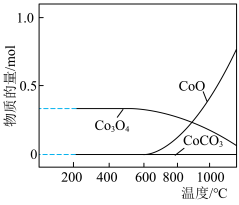
②取1molCoCO3在空气中加热,反应温度对反应产物的影响如图所示,请补充完整以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,___________ ;充分反应,___________ ;反应至固体质量不再变化,即可制得Co3O4。
(1)浸取。将一定量的钴渣粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入到三颈瓶中(装置见图),70℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤,滴液漏斗中的溶液是

已知:
 ,
, ,H2C2O4的电离常数分别为
,H2C2O4的电离常数分别为 、
、 ,NH3·H2O的电离常数为Kb=1.8×10-5。
,NH3·H2O的电离常数为Kb=1.8×10-5。①向除杂后含0.100mol·L-1CoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀,继续滴加NaOH溶液至pH=
②向除杂后CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4.反应
 的平衡常数K的数值为
的平衡常数K的数值为(3)制备Co3O4。以CoCl2为原料先制得CoCO3;然后再制备Co3O4。
已知:①尿素水溶液呈弱碱性,70℃以上能缓慢水解产生
 ,pH为1~3时水解速率对生成CoCO3沉淀较为适宜。
,pH为1~3时水解速率对生成CoCO3沉淀较为适宜。②取1molCoCO3在空气中加热,反应温度对反应产物的影响如图所示,请补充完整以CoCl2溶液、尿素、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
您最近一年使用:0次
2023-09-09更新
|
334次组卷
|
3卷引用:河南省焦作市博爱县第一中2023-2024学年高二下学期4月期中考试化学试题
名校
4 . 草酸钴可用于指示剂和催化剂。其中草酸钴的制备可用水钴矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
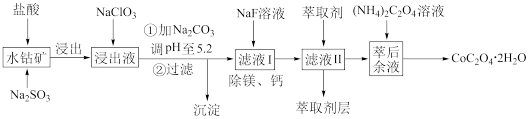
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
,
 转化为
转化为 ;
;
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
回答下列问题:
(1)浸出过程中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)向浸出液中加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“加 调pH至5.2”,过滤所得到的沉淀的成分为
调pH至5.2”,过滤所得到的沉淀的成分为_______ 。
(4)“除钙、镁”是将溶液中( 与
与 转化为
转化为 、
、 沉淀。已知某温度下,
沉淀。已知某温度下, ,
,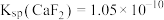 。当加入过量NaF后,所得滤液
。当加入过量NaF后,所得滤液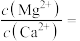
_______ 。
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是_______ (填字母代号)。
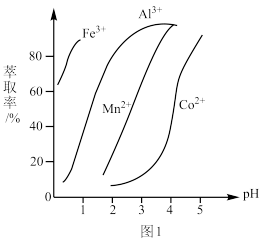
A.2.0~2.5 B.3.0~3.5 C. 4.0~4.5
(6)①实验室里灼烧 晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有
晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有_______ (填仪器名称)
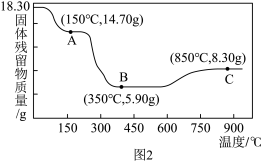
②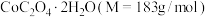 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是_______ 。
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 工艺流程如图所示:
工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
,
 转化为
转化为 ;
;③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
(1)浸出过程中
 发生反应的离子方程式为
发生反应的离子方程式为(2)向浸出液中加入
 发生反应的离子方程式为
发生反应的离子方程式为(3)“加
 调pH至5.2”,过滤所得到的沉淀的成分为
调pH至5.2”,过滤所得到的沉淀的成分为(4)“除钙、镁”是将溶液中(
 与
与 转化为
转化为 、
、 沉淀。已知某温度下,
沉淀。已知某温度下, ,
,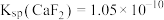 。当加入过量NaF后,所得滤液
。当加入过量NaF后,所得滤液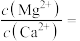
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是

A.2.0~2.5 B.3.0~3.5 C. 4.0~4.5
(6)①实验室里灼烧
 晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有
晶体,所需要的硅酸盐质仪器除了酒精灯和玻璃棒外,还有②
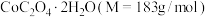 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
您最近一年使用:0次
5 . 工业上由含铜废料(含有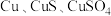 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示:

(1)写出由 “焙烧”生成
“焙烧”生成 和
和 的化学方程式:
的化学方程式:_______ 。
(2)“淘洗”所用的溶液A可以是_______(填字母)。
(3)①“反应”步骤中,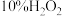 为氧化剂,
为氧化剂,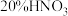 提供
提供 ,可以避免污染性气体的产生,则理论上消耗的
,可以避免污染性气体的产生,则理论上消耗的 和
和 的物质的量之比为
的物质的量之比为_______ 。
②若不加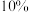 的
的 溶液,只用
溶液,只用 的
的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为_______ 。
(4)根据下图分析从“反应”所得溶液中析出 的方法是
的方法是_______ 。已知室温下 的
的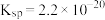 ,则
,则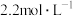 的
的 溶液在室温下结晶时为了避免生成
溶液在室温下结晶时为了避免生成 沉淀,需控制
沉淀,需控制
_______ 。

(5)大量排放 容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:_______ 。

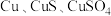 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示:
(1)写出由
 “焙烧”生成
“焙烧”生成 和
和 的化学方程式:
的化学方程式:(2)“淘洗”所用的溶液A可以是_______(填字母)。
| A.稀硫酸 | B.浓硫酸 | C.稀硝酸 | D.浓硝酸 |
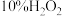 为氧化剂,
为氧化剂,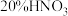 提供
提供 ,可以避免污染性气体的产生,则理论上消耗的
,可以避免污染性气体的产生,则理论上消耗的 和
和 的物质的量之比为
的物质的量之比为②若不加
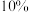 的
的 溶液,只用
溶液,只用 的
的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为(4)根据下图分析从“反应”所得溶液中析出
 的方法是
的方法是 的
的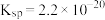 ,则
,则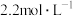 的
的 溶液在室温下结晶时为了避免生成
溶液在室温下结晶时为了避免生成 沉淀,需控制
沉淀,需控制

(5)大量排放
 容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
容易造成酸雨等环境问题,工业上可用双碱法脱硫法处理废气。过程如图所示,写出双碱法脱硫法的总反应方程式:
您最近一年使用:0次
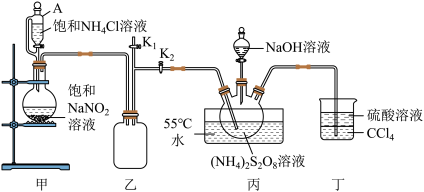
6 . 过硫酸钠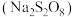 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。
(一)制备
已知:①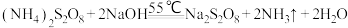 ;
;
② ;
;
③ 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。
回答下列问题:
(1)装置丁的作用是_______ 。
(2)实验时需要将装置甲中反应产生的 持续通入装置丙中,目的是
持续通入装置丙中,目的是_______ 。
(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是_______ 。
(二)探究 的氧化性
的氧化性
(4)用 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:
实验Ⅱ中 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:
a. ;
;
b._______。
请你补充反应
_______ 。设计实验证明实验Ⅱ反应后的溶液中含有
_______ 。
(5)已知:酸性过硫酸钠溶液,在 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为_______ ,该反应的离子方程式为_______ 。
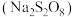 常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备
常用作漂白剂、氧化剂等。装研究小组利用如图所示装置制备 并探究其性质(加热及夹持仪器略去)。
并探究其性质(加热及夹持仪器略去)。(一)制备


已知:①
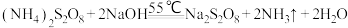 ;
;②
 ;
;③
 是白色晶状粉末,易溶于水,加热至
是白色晶状粉末,易溶于水,加热至 就会发生分解。
就会发生分解。回答下列问题:
(1)装置丁的作用是
(2)实验时需要将装置甲中反应产生的
 持续通入装置丙中,目的是
持续通入装置丙中,目的是(3)反应完毕,将三颈烧瓶中的溶液减压蒸发、结晶过滤、洗涤干燥,可得过硫酸钠,减压蒸发的原因是
(二)探究
 的氧化性
的氧化性(4)用
 溶液与
溶液与 溶液反应,实验操作与现象如下表所示:
溶液反应,实验操作与现象如下表所示:| 实验 | 操作 | 现象 |
| Ⅰ | 在 含淀粉的 含淀粉的 溶液中滴加 溶液中滴加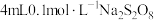 溶液 溶液 | 一段时间后,溶液缓慢变蓝色 |
| Ⅱ | 在 含淀粉的 含淀粉的 溶液中先滴几滴 溶液中先滴几滴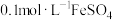 溶液,再滴加 溶液,再滴加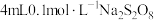 溶液 溶液 | 溶液迅速变蓝色 |
 起催化作用,总反应分两步进行:
起催化作用,总反应分两步进行:a.
 ;
;b._______。
请你补充反应


(5)已知:酸性过硫酸钠溶液,在
 催化作用下可以把
催化作用下可以把 氧化为
氧化为 ,该方法可用于检验
,该方法可用于检验 ,所得溶液除去
,所得溶液除去 后加入
后加入 溶液可以产生白色沉淀。在
溶液可以产生白色沉淀。在 催化作用下,用酸性
催化作用下,用酸性 溶液检验
溶液检验 时的实验现象为
时的实验现象为
您最近一年使用:0次
名校
7 .  常用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂以及各种铜盐等,它在酸中易歧化为铜和铜离子。将一定量的
常用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂以及各种铜盐等,它在酸中易歧化为铜和铜离子。将一定量的 加入
加入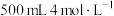 稀硝酸中,得到
稀硝酸中,得到 气体
气体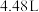 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是
 常用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂以及各种铜盐等,它在酸中易歧化为铜和铜离子。将一定量的
常用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂以及各种铜盐等,它在酸中易歧化为铜和铜离子。将一定量的 加入
加入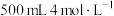 稀硝酸中,得到
稀硝酸中,得到 气体
气体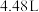 (标准状况下),忽略溶液体积的变化。下列有关说法正确的是
(标准状况下),忽略溶液体积的变化。下列有关说法正确的是A. 溶于稀硝酸的离子方程式为 溶于稀硝酸的离子方程式为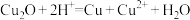 |
B.反应后的溶液中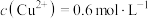 |
| C.反应后的溶液中最多还可以溶解铁粉46.2 g |
D.起氧化作用的硝酸占全部硝酸的 |
您最近一年使用:0次
2023-06-27更新
|
498次组卷
|
6卷引用:河南省新乡市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
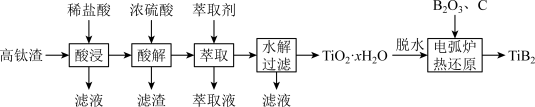
8 . 硼化钛(结构式为B=Ti=B)常用于制备导电陶瓷材料和PTC材料。工业上以高钛渣(主要成分为 、
、 、
、 和CaO,另有少量MgO、
和CaO,另有少量MgO、 )为原料制取
)为原料制取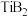 的流程如图:
的流程如图:
已知:①电弧炉是由石墨电极和石墨坩埚组成的高温 加热装置;
② 高温下蒸气压大、易挥发:
高温下蒸气压大、易挥发:
③ 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。
回答下列问题:
(1)滤渣的主要成分为_______ (填化学式)。
(2)“水解”需在沸水中进行,离子方程式为_______ ,该工艺中,经处理可循环利用的物质为_______ (填化学式)。
(3)“热还原”中发生反应的化学方程式为 ,
, 的实际用量超过了理论化学计量所要求的用量,原因是
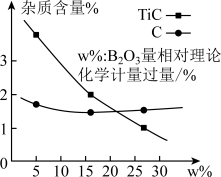
的实际用量超过了理论化学计量所要求的用量,原因是_______ 。仅增大配料中 的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是
的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是_______ (用化学方程式解释)。
(4)硼可与多种金属形成化合物,其中与Ca组成的金属都化物可做新型半导体材料,晶胞结构如图所示:
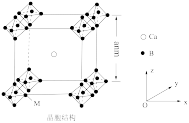
①该晶胞中B原子数为_______ 个,晶体中Ca原子的配位数为_______ 。
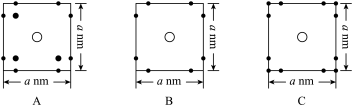
②晶胞在z轴方向的投影图为图中的_______ (填标号)。
③已知 八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为
八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为 ,则M点原子的分数坐标为
,则M点原子的分数坐标为_______ 。
 、
、 、
、 和CaO,另有少量MgO、
和CaO,另有少量MgO、 )为原料制取
)为原料制取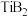 的流程如图:
的流程如图:
已知:①电弧炉是由石墨电极和石墨坩埚组成的
②
 高温下蒸气压大、易挥发:
高温下蒸气压大、易挥发:③
 可溶于热的浓硫酸形成
可溶于热的浓硫酸形成 。
。回答下列问题:
(1)滤渣的主要成分为
(2)“水解”需在沸水中进行,离子方程式为
(3)“热还原”中发生反应的化学方程式为
 ,
, 的实际用量超过了理论化学计量所要求的用量,原因是
的实际用量超过了理论化学计量所要求的用量,原因是 的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是
的用量,产品中的杂质含量变化如图所示。杂质TiC含量随w%增大而降低的原因是
(4)硼可与多种金属形成化合物,其中与Ca组成的金属都化物可做新型半导体材料,晶胞结构如图所示:


①该晶胞中B原子数为
②晶胞在z轴方向的投影图为图中的
③已知
 八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为
八面体中B-B键的键长为rpm,晶胞参数为apm,已知晶胞中钙原子的分数坐标为 ,则M点原子的分数坐标为
,则M点原子的分数坐标为
您最近一年使用:0次
2023-06-05更新
|
385次组卷
|
2卷引用:河南省周口恒大中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
9 . 研究小组探究高铜酸钠(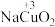 )的制备和性质。
)的制备和性质。
资料:高铜酸钠为棕黑色固体,难溶于水。
实验I.向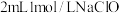 溶液中滴加
溶液中滴加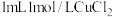 溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
(1)蓝绿色沉淀中含有 ,用离子方程式表示
,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:_________ 。
(2)探究棕黑色沉淀的组成。
实验II.将一份浊液a过滤、洗涤、干燥,得到固体b;取少量固体b,滴加稀 ,沉淀溶解,有气泡产生,得到蓝色溶液。
,沉淀溶解,有气泡产生,得到蓝色溶液。
①另取少量固体b进行实验,证实了 中钠元素的存在,实验操作的名称是
中钠元素的存在,实验操作的名称是_________ 。
②进一步检验,棕黑色固体是 ,
, 与稀
与稀 反应的离子方程式是
反应的离子方程式是_________ 。
(3)探究实验条件对 制备的影响。
制备的影响。
实验III.向另一份浊液a中继续滴加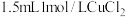 溶液,沉淀由棕黑色变为蓝绿色,溶液的
溶液,沉淀由棕黑色变为蓝绿色,溶液的 约为5,有
约为5,有 产生。
产生。
①对 的来源,甲同学认为是
的来源,甲同学认为是 和
和 反应生成了
反应生成了 ,乙同学认为该说法不严谨,提出了生成
,乙同学认为该说法不严谨,提出了生成 的其他原因:
的其他原因:_________ 。
②探究“继续滴加 溶液,
溶液, 能氧化
能氧化 的原因。
的原因。
ⅰ.提出假设1: 增大,
增大, 的还原性增强,实验证明假设成立,操作和现象是:取少量
的还原性增强,实验证明假设成立,操作和现象是:取少量 固体于试管中,
固体于试管中,_________ 。
ⅱ.提出假设2:_________ ,经证实该假设也成立。
(4)改进实验方案,进行实验。
实验IV,向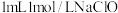 溶液中滴加
溶液中滴加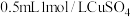 溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉
溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉 试纸变蓝。
试纸变蓝。
 放置过程中产生气体的化学方程式是
放置过程中产生气体的化学方程式是_________ 。
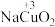 )的制备和性质。
)的制备和性质。资料:高铜酸钠为棕黑色固体,难溶于水。
实验I.向
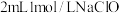 溶液中滴加
溶液中滴加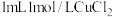 溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。
溶液,迅速产生蓝绿色沉淀,振荡后得到棕黑色的浊液a,将其等分成2份。(1)蓝绿色沉淀中含有
 ,用离子方程式表示
,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:(2)探究棕黑色沉淀的组成。
实验II.将一份浊液a过滤、洗涤、干燥,得到固体b;取少量固体b,滴加稀
 ,沉淀溶解,有气泡产生,得到蓝色溶液。
,沉淀溶解,有气泡产生,得到蓝色溶液。①另取少量固体b进行实验,证实了
 中钠元素的存在,实验操作的名称是
中钠元素的存在,实验操作的名称是②进一步检验,棕黑色固体是
 ,
, 与稀
与稀 反应的离子方程式是
反应的离子方程式是(3)探究实验条件对
 制备的影响。
制备的影响。实验III.向另一份浊液a中继续滴加
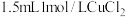 溶液,沉淀由棕黑色变为蓝绿色,溶液的
溶液,沉淀由棕黑色变为蓝绿色,溶液的 约为5,有
约为5,有 产生。
产生。①对
 的来源,甲同学认为是
的来源,甲同学认为是 和
和 反应生成了
反应生成了 ,乙同学认为该说法不严谨,提出了生成
,乙同学认为该说法不严谨,提出了生成 的其他原因:
的其他原因:②探究“继续滴加
 溶液,
溶液, 能氧化
能氧化 的原因。
的原因。ⅰ.提出假设1:
 增大,
增大, 的还原性增强,实验证明假设成立,操作和现象是:取少量
的还原性增强,实验证明假设成立,操作和现象是:取少量 固体于试管中,
固体于试管中,ⅱ.提出假设2:
(4)改进实验方案,进行实验。
实验IV,向
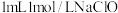 溶液中滴加
溶液中滴加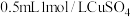 溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉
溶液,迅速生成蓝色沉淀,振荡后得到棕黑色浊液。浊液放置过程中,沉淀表面缓慢产生气泡并出现蓝色固体,该气体不能使湿润的淀粉 试纸变蓝。
试纸变蓝。 放置过程中产生气体的化学方程式是
放置过程中产生气体的化学方程式是
您最近一年使用:0次
名校
解题方法
10 . TRAP是一种温和的氧化剂,TRAP试剂中的RuO4-不会氧化碳碳双键,可以将醇仅氧化至醛(酮),不会过度氧化为羧酸。TRAP氧化醇的反应机理如下图。下列说法不正确的是


| A.在上述6步反应中每一步都发生了氧化还原反应 |
B.步骤④⑤NMO将RuO 氧化,生成TRAP试剂 氧化,生成TRAP试剂 |
C.步骤⑥的离子方程式为2RuO =RuO2+ RuO =RuO2+ RuO |
D.若R1为CH3CH=CH-,R2为 ,则TRAP氧化该醇的主产物为2-丁烯醛 ,则TRAP氧化该醇的主产物为2-丁烯醛 |
您最近一年使用:0次
2023-04-12更新
|
812次组卷
|
6卷引用:河南省信阳高级中学2022-2023学年高二下学期6月月考化学试题
河南省信阳高级中学2022-2023学年高二下学期6月月考化学试题(已下线)素养卷01 物质循环转化机理图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)湖北省荆州市沙市中学2023届高三模拟预测化学试题河北省张家口市宣化第一中学2023届高三模拟试题(三)化学试题江苏省昆山中学2022-2023学年高一下学期5月月考化学试题湖南省长沙市雅礼中学2024届高三上学期月考试卷(一)化学试题



