解题方法
1 . 某化学学习小组进行如下实验:
I.为探究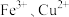 对
对 分解的催化效果,实验方案如下图所示:
分解的催化效果,实验方案如下图所示:___________ (填实验现象),即可得出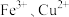 的催化效果的差异。有同学建议将
的催化效果的差异。有同学建议将 改为
改为 溶液,理由是
溶液,理由是___________ 。
II.测定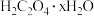 中
中 值
值
已知: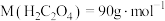 ,①称取
,①称取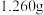 纯草酸晶体,将草酸制成
纯草酸晶体,将草酸制成 水溶液为待测液;②取
水溶液为待测液;②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;③用浓度为
;③用浓度为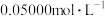 的
的 标准溶液进行滴定。
标准溶液进行滴定。
(2)请写出滴定中发生反应的离子方程式___________ 。
(3)由图可知消耗 溶液体积为
溶液体积为___________  。
。___________ 。
(5)通过上述数据,求得
___________ ,若由于操作不当,滴定结束后滴定管尖嘴处滴定前滴定后有一气泡,引起实验结果___________ (偏大、偏小或没有影响),其它操作均正确,滴定前未用标准 溶液润洗滴定管,引起实验结果
溶液润洗滴定管,引起实验结果___________ (偏大、偏小或没有影响)。
I.为探究
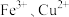 对
对 分解的催化效果,实验方案如下图所示:
分解的催化效果,实验方案如下图所示: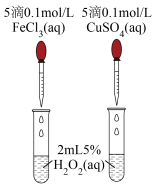
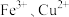 的催化效果的差异。有同学建议将
的催化效果的差异。有同学建议将 改为
改为 溶液,理由是
溶液,理由是II.测定
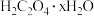 中
中 值
值已知:
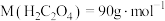 ,①称取
,①称取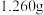 纯草酸晶体,将草酸制成
纯草酸晶体,将草酸制成 水溶液为待测液;②取
水溶液为待测液;②取 待测液放入锥形瓶中,再加入适量的稀
待测液放入锥形瓶中,再加入适量的稀 ;③用浓度为
;③用浓度为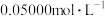 的
的 标准溶液进行滴定。
标准溶液进行滴定。(2)请写出滴定中发生反应的离子方程式
(3)由图可知消耗
 溶液体积为
溶液体积为 。
。
(5)通过上述数据,求得

 溶液润洗滴定管,引起实验结果
溶液润洗滴定管,引起实验结果
您最近一年使用:0次
2 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: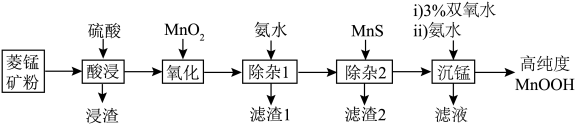
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为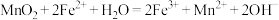 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近一年使用:0次
名校
解题方法
3 . 铈( )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
(1) 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有_______ (填序号)。
a. b.
b.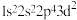 c.
c. d.
d.
(2)“氧化焙烧”后, 元素转化为
元素转化为 和
和 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:_______ 。
(3)实验室进行操作①所需的玻璃仪器有烧杯、_______ 。
(4)“系列操作”包含下图几个过程: 不能溶于有机物
不能溶于有机物 ;
;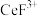 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应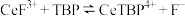 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是_______ ,“有机层B”中发生反应的离子方程式为_______ 。
(5)已知25℃时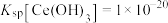 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于_______ 。
(6) 立方晶胞结构如图所示。
立方晶胞结构如图所示。_______ 。
②阿伏加德罗常数的值为 ,
, 摩尔质量为
摩尔质量为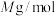 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
_______  。
。
 )的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含
)的氧化物在半导体材料、高级颜料及汽车尾气的净化器方面有广泛应用。以氟碳铈矿(含 、
、 、
、 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: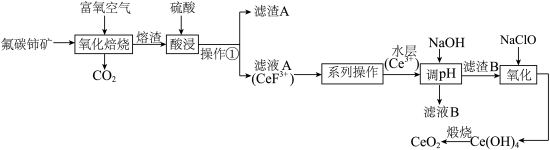
(1)
 中氟元素对应的氟原子激发态的电子排布式有
中氟元素对应的氟原子激发态的电子排布式有a.
 b.
b.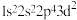 c.
c. d.
d.
(2)“氧化焙烧”后,
 元素转化为
元素转化为 和
和 。写出“氧化焙烧”时
。写出“氧化焙烧”时 发生的化学反应方程式:
发生的化学反应方程式:(3)实验室进行操作①所需的玻璃仪器有烧杯、
(4)“系列操作”包含下图几个过程:

 不能溶于有机物
不能溶于有机物 ;
;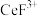 能溶于有机物
能溶于有机物 ,且存在反应
,且存在反应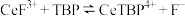 。“滤液
。“滤液 ”中加入有机物
”中加入有机物 后的分离方法是
后的分离方法是(5)已知25℃时
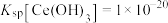 ,“调
,“调 ”时,要使
”时,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制
为沉淀完全),应控制 大于
大于(6)
 立方晶胞结构如图所示。
立方晶胞结构如图所示。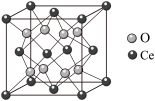
②阿伏加德罗常数的值为
 ,
, 摩尔质量为
摩尔质量为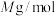 ,晶体密度为
,晶体密度为 ,其晶胞边长的计量表达式为
,其晶胞边长的计量表达式为
 。
。
您最近一年使用:0次
2024-02-25更新
|
436次组卷
|
4卷引用:四川省广安市华蓥中学2023-2024学年高二下学期4月期中考试化学试题
名校
解题方法
4 . 下列离子方程式书写正确的是
A. 溶液中加入浓盐酸: 溶液中加入浓盐酸: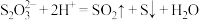 |
B.硫氰化铁溶液中加 溶液产生沉淀: 溶液产生沉淀: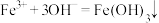 |
C.用白醋浸泡过的淀粉-KI试纸在空气中放置一段时间后,溶液呈蓝色: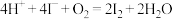 |
D.向 溶液中通入过量 溶液中通入过量 [已知: [已知: 的 的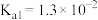 , ,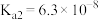 ; ; 的 的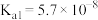 , ,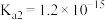 ] ] |
您最近一年使用:0次
2023-12-12更新
|
141次组卷
|
2卷引用:四川省成都市树德中学2023-2024学年高二上学期期中考试化学试题
名校
5 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.
(1)提高“酸溶”速率的措施有______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______ 。
(3)“水解”操作中, 转化为
转化为 的离子方程式是
的离子方程式是______ 。分析化学上,测定 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,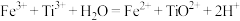 。反应②的滴定实验可选用
。反应②的滴定实验可选用______ (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,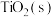 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:
(4) 与C、
与C、 反应的化学方程式为
反应的化学方程式为______ 。
(5)平衡常数表达式
______ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______ 。
A.混合气体的压强保持不变B.
C.混合气体的密度保持不变D. 和CO物质的量相等
和CO物质的量相等
(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则 的平均反应速率为
的平均反应速率为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
Ⅰ.
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水解”操作中,
 转化为
转化为 的离子方程式是
的离子方程式是 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,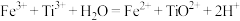 。反应②的滴定实验可选用
。反应②的滴定实验可选用Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为
 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃, 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:| 物质 |  | CO |  |  |
| 分压(MPa) | 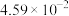 | 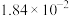 |  |  |
(4)
 与C、
与C、 反应的化学方程式为
反应的化学方程式为(5)平衡常数表达式

A.混合气体的压强保持不变B.

C.混合气体的密度保持不变D.
 和CO物质的量相等
和CO物质的量相等(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
2023-11-28更新
|
113次组卷
|
2卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期12月月考化学试题
名校
解题方法
6 . 工业上常用天然二氧化锰粉与硫化锰矿(含Fe、Al、Mg、Ni、Si等的氧化物杂质)制备MnSO4,其工艺如图所示。回答下列问题:
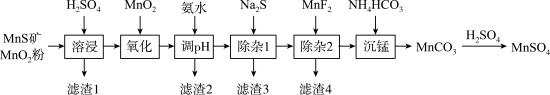
资料1:常温下,MnCO3的溶度积Ksp=2.1 10-11,当c0(Mn+)≤ 1.0
10-11,当c0(Mn+)≤ 1.0 10-5 mol·L-1时该离子已沉淀完全。
10-5 mol·L-1时该离子已沉淀完全。
资料2:相关金属离子 [c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和___________ ;“溶浸”中二氧化锰与硫化锰反应的化学方程式为___________ 。
(2)“氧化”中添加适量的MnO2的作用是___________ 。
(3)“调pH”只除去铁和铝,溶液的pH范围为___________ 。
(4)“除杂1”的目的是除去Ni2+,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+,若溶液酸度过高,Mg2+沉淀不完全。请用平衡移动原理解释其原因___________ 。
(6)MnCO3是一种重要的化工原料。常温下,向溶液中加入NH4HCO3溶液使Mn2+完全沉淀,则混合溶液中 浓度不低于
浓度不低于___________ mol·L-1。

资料1:常温下,MnCO3的溶度积Ksp=2.1
 10-11,当c0(Mn+)≤ 1.0
10-11,当c0(Mn+)≤ 1.0 10-5 mol·L-1时该离子已沉淀完全。
10-5 mol·L-1时该离子已沉淀完全。资料2:相关金属离子 [c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是
(3)“调pH”只除去铁和铝,溶液的pH范围为
(4)“除杂1”的目的是除去Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+,若溶液酸度过高,Mg2+沉淀不完全。请用平衡移动原理解释其原因
(6)MnCO3是一种重要的化工原料。常温下,向溶液中加入NH4HCO3溶液使Mn2+完全沉淀,则混合溶液中
 浓度不低于
浓度不低于
您最近一年使用:0次
2023-11-12更新
|
547次组卷
|
2卷引用:四川省成都市第七中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
7 . 中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图1所示:

(1)硫化砷中砷元素化合价为_______ ,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为_______ 。
(2)氧化脱硫过程中被氧化的元素是_______ 。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______ 。
(4)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。
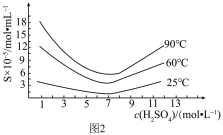
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_______ 。
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是_______ 。
(6)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图3写出As2O5分解为As2O3的热化学方程式_______ 。

②砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1mol/LNa3AsO4溶液、20mL0.1mol/LKI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO (无色)+2I-+2H+
(无色)+2I-+2H+ AsO
AsO (无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图4所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
(无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图4所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______ (填字母代号)。

a.溶液颜色保持不再变化 b.c(AsO )+c(AsO
)+c(AsO )不再变化
)不再变化
c.AsO 的生成速率等于I2的生成速率 d.
的生成速率等于I2的生成速率 d. 保持不再变化
保持不再变化

(1)硫化砷中砷元素化合价为
(2)氧化脱硫过程中被氧化的元素是
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是
(4)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。

为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为
(5)在工业生产中,最后一步所得滤液可循环使用,其目的是
(6)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图3写出As2O5分解为As2O3的热化学方程式

②砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1mol/LNa3AsO4溶液、20mL0.1mol/LKI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO
 (无色)+2I-+2H+
(无色)+2I-+2H+ AsO
AsO (无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图4所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
(无色)+I2(浅黄色)+H2O,测得溶液中c(I2)与时间(t)的关系如图4所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是
a.溶液颜色保持不再变化 b.c(AsO
 )+c(AsO
)+c(AsO )不再变化
)不再变化c.AsO
 的生成速率等于I2的生成速率 d.
的生成速率等于I2的生成速率 d. 保持不再变化
保持不再变化
您最近一年使用:0次
名校
解题方法
8 . 铋酸钠(NaBiO3)在酸性条件下可将Mn2+氧化成MnO ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
 ,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是
,在钢铁工业中可用于锰元素的分析测定。NaBiO3的制备过程为:①将试剂级Bi(NO3)3溶解于稀HNO3溶液中,滤去不溶物;②依次加入水和30%的NaOH溶液至溶液呈中性;③再依次加入30%的NaOH溶液和NaClO溶液,加热至95℃并维持1h;④反应结束后,静置冷却,分去上层清液,用水洗涤沉淀至洗涤液中不含Cl-,在80℃下干燥,即得成品。下列说法正确的是| A.常温下,NaBiO3和Bi(NO3)3均可溶于水 |
B.制备NaBiO3的化学方程式为Bi(NO3)3+4NaOH+NaClO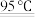 NaBiO3↓+NaCl+3NaNO3+2H2O NaBiO3↓+NaCl+3NaNO3+2H2O |
| C.将Bi(NO3)3溶解于稀HNO3溶液中的目的是增强酸性 |
| D.用NaBiO3分析测定锰元素的过程中,NaBiO3发生氧化反应 |
您最近一年使用:0次
2023-08-15更新
|
471次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
解题方法
9 . 氮元素与人类的生命、生产等活动息息相关。
(1)亚硝酸钠( )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
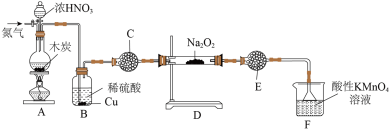
已知:① ;
;
②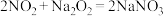
③酸性条件下, 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为___________ 。
②装置B中的实验现象为___________ 。
③装置C的作用为___________ 。
④装置F中发生反应的离子方程式为___________ 。
(2)生物脱氮法流程如下:
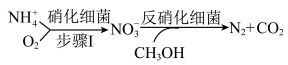
步骤I中若 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为___________  。
。
(3)目前,湿法 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一
已知:两组实验中 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为
①图1是 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
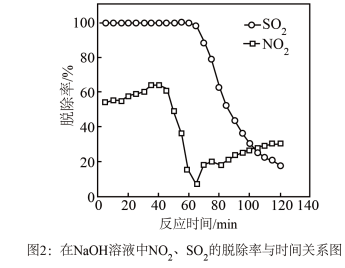
时生成一种对空气无污染的气体,请写出该反应化学方程式___________ 。
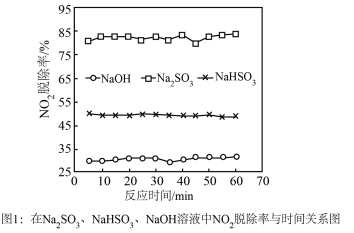
②实验发现,在相同实验条件下利用 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因___________ 。
(1)亚硝酸钠(
 )在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
)在生活中有广泛应用,实验室可用如图装置制备(略去部分夹持仪器)。
已知:①
 ;
;②
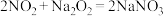
③酸性条件下,
 、
、 和
和 都能与
都能与 反应生成
反应生成 和
和
请回答下列问题:
①装置A中发生反应的化学方程式为
②装置B中的实验现象为
③装置C的作用为
④装置F中发生反应的离子方程式为
(2)生物脱氮法流程如下:

步骤I中若
 的消除速率为
的消除速率为 ,则
,则 的消耗速率为
的消耗速率为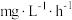 。
。(3)目前,湿法
 和
和 一体化脱除法是解决燃煤烟气领域的途径之一
一体化脱除法是解决燃煤烟气领域的途径之一已知:两组实验中
 溶液浓度均为
溶液浓度均为 ,
, 浓度均为
浓度均为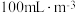
①图1是
 、
、 、
、 对
对 的液相吸收。已知
的液相吸收。已知 溶液在脱除
溶液在脱除 时生成一种对空气无污染的气体,请写出该反应化学方程式
时生成一种对空气无污染的气体,请写出该反应化学方程式
②实验发现,在相同实验条件下利用
 溶液同时吸收
溶液同时吸收 和
和 ,
, 脱除率在60%左右;单独吸收
脱除率在60%左右;单独吸收 时,
时, 脱除率在33%左右。结合①信息及图像解释原因
脱除率在33%左右。结合①信息及图像解释原因
您最近一年使用:0次
2023-07-14更新
|
444次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高二上学期开学考试化学试题
解题方法
10 . 三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图。

已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。
请回答下列问题:
(1)“浸泡”过程中将铜钴矿石研成粉末,原因是___________ 。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是___________ 。
(3)“沉铜”步骤中加入过量铁粉置出铜,再向滤液中通入足量O2,写出通入O2与滤液中的某金属离子反应的离子方程式___________ 。
(4)已知:该温度下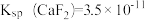 ,
,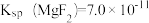 。一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中
。一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中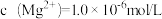 ,则滤液B中c(Ca2+)为
,则滤液B中c(Ca2+)为___________ 。
(5)温度、pH对铜、钴浸出率的影响如图所示:
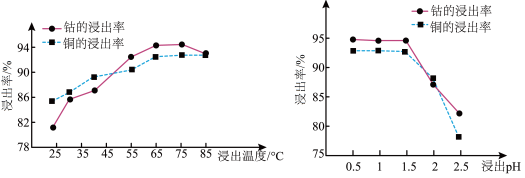
①“浸泡”铜钴矿石选择的适宜条件为___________ 。
A.温度为65~75℃ B.温度为75~85℃ C.pH为0.5-1.5 D.pH为1.5~2
②上图中,pH增大时铜、钴浸出率下降的原因可能是___________ 。
(6)CoC2O4·2H2O在空气中高温焙烧得到Co2O3的化学方程式是___________ 。

已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。
请回答下列问题:
(1)“浸泡”过程中将铜钴矿石研成粉末,原因是
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是
(3)“沉铜”步骤中加入过量铁粉置出铜,再向滤液中通入足量O2,写出通入O2与滤液中的某金属离子反应的离子方程式
(4)已知:该温度下
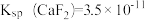 ,
,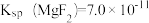 。一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中
。一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中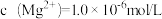 ,则滤液B中c(Ca2+)为
,则滤液B中c(Ca2+)为(5)温度、pH对铜、钴浸出率的影响如图所示:

①“浸泡”铜钴矿石选择的适宜条件为
A.温度为65~75℃ B.温度为75~85℃ C.pH为0.5-1.5 D.pH为1.5~2
②上图中,pH增大时铜、钴浸出率下降的原因可能是
(6)CoC2O4·2H2O在空气中高温焙烧得到Co2O3的化学方程式是
您最近一年使用:0次



