名校
1 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1),已知它易溶于水,难溶于乙醇,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是___________ 。
(2)下列说法不正确的是 ___________。
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称___________ 。
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为___________ 。
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 ___________ 。
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①出“步骤2”中反应的离子方程式___________ 。
②试计算Na2S2O3·5H2O的纯度___________ 。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是 ___________。
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.反应后趁热过滤是除去硫等不溶物 |
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O
 +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 (6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。①出“步骤2”中反应的离子方程式
②试计算Na2S2O3·5H2O的纯度
您最近一年使用:0次
2024-01-18更新
|
267次组卷
|
3卷引用:新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题
新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题黑龙江省牡丹江市第一中学2023-2024学年高三上学期 期末化学试卷(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
解题方法
2 . 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1)NaClO2的化学名称为__________ 。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
①出NaClO2溶液脱硝过程中主要反应的离子方程式__________________________ 。增加压强,NO的转化率________________ (填“提高”“不变”或“降低”)。
②着吸收反应的进行,吸收剂溶液的pH逐渐____________ (填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率______________ 反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是____________ 。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是______________ 。
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=______ 。
(1)NaClO2的化学名称为
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3 mol/L。反应一段时间后溶液中离子浓度的分析结果如下表。
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol/L) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①出NaClO2溶液脱硝过程中主要反应的离子方程式
②着吸收反应的进行,吸收剂溶液的pH逐渐
③由实验结果可知,脱硫反应速率
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
②知下列反应:
SO2(g)+2OH-(aq) =SO32-(aq)+H2O(l) ΔH1
ClO-(aq)+SO32-(aq)=SO42-(aq)+Cl-(aq)ΔH2
CaSO4(s)=Ca2+(aq)+SO42-(aq) ΔH3
则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)=CaSO4(s)+H2O(l)+Cl-(aq)的ΔH=
您最近一年使用:0次
名校
3 . 亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________ 。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________ (写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________ ,H2O2的电子式为________ 。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______ ;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______ g·L−1(杂质不参与反应,NaClO2中的氯元素被还原为Cl−)。

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为
(3)ClO2吸收塔中发生反应的离子方程式为
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L−1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为
您最近一年使用:0次
名校
4 . 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
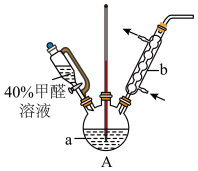
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是_________ ,作用为_________ 。
②能说明甲醛具有还原性的实验现象是______________ 。
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
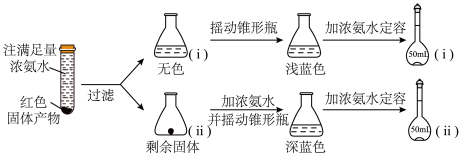
①摇动锥形瓶i的目的是_______ 。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______ 。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________ 。

(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是
②能说明甲醛具有还原性的实验现象是
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O
 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①摇动锥形瓶i的目的是
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为
您最近一年使用:0次
名校
5 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________ (填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________ 。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____ mol。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________ 。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=_______ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c=
您最近一年使用:0次
2018-11-25更新
|
741次组卷
|
2卷引用:新疆维吾尔自治区喀什第六中学2022-2023学年高二上学期第一次月考化学试题
解题方法
6 . 实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是_______________________________________ 。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为_____________ 。生成0.1mol还原产物时转移电子______________ 个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是____________________________ 。
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为____________________ 。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为
您最近一年使用:0次



