1 . 酸浸法回收废炉渣中(主要为铜、钴、镍、铁等金属元素的氧化物)的铜、钴、镍的流程如下: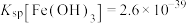 ,
, .
.
(1)“磨细”过程的目的是____________ .
(2)酸浸液中大量铁元素以 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为____________ .
(3)“滤渣2”主要成分为______ (填化学式)。
(4)“镍钴分离”过程 发生反应的离子方程式为
发生反应的离子方程式为____________ .
(5)“酸溶1”过程用 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性____________ 。
(6)“焙烧”过程发生反应的化学方程式为____________ 。
(7)已知当 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为______ 。
(8)“操作X”采用的结晶方法为______ 。
 ,
, .
.(1)“磨细”过程的目的是
(2)酸浸液中大量铁元素以
 存在,加入
存在,加入 可减少铁屑的消耗从而降低成本,
可减少铁屑的消耗从而降低成本, 与
与 反应过程中会产生气泡,其离子方程式为
反应过程中会产生气泡,其离子方程式为(3)“滤渣2”主要成分为
(4)“镍钴分离”过程
 发生反应的离子方程式为
发生反应的离子方程式为(5)“酸溶1”过程用
 替换HCl,从绿色化学角度分析其可行性
替换HCl,从绿色化学角度分析其可行性(6)“焙烧”过程发生反应的化学方程式为
(7)已知当
 mol⋅L
mol⋅L 时,认为其沉淀完全。“沉镍”过程的目的是为了将
时,认为其沉淀完全。“沉镍”过程的目的是为了将 .此时应调节溶液的pH为
.此时应调节溶液的pH为(8)“操作X”采用的结晶方法为
您最近一年使用:0次
解题方法
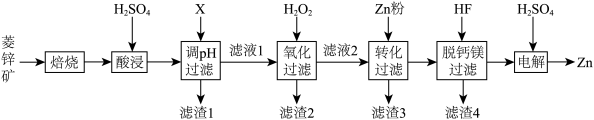
2 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
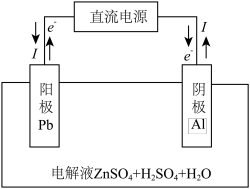
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
名校
解题方法
3 . 二氯化一氯五氮合钴 可用作聚氯乙烯的染色剂和稳定剂。
可用作聚氯乙烯的染色剂和稳定剂。 不溶于水和乙醇;
不溶于水和乙醇;
 是粉红色不溶于水的固体;
是粉红色不溶于水的固体;
 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。
Ⅰ.制备 :装置和简化流程如图。
:装置和简化流程如图。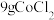 、
、 和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是
和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是________ ;加入浓氨水前先加 的原因有
的原因有________ 。
(2)步骤ii ①请补齐该步骤发生的相关反应的离子方程式:_____
□________+□ +□
+□ □
□ □________
□________
②加入20mL5% 的操作方式为
的操作方式为________ 。
A.过滤出黄色沉淀,向沉淀中加入 B.向黄色悬浊液中加入
C.一次性快速倒入 D.控温缓慢滴加
(3)步骤iii 待溶液中停止产生气泡后,缓慢加入20mL浓盐酸,在85℃水浴中加热20min,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。产品洗涤时必须使用的试剂有① 溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为
溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为________ (用序号填写)。
Ⅱ.产品测定
(4)取0.3g产品加入强碱溶液,加热煮沸,将蒸出的氨气用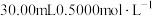 的盐酸完全吸收。滴加2~3滴甲基橙,再用
的盐酸完全吸收。滴加2~3滴甲基橙,再用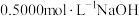 溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为
溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为________ (结果保留三位有效数字)。
Ⅲ.实验探究
(5)实验小组在制备过程中发现 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和
不被氧化,据此认为加入浓氨水和 对
对 的氧化产生了影响,提出以下猜想并设计、进行实验验证。
的氧化产生了影响,提出以下猜想并设计、进行实验验证。
猜想1:加入 溶液,增强了
溶液,增强了 的氧化性。
的氧化性。
猜想2:加入浓氨水形成配合物,增强了 离子的还原性。
离子的还原性。
①a是________ ,b是________ 。
②请从物质结构角度解释猜想2合理可能的原因________ 。
 可用作聚氯乙烯的染色剂和稳定剂。
可用作聚氯乙烯的染色剂和稳定剂。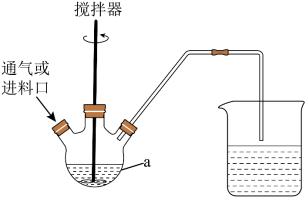
 不溶于水和乙醇;
不溶于水和乙醇; 是粉红色不溶于水的固体;
是粉红色不溶于水的固体; 是棕褐色不溶于水的固体。
是棕褐色不溶于水的固体。Ⅰ.制备
 :装置和简化流程如图。
:装置和简化流程如图。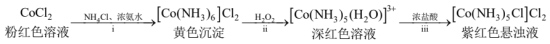
 、
、 和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是
和20mL浓氮水,并不断搅拌,充分反应,仪器a的名称是 的原因有
的原因有(2)步骤ii ①请补齐该步骤发生的相关反应的离子方程式:
□________+□
 +□
+□ □
□ □________
□________②加入20mL5%
 的操作方式为
的操作方式为A.过滤出黄色沉淀,向沉淀中加入 B.向黄色悬浊液中加入
C.一次性快速倒入 D.控温缓慢滴加
(3)步骤iii 待溶液中停止产生气泡后,缓慢加入20mL浓盐酸,在85℃水浴中加热20min,所得混合物冷却至室温,抽滤、洗涤、烘干得到产品。产品洗涤时必须使用的试剂有①
 溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为
溶液、②无水乙醇、③冰水,洗涤过程中这三种试剂的使用先后顺序为Ⅱ.产品测定
(4)取0.3g产品加入强碱溶液,加热煮沸,将蒸出的氨气用
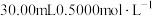 的盐酸完全吸收。滴加2~3滴甲基橙,再用
的盐酸完全吸收。滴加2~3滴甲基橙,再用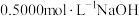 溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为
溶液滴定,达到终点时共消耗NaOH溶液22.00mL。产品中N的质量分数为Ⅲ.实验探究
(5)实验小组在制备过程中发现
 溶液中直接加入
溶液中直接加入 ,
, 不被氧化,据此认为加入浓氨水和
不被氧化,据此认为加入浓氨水和 对
对 的氧化产生了影响,提出以下猜想并设计、进行实验验证。
的氧化产生了影响,提出以下猜想并设计、进行实验验证。猜想1:加入
 溶液,增强了
溶液,增强了 的氧化性。
的氧化性。猜想2:加入浓氨水形成配合物,增强了
 离子的还原性。
离子的还原性。实验编号 | 试剂 | 现象 |
1 | 0.5mL水 | 无明显变化 |
2 | a | 无明显变化 |
3 | b | 溶液变为深红色,且出现棕褐色沉淀 |

①a是
②请从物质结构角度解释猜想2合理可能的原因
您最近一年使用:0次
名校
解题方法
4 . 砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为GaAs,含 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。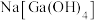 的形式进入溶液。
的形式进入溶液。
②离子完全沉淀时的pH: 为8,
为8, 为5.6。
为5.6。
(1)第一电离能比较:As________ Ga(填“<”“>”或“=”,下同),原子半径比较:As________ Ga。
(2)下图为砷化镓晶胞,白球所代表原子的配位数是________ 。已知:晶胞参数为apm,密度为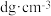 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为________ (用含a、d的式子表示)。________ 。
(4)“调pH①”时,pH=________ 最合适;滤液②的溶质成分为________ (写化学式)。
(5)写出用惰性电极电解制备镓单质的电极反应方程式:________ 。
 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。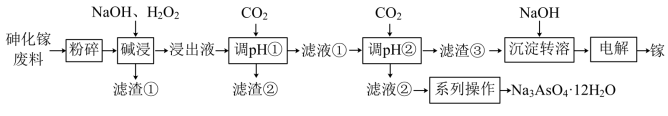
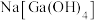 的形式进入溶液。
的形式进入溶液。②离子完全沉淀时的pH:
 为8,
为8, 为5.6。
为5.6。(1)第一电离能比较:As
(2)下图为砷化镓晶胞,白球所代表原子的配位数是
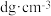 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为
(4)“调pH①”时,pH=
(5)写出用惰性电极电解制备镓单质的电极反应方程式:
您最近一年使用:0次
2024-03-25更新
|
112次组卷
|
2卷引用:福建省漳州市华安县第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
5 . 工业废水中常含有一定量的 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含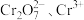 及少量
及少量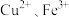 等)制备
等)制备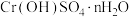 晶体,工艺流程如下:
晶体,工艺流程如下:
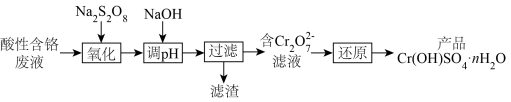
常温下, 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
回答下列问题
(1)“氧化”时,
①将 先氧化为
先氧化为 的目的是
的目的是_______ 。
②加入的 (
( 为+6价)中,
为+6价)中,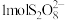 含有过氧键数目为
含有过氧键数目为_______ 。
③完成下列离子方程式:_______ 。

(2)“调 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是_______ ;
(3)“过滤”时,滤渣的主要成分是_______ 。(填化学式)
(4)“还原”时,还原剂将 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。
(5)从 溶液得到
溶液得到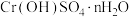 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
 ,会危害生态系统,必须进行处理。常将
,会危害生态系统,必须进行处理。常将 转化为纺织印染中的媒染剂
转化为纺织印染中的媒染剂 ,变废为宝。该法用酸性含铬废液(含
,变废为宝。该法用酸性含铬废液(含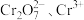 及少量
及少量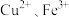 等)制备
等)制备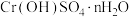 晶体,工艺流程如下:
晶体,工艺流程如下:
常温下,
 金属离子形成氢氧化物沉淀的
金属离子形成氢氧化物沉淀的 范围如表。已知:
范围如表。已知:
| 离子 | 开始沉淀的 | 完全沉淀的 |
 | 1.4 | 3.0 |
 | 4.2 | 6.7 |
 | 4.0 | 6.8 |
(1)“氧化”时,
①将
 先氧化为
先氧化为 的目的是
的目的是②加入的
 (
( 为+6价)中,
为+6价)中,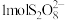 含有过氧键数目为
含有过氧键数目为③完成下列离子方程式:

(2)“调
 ”时,加入
”时,加入 至溶液呈碱性,但
至溶液呈碱性,但 不能大于9的原因是
不能大于9的原因是(3)“过滤”时,滤渣的主要成分是
(4)“还原”时,还原剂将
 还原为
还原为 ,最适合的还原剂是_______。
,最适合的还原剂是_______。A. | B. | C. | D. |
(5)从
 溶液得到
溶液得到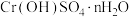 晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
晶体,需进行的操作为:蒸发浓缩、_______、过滤、洗涤、干燥。
您最近一年使用:0次
名校
解题方法
6 . 用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
表中a、b的值分别为:a=___________ 、b=___________
(2)该反应的离子方程式为___________ 。
(3)若t1<t2,则根据实验①和②得到的结论是___________ 。
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=___________ ,其反应速率变化如图,其中x1~x2时间内速率变快的主要原因可能是:产物Mn2+是反应的催化剂、___________ 。

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶的体积/mL | 蒸馏水体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
(3)若t1<t2,则根据实验①和②得到的结论是
(4)某小组同学按实验①进行实验,测得溶液褪色时间t1=2.5min,求该条件下的化学反应速率v(H2C2O4)=

(5)请你设计实验④验证MnSO4对该反应起催化作用,完成下表中内容。
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
您最近一年使用:0次
解题方法
7 . 工业废水中常含有一定量有毒的 和
和 ,需进行处理后再排放。处理含
,需进行处理后再排放。处理含 和
和 的工业废水常用的方法有两种。
的工业废水常用的方法有两种。
方法一:还原沉淀法。
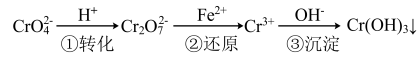
(1)请写出第①步中 与
与 在溶液中存在的平衡:
在溶液中存在的平衡:___________ ,下列能说明该反应达到平衡状态的是___________ (填标号)。
A. 与
与 的物质的量相等
的物质的量相等
B.溶液颜色不变
C.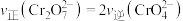
(2)第②步中,每 可还原
可还原___________  ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
方法二:电解法。用石墨和Fe作电极电解含 的酸性废水,随着电解的进行,阴极附近溶液pH升高,阳极附近
的酸性废水,随着电解的进行,阴极附近溶液pH升高,阳极附近 将
将 还原为
还原为 ,最后
,最后 以
以 形式沉淀。
形式沉淀。
(3)在电解除铬的过程中,石墨电极为___________ (填“阴极”或“阳极”),Fe电极的电极反应式为___________ 。
(4)在阴极附近溶液pH升高的原因是___________ (填电极反应式及必要的文字)。
(5)当Fe电极质量减小3.36g时,理论上可处理___________ (填含a的表达式)L含 的酸性废水。
的酸性废水。
 和
和 ,需进行处理后再排放。处理含
,需进行处理后再排放。处理含 和
和 的工业废水常用的方法有两种。
的工业废水常用的方法有两种。方法一:还原沉淀法。

(1)请写出第①步中
 与
与 在溶液中存在的平衡:
在溶液中存在的平衡:A.
 与
与 的物质的量相等
的物质的量相等B.溶液颜色不变
C.
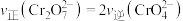
(2)第②步中,每
 可还原
可还原 ,该反应的离子方程式为
,该反应的离子方程式为方法二:电解法。用石墨和Fe作电极电解含
 的酸性废水,随着电解的进行,阴极附近溶液pH升高,阳极附近
的酸性废水,随着电解的进行,阴极附近溶液pH升高,阳极附近 将
将 还原为
还原为 ,最后
,最后 以
以 形式沉淀。
形式沉淀。(3)在电解除铬的过程中,石墨电极为
(4)在阴极附近溶液pH升高的原因是
(5)当Fe电极质量减小3.36g时,理论上可处理
 的酸性废水。
的酸性废水。
您最近一年使用:0次
名校
解题方法
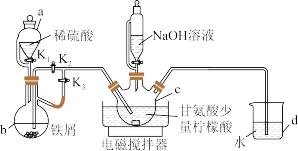
8 . 有一种新型补铁剂由甘氨酸与硫酸亚铁制取。某化学学习小组用如图所示装置(夹持仪器省略)制备补铁剂甘氨酸亚铁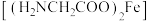 。
。
有关物质性质如下表所示:
实验步骤如下:
Ⅰ.打开 、
、 ,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。
,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。
Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器c的名称是_______ ,d的作用是_______ 。
(2)步骤Ⅰ中将b中溶液加入c中的操作是_______ ;步骤Ⅱ中若调节溶液pH偏高,则所得粗产品中会混有一种杂质,该杂质为_______ 。
(3)c中生成甘氨酸亚铁的化学方程式是_______ 。
(4)下列关于该实验的说法不正确的是_______ 。
A.步骤Ⅰ中当观察到d中导管冒出气泡,则表示装置内空气已排尽
B.步骤Ⅰ、步骤Ⅱ加液时,无须打开分液漏斗上方的活塞
C.反应混合液中加入柠檬酸的作用是防止 水解及被氧化
水解及被氧化
D.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
E.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5) 的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表
的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表
为探究配合物形成的影响因素,某同学按如下步骤完成实验:

为了能观察到溶液I中 的颜色,应加入的试剂为
的颜色,应加入的试剂为_______ ;从实验②和③可知配体的配位能力强弱顺序_______ (填化学式)。
结论:该实验中影响配合物形成的因素有溶液的酸碱性、_______ 。
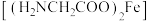 。
。
有关物质性质如下表所示:
甘氨酸( ) ) | 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度 |
| 柠檬酸 | 易溶于水和乙醇,酸性较强,有强还原性。 |
| 甘氨酸亚铁 | 溶于水,难溶于乙醇、冰醋酸。 |
Ⅰ.打开
 、
、 ,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。
,向c中通入气体,待确定c中空气被排尽后,将b中溶液加入c中。Ⅱ.在50℃恒温条件下用磁力搅拌器不断搅拌,然后向c中滴加NaOH溶液,调溶液pH至5.5左右,使反应物充分反应。
Ⅲ.反应完成后,向c中反应混合液中加入无水乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品,将粗产品纯化后得精品。
回答下列问题:
(1)仪器c的名称是
(2)步骤Ⅰ中将b中溶液加入c中的操作是
(3)c中生成甘氨酸亚铁的化学方程式是
(4)下列关于该实验的说法不正确的是
A.步骤Ⅰ中当观察到d中导管冒出气泡,则表示装置内空气已排尽
B.步骤Ⅰ、步骤Ⅱ加液时,无须打开分液漏斗上方的活塞
C.反应混合液中加入柠檬酸的作用是防止
 水解及被氧化
水解及被氧化D.步骤Ⅲ中加入无水乙醇的作用是降低甘氨酸亚铁的溶解度
E.步骤Ⅲ中沉淀洗涤时,用蒸馏水作洗涤剂
(5)
 的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表
的配位化合物较为稳定且运用广泛,常见配离子及其在水溶液中的颜色如下表| 配离子 |  |  |  |  |
| 颜色 | 浅紫色 | 黄色 | 红色 | 无色 |

为了能观察到溶液I中
 的颜色,应加入的试剂为
的颜色,应加入的试剂为结论:该实验中影响配合物形成的因素有溶液的酸碱性、
您最近一年使用:0次
9 . 以菱锌矿(主要含有 ,另含有少量
,另含有少量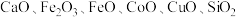 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有_______ (写出一种即可)。
(2)“调 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择_______ (填标号)。
A. B.
B. C.
C.
(3)“氧化过滤”中, 转化为
转化为 的离子方程式为
的离子方程式为_______ 。若反应结束时,溶液 为5,则残留的
为5,则残留的
_______  。
。
(4)“转化过滤”中,除去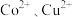 速率先慢后快的原因是
速率先慢后快的原因是_______ 。
(5)“脱钙镁过滤”后,溶液中
_______ 。
(6)“电解”装置示意如图。 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为_______ 。
②电解过程中,电解液中 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是_______ 。
 ,另含有少量
,另含有少量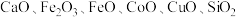 等)为原料电解制
等)为原料电解制 的流程如图:
的流程如图: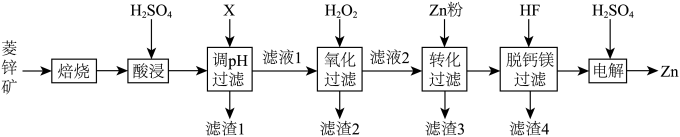
| 物质 |  |  |  |  |
 | 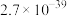 | 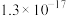 |  |  |
(2)“调
 过滤”中,物质X最适宜选择
过滤”中,物质X最适宜选择A.
 B.
B. C.
C.
(3)“氧化过滤”中,
 转化为
转化为 的离子方程式为
的离子方程式为 为5,则残留的
为5,则残留的
 。
。(4)“转化过滤”中,除去
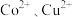 速率先慢后快的原因是
速率先慢后快的原因是(5)“脱钙镁过滤”后,溶液中

(6)“电解”装置示意如图。
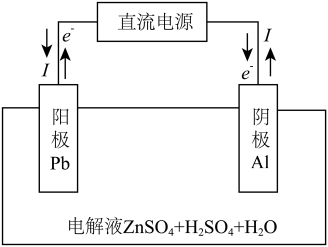
 ,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
,保护阳极不被酸性电解液腐蚀,相应的电极反应式为②电解过程中,电解液中
 含量应维持在
含量应维持在 ,
, 含量不宜过高的原因是
含量不宜过高的原因是
您最近一年使用:0次
名校
10 .  的资源化利用和转化已成为当今科学研究的热点。
的资源化利用和转化已成为当今科学研究的热点。
(1)325℃时,水在 粉表面产生的
粉表面产生的 可将
可将 转化成甲酸,同时生成
转化成甲酸,同时生成 。
。
①由 、
、 、
、 制备甲酸的化学方程式为
制备甲酸的化学方程式为_______ 。
②直接加热 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是_______ 。
(2) 加氢生成
加氢生成 的主要反应的热化学方程式为
的主要反应的热化学方程式为
反应Ⅰ:
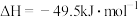
反应Ⅱ: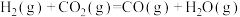

反应Ⅲ:

将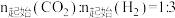 的混合气体置于密闭容器中,达到平衡时,体系中温度和压强对
的混合气体置于密闭容器中,达到平衡时,体系中温度和压强对 的选择性影响如图所示。
的选择性影响如图所示。

①压强的大小:
_______  (填“<”或“>”)
(填“<”或“>”)
② 的选择性随温度升高而下降的原因是
的选择性随温度升高而下降的原因是_______ 。
(3) 和环氧乙烷在
和环氧乙烷在 作催化剂的条件下合成碳酸乙烯酯。
作催化剂的条件下合成碳酸乙烯酯。
① 溶液中加入尿素
溶液中加入尿素 生成
生成 沉淀,同时有
沉淀,同时有 气体产生,该反应的离子方程式为
气体产生,该反应的离子方程式为_______ 。
② 与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到
与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到 。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的
。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的 作催化剂效果更好,其原因是
作催化剂效果更好,其原因是_______ 。
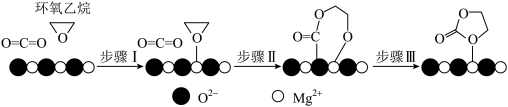
③ 催化
催化 合成碳酸乙烯酯(
合成碳酸乙烯酯(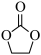 )可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为
)可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为_______ 。
 的资源化利用和转化已成为当今科学研究的热点。
的资源化利用和转化已成为当今科学研究的热点。(1)325℃时,水在
 粉表面产生的
粉表面产生的 可将
可将 转化成甲酸,同时生成
转化成甲酸,同时生成 。
。①由
 、
、 、
、 制备甲酸的化学方程式为
制备甲酸的化学方程式为②直接加热
 与
与 难以生成甲酸,该条件下能较快生成甲酸的原因是
难以生成甲酸,该条件下能较快生成甲酸的原因是(2)
 加氢生成
加氢生成 的主要反应的热化学方程式为
的主要反应的热化学方程式为反应Ⅰ:

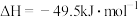
反应Ⅱ:
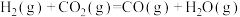

反应Ⅲ:


将
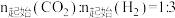 的混合气体置于密闭容器中,达到平衡时,体系中温度和压强对
的混合气体置于密闭容器中,达到平衡时,体系中温度和压强对 的选择性影响如图所示。
的选择性影响如图所示。
①压强的大小:

 (填“<”或“>”)
(填“<”或“>”)②
 的选择性随温度升高而下降的原因是
的选择性随温度升高而下降的原因是(3)
 和环氧乙烷在
和环氧乙烷在 作催化剂的条件下合成碳酸乙烯酯。
作催化剂的条件下合成碳酸乙烯酯。①
 溶液中加入尿素
溶液中加入尿素 生成
生成 沉淀,同时有
沉淀,同时有 气体产生,该反应的离子方程式为
气体产生,该反应的离子方程式为②
 与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到
与沉淀剂(尿素、氢氧化钠)反应生成沉淀,过滤后将沉淀焙烧得到 。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的
。与氢氧化钠作沉淀剂相比,用尿素作沉淀剂焙烧生成的 作催化剂效果更好,其原因是
作催化剂效果更好,其原因是③
 催化
催化 合成碳酸乙烯酯(
合成碳酸乙烯酯( )可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为
)可能的反应机理如图所示,根据元素电负性的变化规律,步骤Ⅰ、Ⅱ的过程可描述为
您最近一年使用:0次
2023-02-10更新
|
462次组卷
|
3卷引用:福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题
福建省泉州市永春第一中学2022-2023学年高二下学期6月期末考试化学试题江苏省苏州市2022-2023学年高三上学期学业质量阳光指标调研化学试题(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(原理综合题)



