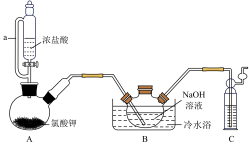
(1)C中所装试剂为
(2)A中反应的化学方程式为
(3)待装置B中出现
(4)反应结束后,装置B中的浊液经过滤、
(5)通过下列实验,可以测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:[(CNO)3Cl2]-+ H++ 2H2O = (CNO)3H3+ 2HClO;HClO + 2I-+ H+= I2+ Cl-+ H2O;
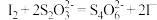 。
。实验步骤:准确称取m g样品,用容量瓶配成250 mL溶液;取12.50 mL上述溶液于锥形瓶中,加入适量稀硫酸和过量KI溶液,充分反应,用c mol/L Na2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为V mL。
①滴定终点现象为
②该样品的有效氯含量表达式为(化为最简式)
(提示:该样品的有效氯=
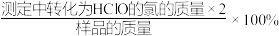 )
)
 )可用于生产铅蓄电池。用方铅矿(主要成分为
)可用于生产铅蓄电池。用方铅矿(主要成分为 ,含少量
,含少量 )为原料生产
)为原料生产 的一种工艺流程如下:
的一种工艺流程如下:
已知:铅能与浓
 溶液在通入空气和加热条件下反应生成
溶液在通入空气和加热条件下反应生成 。回答下列问题:
。回答下列问题:(1)铅元素位于第六周期IVA族,原子序数为82,其原子结构示意图为
(2)方铅矿焙烧时生成一种具有漂白性的气体,其分子式为
 未转化为
未转化为 而是生成单质Ag,原因是
而是生成单质Ag,原因是(3)铅与浓氢氧化钠溶液、空气(已去除
 )在加热时发生反应的化学方程式为
)在加热时发生反应的化学方程式为(4)
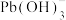 与漂白粉中的有效成分发生反应的离子方程式为
与漂白粉中的有效成分发生反应的离子方程式为(5)
 和
和 可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解
可分别用于铅蓄电池的负极、正极材料。若以石墨、铅为电极电解 溶液制备
溶液制备 和
和 ,则阴极应选用
,则阴极应选用
已知:Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9
(1)滤渣1的主要成分是S和
(2)若用H2O2代替Cl2,试剂Y的使用量会减少,原因是
(3)氟化除杂时要保证完全除去Ca2+和Mg2+(离子浓度<10-5mol/L),滤液3中F—的浓度不小
(4)操作A为
(5)二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂将所得NiCl2•6H2O与SOCl2混合加热可制备无水NiCl2,反应的化学方程式为
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯,磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下: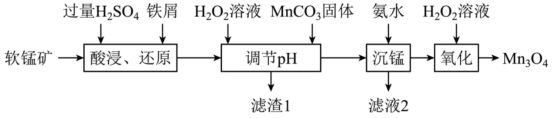
 时,相关金属离子
时,相关金属离子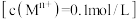 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |
开始沉淀的 | 1.5 | 6.3 | 3.4 | 8.1 |
沉淀完全的 | 2.8 | 8.3 | 4.7 | 10.1 |
 发生反应的离子方程式为
发生反应的离子方程式为(2)“调节
 ”时,加入
”时,加入 溶液的目的是
溶液的目的是 ”的范围为
”的范围为(3)“沉锰”时,其他条件一定,沉锰过程中锰离子的沉淀率与溶液温度的关系如图所示。
 后,溶液温度越高,锰离子的沉淀率越低,原因是
后,溶液温度越高,锰离子的沉淀率越低,原因是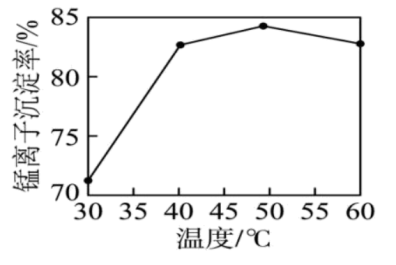
(4)
 时,
时, ,
, 沉淀完全,则
沉淀完全,则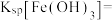
已知:
| 金属阳离子 | 开始沉淀的pH | 完全沉淀的pH |
| Cu2+ | 4.8 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
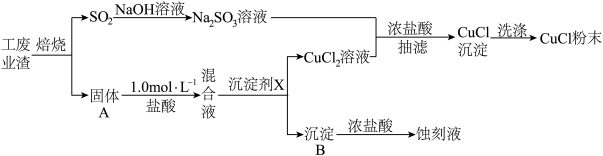
(1)写出焙烧过程中产生SO2的化学方程式:
A.
 B.
B. C.
C.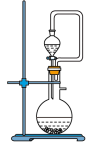 D.
D.
(2)混合液中加入的沉淀剂X可为
(3)①向Na2SO3溶液中逐滴加入CuCl2溶液,再加入少量浓盐酸,混匀后倾倒出清液,抽滤、洗涤、干燥获得CuCl产品,该反应的离子方程式为
②抽滤也称减压过滤,请选择合适的仪器并组装抽滤的装置从溶液中得到CuCl产品,装置连接顺序为_____→_____→E→_____(填标号)。
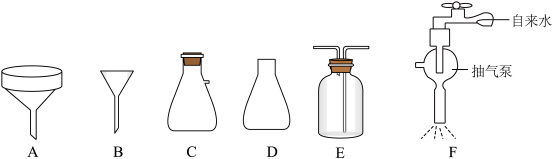
下列有关抽滤的说法错误的是
A.原理为利用抽气泵使抽滤瓶中的压强降低,以达到固液分离的目的
B.过滤速度快,可得到较干燥的沉淀
C.实验结束后,先关抽气泵,后拔开抽滤瓶接管
③抽滤过程中先用“去氧水”作洗涤剂洗涤产品,然后立即用无水酒精洗涤,并在70℃真空下干燥2h,冷却后密封包装,密封包装的原因是
(4)实验测得氯化亚铜蒸气的相对分子质量为199,则氯化亚铜的分子式为
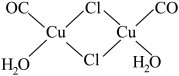 ),则Cu2(CO)2Cl2·2H2O中的配位体为
),则Cu2(CO)2Cl2·2H2O中的配位体为 等杂质)制备氯酸钾流程如下图所示。回答下列问题:
等杂质)制备氯酸钾流程如下图所示。回答下列问题:
(1)“化盐”时需使用温水的目的是
(2)“盐水精制”步骤中需要加入三种除杂试剂,按正确顺序写出除杂试剂的化学式:
(3)“无隔膜电解”步骤主要目的是合成NaClO3。
①阳极生成的气体是
②电解过程中,溶液中的HCO和NaClO在酸性环境中生成NaClO3。写出该反应的离子方程式:
③“盐水调液”步骤中加入Na2Cr2O7后可在阴极表面形成一层铬盐薄膜,有效的防止了
(4)“系列操作”中包括的步骤有
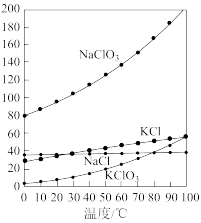
(5)将CH3OH加入到用稀硫酸酸化的KClO3溶液中可生成ClO2和CO2,该反应中氧化和还原剂的物质的量之比为
7 . 铋及其化合物在冶金、医疗、化工生产中均有重要作用。铋在自然界中的含量极少,常以游离金属和矿物的形式存在。对浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2、Cu2S、FeS2等杂质)通过浸出、净化和电沉积法分离回收铋的流程:
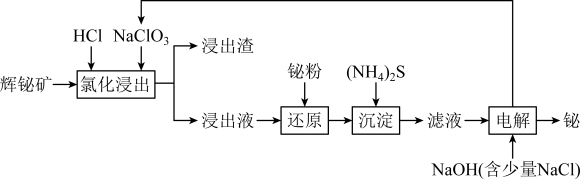
已知:I.“氯化浸出”过程中,需分批多次加入NaClO3,以防生成Cl2;
II.BiCl3极易水解生成不溶性的BiOCl沉淀,但在浓盐酸中几乎不水解;
III.氧化性:Fe3+>Cu2+>Bi3+>H+.
请回答以下问题:
(1)“氯化浸出”时,为了提高浸取速率,可采取的措施有
(2)浸出渣中含有S和
(3)写出“氯化浸出”中Bi2S3所发生反应的离子方程式
(4)“还原”过程中所发生反应的离子方程式为2Bi+3Cu2+=2Bi3++3Cu及
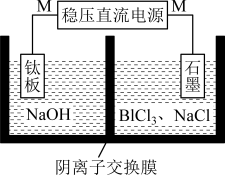
(5)“电解”过程的简易装置如图所示。装置中N为电源的

(1)“酸浸”时保持H2SO4过量的目的是
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式:
②流程中调节pH=5.4所加试剂X为
(3)上述流程中滤渣的成分为
(4)检验Zn2(OH)2CO3是否洗涤干净的方法是
(5)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为


已知:①AgCl可溶于氨水,生成[Ag(NH3)2]+;
②Ksp(Ag2SO4)=1.2×10−5,Ksp(AgCl)=1.8×10−10;
③渣料中含有少量银和硫酸银(微溶)。
(1)操作I中为了加快空气熔炼速率,可以采取
(2)操作IV经过
(3)洗涤滤渣II,与粗银合并,目的是
(4)操作III中,NaClO溶液与Ag反应的产物为AgCl、NaOH、NaCl和O2,该反应的化学方程式为
(5)在空气中加热5.20g硫酸铜晶体(CuSO4·5H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。【已知CuSO4·5H2O相对分子质量250】
| 温度范围/℃ | 固体质量/g |
| 200~260 | 3.33 |
| 650~800 | 1.67 |
| 1000~1500 | 1.50 |
加热到1000℃时,固体物质的化学式为:

已知:①NaFeO2遇水强烈水解,生成红褐色物质;
②2CrO42—(黄色)+2H+
 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O请回答下列问题:
Ⅰ.(1)滤液1的溶质除Na2CrO4、Na2SiO3外,还含有(填化学式)
(2)由滤液2转化为Na2Cr2O7溶液过程中,能说明反应达平衡状态的是
a.溶液的颜色不变
b.v (CrO42—)= 2v (Cr2O72—)
c.Cr2O72—和CrO42—的浓度相同
(3)向Na2Cr2O7溶液中加入KCl固体,获得K2Cr2O7晶体的操作依次是:加热浓缩、
Ⅱ.工业废水中常含有一定量的Cr2O72—和CrO42—,常用还原沉淀法处理。该方法的工艺流程为:

(4)请写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式
(5)已知常温下,Cr(OH)3的溶度积Ksp=10-32,要使第步过程中c(Cr3+)降至10-5mol/L,溶液的pH应调至



