名校
1 . 某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的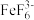 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入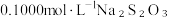 溶液滴定,发生反应:
溶液滴定,发生反应:
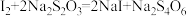 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:1.称取
 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;Ⅱ.取
 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的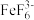 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;Ⅲ.向Ⅱ的锥形瓶中加入
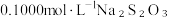 溶液滴定,发生反应:
溶液滴定,发生反应: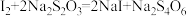 (无色);
(无色);Ⅳ.平行测定四次,四次滴定实验消耗
 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:| 滴定次数 | 待测溶液的体积/ | 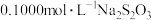 溶液的体积/ 溶液的体积/ | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。(1)盛装
 溶液,应选择下图中的
溶液,应选择下图中的
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是(4)滴定终点的现象
(5)Ⅳ所消耗的
 标准溶液平均体积为
标准溶液平均体积为 ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
 溶液
溶液
您最近一年使用:0次
名校
解题方法
2 . 工业上以黄铁矿(主要成分FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示:
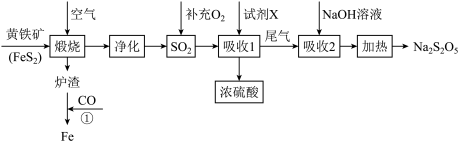
已知: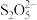 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。
回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为___________ (写出1种即可)。
(2)煅烧过程中主要发生的反应为 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的___________ 性,发生该反应的离子方程式为___________ 。
(3)“吸收1”中试剂X是___________ 。
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式___________ 。
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:___________ 。
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为___________ (填化学式)。图中的氨气来源于工业生产,而实验室制取NH3的方法与其不同,写出实验室制取氨气的化学方程式___________ 。


已知:
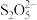 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为
(2)煅烧过程中主要发生的反应为
 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的(3)“吸收1”中试剂X是
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为

您最近一年使用:0次
名校
3 . 酸性KMnO4、H2O2在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要的氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式_______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是_______ mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是_______ (用文字表达),又变为棕黄色的离子方程式是_______ 。
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,配平下面方程式_______ 。
_______ +_______
+_______ +_______H+=_______Mn2++_______
+_______H+=_______Mn2++_______ +_______H2O
+_______H2O
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式
(2)取300 mL 0.2 mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量是
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是
(4)测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,配平下面方程式
_______
 +_______
+_______ +_______H+=_______Mn2++_______
+_______H+=_______Mn2++_______ +_______H2O
+_______H2O
您最近一年使用:0次
名校
解题方法
4 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号)。
(2)滤渣Ⅰ的主要成分是_______ (填化学式)。
(3)物质Ⅴ可代替高温连续氧化工序中的NaOH,此时高温连续氧化发生的主要反应的化学方程式为:_______ 。可代替NaOH的化学试剂还有_______ (填化学式)。
(4)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(5)酸性工业废水中含有的重铬酸根离子( )有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,反应的离子方程式为:
)有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,反应的离子方程式为:_______ 。
 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)滤渣Ⅰ的主要成分是
(3)物质Ⅴ可代替高温连续氧化工序中的NaOH,此时高温连续氧化发生的主要反应的化学方程式为:
(4)热解工序产生的混合气体最适宜返回工序
(5)酸性工业废水中含有的重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,反应的离子方程式为:
)有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,反应的离子方程式为:
您最近一年使用:0次
名校
5 . 根据要求回答下列问题:
(1)氯气与氢氧化钠在70℃时反应,生成物中 和NaClO的物质的量之比为3:1的离子方程式为
和NaClO的物质的量之比为3:1的离子方程式为_______ 。
(2) 与
与 按照1:1反应的离子方程式为
按照1:1反应的离子方程式为_______ 。
(3) 及
及 均可将溶液中的Ag+还原为银,从而可用于化学镀银。
均可将溶液中的Ag+还原为银,从而可用于化学镀银。
① 中,P元素的化合价为
中,P元素的化合价为_______ 。
②利用 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______ (填化学式)。
(4)取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是_______ mol。
(5)在 溶液中加入
溶液中加入 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是_______ ,又变为棕黄色的原因是_______ (用离子方程式解释)。
(1)氯气与氢氧化钠在70℃时反应,生成物中
 和NaClO的物质的量之比为3:1的离子方程式为
和NaClO的物质的量之比为3:1的离子方程式为(2)
 与
与 按照1:1反应的离子方程式为
按照1:1反应的离子方程式为(3)
 及
及 均可将溶液中的Ag+还原为银,从而可用于化学镀银。
均可将溶液中的Ag+还原为银,从而可用于化学镀银。①
 中,P元素的化合价为
中,P元素的化合价为②利用
 进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为
进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为(4)取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是
(5)在
 溶液中加入
溶液中加入 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
您最近一年使用:0次
名校
6 . 磷酸亚铁锂( )是新型锂离子电池的电极材料,来源广泛且无污染。利用钛铁矿(主要成分为
)是新型锂离子电池的电极材料,来源广泛且无污染。利用钛铁矿(主要成分为 ,含有少量
,含有少量 等杂质)制备
等杂质)制备 的工艺流程如图所示。
的工艺流程如图所示。
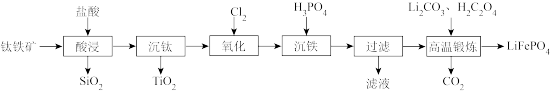
回答下列问题:
(1)反应过程中 的化合价没有发生变化,则
的化合价没有发生变化,则 中
中 元素的化合价为
元素的化合价为_______ 。
(2)实验室中进行过滤操作需要用到的玻璃仪器有烧杯、_______ 。
(3)氧化时发生反应的离子方程式为_______ ;滤液中溶质的主要为_______ (填化学式)。
(4)高温煅烧时发生反应的化学方程式为_______ 。
(5)理论上反应过程中消耗 和
和 的物质的量之比为
的物质的量之比为_______ 。
 )是新型锂离子电池的电极材料,来源广泛且无污染。利用钛铁矿(主要成分为
)是新型锂离子电池的电极材料,来源广泛且无污染。利用钛铁矿(主要成分为 ,含有少量
,含有少量 等杂质)制备
等杂质)制备 的工艺流程如图所示。
的工艺流程如图所示。
回答下列问题:
(1)反应过程中
 的化合价没有发生变化,则
的化合价没有发生变化,则 中
中 元素的化合价为
元素的化合价为(2)实验室中进行过滤操作需要用到的玻璃仪器有烧杯、
(3)氧化时发生反应的离子方程式为
(4)高温煅烧时发生反应的化学方程式为
(5)理论上反应过程中消耗
 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-01-23更新
|
712次组卷
|
3卷引用:黑龙江省绥化市第九中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
7 . 镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1) 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:

①加入 的目的是
的目的是___________ 。[已知: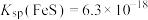 ,
, ,
, ,
, ]
]
②可用氯酸钠 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为___________ 。
③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下 的
的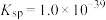 ,若要使溶液中
,若要使溶液中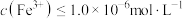 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于_____ 。
(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:
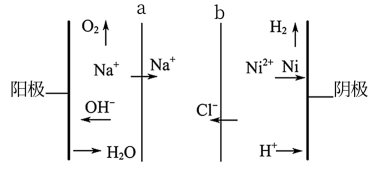
判断a是____ (填“阳膜”或“阴膜”);电解过程中,需要控制溶液pH为4左右,原因是____ 。
(1)
 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:
①加入
 的目的是
的目的是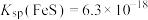 ,
, ,
, ,
, ]
]②可用氯酸钠
 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下
 的
的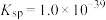 ,若要使溶液中
,若要使溶液中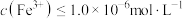 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:

判断a是
您最近一年使用:0次
2022-01-15更新
|
447次组卷
|
2卷引用:黑龙江省齐齐哈尔市第八中学2021-2022学年高二下学期开学考试化学试题
名校
8 . 四水合磷酸锌[Zn3(PO4)2·4H2O],摩尔质量为457g·mol-1,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:

已知:6NH4HCO3+3ZnSO4 ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
提示:在本实验条件下,高锰酸钾的还原产物是MnO2
(1)实验前需要将锌灰研磨成粉末状,原因是_______ 。
(2)步骤I中需将溶液pH调至5,应选择的最佳试剂是_______ (填字母)
a.NaOH b.ZnO c.Ba(OH)2
(3)步骤II中加入的a是_______ 。
(4)写出步骤I滴加KMnO4溶液发生的离子方程式_______ 。
(5)步骤IV反应结束后得到Zn3(PO4)2·4H2O的操作包括_______ 和干燥。
(6)称取45.7mgZn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______ 。


已知:6NH4HCO3+3ZnSO4
 ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑提示:在本实验条件下,高锰酸钾的还原产物是MnO2
(1)实验前需要将锌灰研磨成粉末状,原因是
(2)步骤I中需将溶液pH调至5,应选择的最佳试剂是
a.NaOH b.ZnO c.Ba(OH)2
(3)步骤II中加入的a是
(4)写出步骤I滴加KMnO4溶液发生的离子方程式
(5)步骤IV反应结束后得到Zn3(PO4)2·4H2O的操作包括
(6)称取45.7mgZn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为

您最近一年使用:0次
名校
解题方法
9 . 二氯化二硫 ( S2Cl2)是一种黄红色液体,常用作橡胶的低温硫化剂和粘结剂。S2Cl2分子中各原子最外层均有8个电子。S2Cl2遇水反应会产生淡黄色沉淀和刺激性气味气体。下列说法不正确 的是
| A.S2Cl2的结构式为 Cl—S —S—Cl |
| B.S2Cl2 可能使品红溶液褪色 |
| C.S2Cl2 与水反应时 ,氧化产物与还原产物的物质的量之比为 1 : 3 |
| D.将S2Cl2气体通入 AgNO3溶液中,若有白色沉淀产生,则 S2Cl2气体中有 HCl |
您最近一年使用:0次
2020-07-24更新
|
2104次组卷
|
13卷引用:黑龙江省齐齐哈尔市第八中学校2020-2021学年高二上学期开学考试化学试题
黑龙江省齐齐哈尔市第八中学校2020-2021学年高二上学期开学考试化学试题黑龙江齐齐哈尔第八中学校2021-2022学年高二上学期开学考试化学试题浙江省丽水市2019-2020学年高二下学期期末教学质量监控化学试题浙江省温州新力量联盟2020-2021学年高二上学期期末联考化学试题(已下线)【绍兴新东方】绍兴高中化学00012(已下线)高二上期末考化学194上海市建平中学2020-2021学年高三上学期期中考试化学试题湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题湖南省邵阳市隆回县第一中学2021-2022学年高三下学期第三次模拟考试化学试题(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)浙江省杭州第十四中学2022-2023学年高一上学期期末考试化学试题甘肃省定西市渭源县第一中学2022-2023学年高一下学期第一次阶段考试化学试题(已下线)【2023】【高一下】【其他】【余高1】【高中化学】【刘尼尼收集】
名校
10 . CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
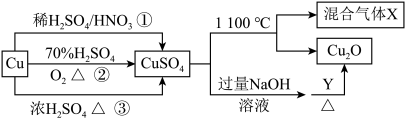
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.已知1molCuSO4在1100℃所得混合气体X为SO2和O2,则O2为0.75mol |
| D.Y可以是葡萄糖 |
您最近一年使用:0次
2020-07-17更新
|
815次组卷
|
8卷引用:黑龙江省大兴安岭实验中学2023-2024学年高二上学期开学考试化学试卷



