名校
1 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解,工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水化。请回答下列问题:
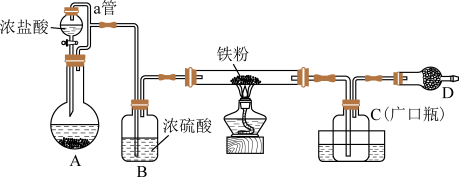
(1)添加浓盐酸的仪器名称是_______ 。
(2)在装置A中,用 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式_______ 。
(3)D中装的药品是碱石灰,其作用是_______ 。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_______ (只能选取一种试剂,填序号)进行俭测。
①H2O2溶液 ②KI一淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取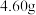 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;
②加入足量 溶液;
溶液;
③再加入足量 溶液:
溶液:
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为 。
。
则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______ (填“相等”“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氧化铁,可采取的“装置”改进措施是_______ 。

(1)添加浓盐酸的仪器名称是
(2)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式(3)D中装的药品是碱石灰,其作用是
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的
①H2O2溶液 ②KI一淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取
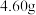 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;②加入足量
 溶液;
溶液;③再加入足量
 溶液:
溶液:④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为
 。
。则该样品中铁元素的质量分数为
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氧化铁,可采取的“装置”改进措施是
您最近一年使用:0次
名校
解题方法
2 . 以硅藻土为载体的五氧化二钒( )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
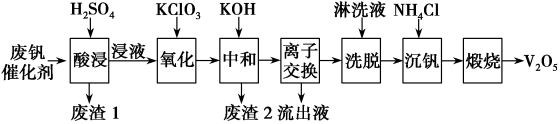
回答下列问题:
(1)“酸浸”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为_______ ,同时 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是_______ 。
(2)“氧化”中使 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: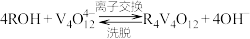 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为_______ 。
(5)“煅烧”中发生反应的化学方程式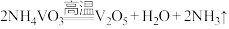 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_______ 。
(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到
_______ kg(保留小数点后一位)。
 )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:| 物质 |  |  |  |  |  |  |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“离子交换”和“洗脱”可简单表示为:
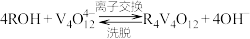 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
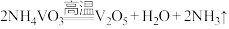 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到

您最近一年使用:0次
解题方法
3 . 实验室有一包久置的生铁粉末(成分为碳、铁和氧化铁)。为测定各组分的质量分数,小怡取两份质量均为mg的生铁粉末样品,分别进行如图实验。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为_______ ,所需的玻璃仪器有_______ 。
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为_______ ,检验硫酸铁溶液中Fe3+存在的试剂是_______ 。
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C 4Fe+3 CO2↑
4Fe+3 CO2↑
②Fe2O3+3H2 2Fe+3H2O↑。
2Fe+3H2O↑。
如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。
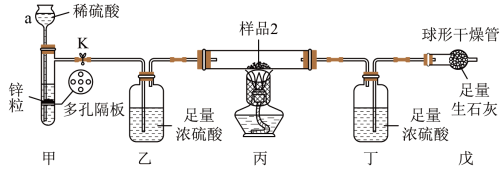
(3)仪器a的名称为_______ 。
(4)若无装置乙,会导致测得氧化铁的质量分数_______ (填“偏大”“偏小”或“不变”)。
(5)装置戊的作用为:_______ 。
(6)原样品中氧化铁的质量为_______ 。
I.测定碳的含量

已知:过氧化氢溶液能将Fe2+转化为Fe3+。
(1)步骤①的操作名称为
(2)溶液乙与过氧化氢溶液发生反应的离子方程式为
II.测定氧化铁的质量分数
【查阅资料】①2Fe2O3+3C
 4Fe+3 CO2↑
4Fe+3 CO2↑②Fe2O3+3H2
 2Fe+3H2O↑。
2Fe+3H2O↑。如图所示装置气密性良好。称量丁装置质量为ag,在硬质玻璃管中放入样品2,打开止水夹K,在球形干燥管出口处检验氢气纯净后,点燃酒精灯,待充分反应后,熄灭酒精灯,冷却至室温,关闭止水夹K,再次称量丁装置的质量为bg。

(3)仪器a的名称为
(4)若无装置乙,会导致测得氧化铁的质量分数
(5)装置戊的作用为:
(6)原样品中氧化铁的质量为
您最近一年使用:0次
名校
4 . 化学科学可以帮助我们安全、合理、有效地开发自然资源和使用各种化学品,为建设美丽家园发挥重要价值。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:
(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是_______ 法。
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是_______ 。
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为_______ 。
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。
②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+
请回答下列问题:
(4)装置 A 中发生反应的化学方程式为_______ 。
(5)装置 C 的作用为_______ ,装置 E 的作用为_______ 。
(6)装置 F 中发生反应的离子方程式为_______ 。
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为_______ (保留四位有效数字)。
Ⅰ.工业海水淡化及从海水中提取溴的过程如下:

(1)历史最久,技术和工艺也比较成熟,但成本较高的海水淡化的方法是
(2)步骤Ⅰ中已获得 Br2,步骤Ⅱ中又将 Br2还原为 Br-,其目的是
(3)步骤Ⅱ用 SO2溶液吸收 Br2,反应的离子方程式为
Ⅱ.亚硝酸钠(NaNO2)是生活中广泛应用的一种化学品,实验室可用如图装置制备(略去部分夹持仪器)。

②2NO2 + Na2O2 = 2NaNO3
③酸性条件下,NO、NO2和 NO
 都能与 MnO
都能与 MnO 反应生成 NO
反应生成 NO 和 Mn2+
和 Mn2+请回答下列问题:
(4)装置 A 中发生反应的化学方程式为
(5)装置 C 的作用为
(6)装置 F 中发生反应的离子方程式为
(7)为测定亚硝酸钠的含量,进行如下操作:称取 3.000 g 样品溶于水配成 250 mL 溶液,取 25.00 mL溶液于锥形瓶中,再向锥形瓶中加入 0.1000mol·L-1酸性 KMnO4溶液 16.00 mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数为
您最近一年使用:0次
22-23高三上·江苏南通·开学考试
名校
5 . ClO2是一种高效消毒灭菌剂,可用于灭活新冠病毒。ClO2稳定性差,工业上可将ClO2转化为较稳定的NaClO2保存。一种由NaClO3制取NaClO2晶体的流程如下:

已知高于60℃时,NaClO2易分解为NaClO3和NaCl。
(1)制C1O2.向用硫酸酸化的NaClO3中通入混有空气(起稀释作用)的SO2的气体,可制得C1O2气体。其他条件一定,若通入的SO2过量,所得ClO2的体积将减小,原因是_______ 。
(2)制NaClO2溶液。将一定量的ClO2通入NaOH和H2O2的混合溶液中,充分反应后可制得NaClO2溶液。由该反应可以比较反应物和产物中两种微粒的氧化性大小。碱性条件下,两种微粒的氧化性大小规律为_______>_______。_______
(3)制NaClO2晶体。已知NaClO2的溶解度曲线如图所示。设计由质量分数为10%的NaClO2溶液(含少量NaOH)制取NaClO2·3H2O晶体的实验方案:_______ 。

(4)NaClO2晶体使用时,向其中加入盐酸,即可得到ClO2气体。已知反应产物中只有一种气体和一种盐,则消耗1molNaClO2,可生成ClO2的物质的量为_______ 。
(5)ClO2还可将碱性废水中的CN-化为N2和CO ,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)__________

已知高于60℃时,NaClO2易分解为NaClO3和NaCl。
(1)制C1O2.向用硫酸酸化的NaClO3中通入混有空气(起稀释作用)的SO2的气体,可制得C1O2气体。其他条件一定,若通入的SO2过量,所得ClO2的体积将减小,原因是
(2)制NaClO2溶液。将一定量的ClO2通入NaOH和H2O2的混合溶液中,充分反应后可制得NaClO2溶液。由该反应可以比较反应物和产物中两种微粒的氧化性大小。碱性条件下,两种微粒的氧化性大小规律为_______>_______。
(3)制NaClO2晶体。已知NaClO2的溶解度曲线如图所示。设计由质量分数为10%的NaClO2溶液(含少量NaOH)制取NaClO2·3H2O晶体的实验方案:

(4)NaClO2晶体使用时,向其中加入盐酸,即可得到ClO2气体。已知反应产物中只有一种气体和一种盐,则消耗1molNaClO2,可生成ClO2的物质的量为
(5)ClO2还可将碱性废水中的CN-化为N2和CO
 ,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
,自身转化为Cl-。经测定,某冶炼废水中CN-含量为1040mg·L-1,处理该废水10m3,理论上需要通入标准状况下ClO2的体积为多少升?(写出计算过程)
您最近一年使用:0次
解题方法
6 . 碘化钠(NaI,白色粒状)常用于医学和摄影技术。以纯碱(含少量Na2SO4杂质)为原料制备NaI的流程如下:

已知:①I2与Na2CO3生成NaI、NaIO和NaIO3;
②
③NaI·2H2O易被O2氧化生成I2,且温度越高,反应速率越快;
④减压可使物质的沸点降低。
回答下列问题:
(1)“转化”时,向溶液中加入少量NaI的目的是_______ ;该步骤反应适宜的温度为40~70℃,温度不宜超过70℃的原因是_______ (从 的性质考虑)。
的性质考虑)。
(2)写出“还原”时, 发生反应的离子方程式:
发生反应的离子方程式:_______ ( )。
)。
(3)“除 ”时,若试剂a是稍过量的饱和Ba(OH)2溶液,则b是稍过量的
”时,若试剂a是稍过量的饱和Ba(OH)2溶液,则b是稍过量的_______ 。
(4)试剂X是_______
(5)获得NaI·2H2O时,采用减压蒸发的原因是_______ 。
(6)测定产品中NaI含量,采用电位滴定法测定,实验步骤如下:

该样品中NaI的质量分数为_______ 。

已知:①I2与Na2CO3生成NaI、NaIO和NaIO3;
②

③NaI·2H2O易被O2氧化生成I2,且温度越高,反应速率越快;
④减压可使物质的沸点降低。
回答下列问题:
(1)“转化”时,向溶液中加入少量NaI的目的是
 的性质考虑)。
的性质考虑)。(2)写出“还原”时,
 发生反应的离子方程式:
发生反应的离子方程式: )。
)。(3)“除
 ”时,若试剂a是稍过量的饱和Ba(OH)2溶液,则b是稍过量的
”时,若试剂a是稍过量的饱和Ba(OH)2溶液,则b是稍过量的(4)试剂X是
(5)获得NaI·2H2O时,采用减压蒸发的原因是
(6)测定产品中NaI含量,采用电位滴定法测定,实验步骤如下:

该样品中NaI的质量分数为
您最近一年使用:0次
2022-11-28更新
|
272次组卷
|
2卷引用:安徽省铜陵市等5地2022届高三下学期二模统考化学试题
解题方法
7 . 硝酸铈铵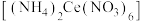 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。

(1)“沉淀1”时,溶液中 转化为
转化为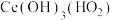 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:_______ 。
(2)“酸溶2”时,控制反应温度为80℃,硝酸与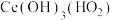 分解产生的
分解产生的 反应生成
反应生成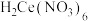 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是_______ 。
(3)“沉淀2”时,控制其他条件一定,改变加入 固体的量,测得
固体的量,测得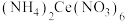 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是_______ 。
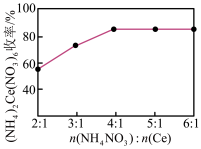
(4)实验小组以 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中,_______ ,得 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)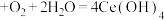 (黄色沉淀),
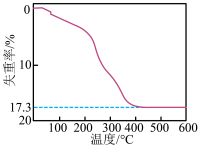
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、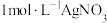 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为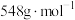 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用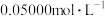 硫酸亚铁铵
硫酸亚铁铵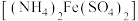 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数______ 。
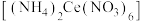 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。
(1)“沉淀1”时,溶液中
 转化为
转化为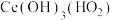 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:(2)“酸溶2”时,控制反应温度为80℃,硝酸与
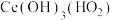 分解产生的
分解产生的 反应生成
反应生成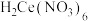 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是(3)“沉淀2”时,控制其他条件一定,改变加入
 固体的量,测得
固体的量,测得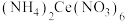 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是
(4)实验小组以
 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中, 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)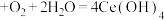 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、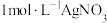 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为
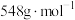 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用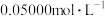 硫酸亚铁铵
硫酸亚铁铵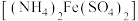 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
您最近一年使用:0次
8 . 钒的化合物能有效调节血糖,化合物丁有望成为抗糖尿病的新型药物,其制备流程如下:
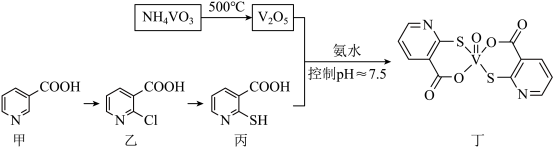
(1)钒在元素周期表中的位置为_______ ,基态V的原子结构示意图为_______ 。
(2) 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(3)下列说法正确的是_______(填字母)
(4)分析丙的分子结构与性质
①比较丙中 键角和
键角和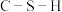 键角的大小并解释原因:
键角的大小并解释原因:_______
②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式_______ 。
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。
(6)丁是一种配合物含有化合物丁的样品中,含钒量的测定方法是:先把样品中的钒元素经处理转化为 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗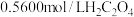 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为_______ (写出计算结果)。

(1)钒在元素周期表中的位置为
(2)
 转化为
转化为 的化学方程式是
的化学方程式是(3)下列说法正确的是_______(填字母)
A.元素的第一电离能: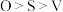 |
B.共价键的极性:丙中 乙中 乙中 |
| C.甲分子中所有原子可能在同一平面内 |
D.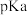 :乙>甲 :乙>甲 |
①比较丙中
 键角和
键角和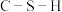 键角的大小并解释原因:
键角的大小并解释原因:②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。A. | B. | C. | D. |
 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗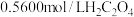 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为
您最近一年使用:0次
名校
解题方法
9 . Ⅰ.氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如图:
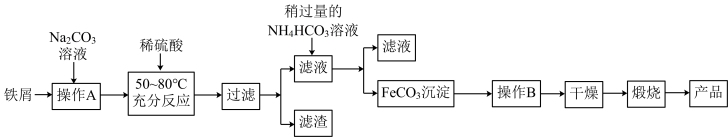
回答下列问题:
(1)“操作A”的目的是_______ ,检验“操作B”是否彻底的操作为_______ 。
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:_______ 。
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:_______ 。
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为_______ 。
(5)上述样品的质量分数为_______ 。
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。

回答下列问题:
(1)“操作A”的目的是
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为
(5)上述样品的质量分数为
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。
| A.未干燥锥形瓶 |
| B.盛装标准液的滴定管没有用标准液润洗 |
| C.滴定开始时平视刻度线读数,滴定结束时仰视刻度线读数 |
| D.量取待测液的滴定管没有润洗 |
您最近一年使用:0次
2022·浙江·模拟预测
解题方法
10 . 铁矿石中含铁量的测定是铁元素提炼的基础和前提,目前主要采用重铬酸钾法测定铁矿石中的铁含量,其流程如图所示:

已知:已知:①氧化性顺序: >Fe3+>
>Fe3+> 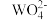 ;
;
②Sn在溶液中的主要存在形式为Sn2+和 ;
;
③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有_______ (任写两条)。
(2)“SnCl2还原”过程的离子反应方程式为_______ 。
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为_______ ,Na2WO4的作用为_______ 。
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是_______ 。
(5)“滴定”过程中,用移液管吸取一定体积待测液后,将移液管垂直放入稍倾斜的锥形瓶中,_______ ,数秒后,取出移液管。
(6)现称取m g铁矿石进行测定,“滴定”时共消耗V mL c mol·L−1 K2Cr2O7,则该铁矿石中铁的质量分数为_______ (用含m、c、V的代数式表示)。

已知:已知:①氧化性顺序:
 >Fe3+>
>Fe3+> 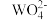 ;
;②Sn在溶液中的主要存在形式为Sn2+和
 ;
;③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有
(2)“SnCl2还原”过程的离子反应方程式为
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是
(5)“滴定”过程中,用移液管吸取一定体积待测液后,将移液管垂直放入稍倾斜的锥形瓶中,
(6)现称取m g铁矿石进行测定,“滴定”时共消耗V mL c mol·L−1 K2Cr2O7,则该铁矿石中铁的质量分数为
您最近一年使用:0次



