名校
1 . 水泥是重要的建筑材料,某兴趣小组欲用高锰酸钾法测定水泥中的钙含量,具体做法如下:称取一定质量的水泥样品,经过一系列操作将其转化为草酸钙( )沉淀,将此沉淀洗涤后溶于稀硫酸可得草酸(
)沉淀,将此沉淀洗涤后溶于稀硫酸可得草酸( ),再用高锰酸钾溶液滴定即可测定水泥样品中
),再用高锰酸钾溶液滴定即可测定水泥样品中 的含量。
的含量。
【实验一、配制高锰酸钾标准溶液】
如图是该小组同学配制50mL高锰酸钾溶液的过程示意图,且步骤①中游码读数不为0。
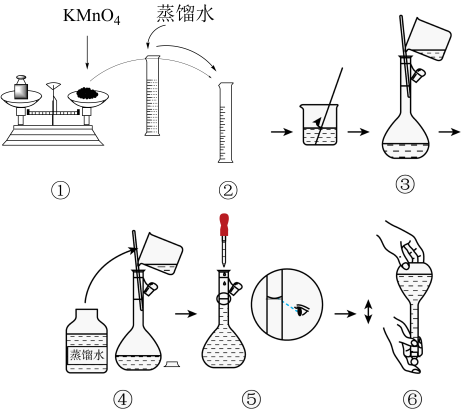
(1)请你观察图示判断,其中不正确的操作有_______ (填序号),容量瓶使用之前需要先_______ (填操作名称)。
(2)定容时的操作:当液面接近容量瓶刻度线时,_______ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将_______ (填“偏大”或“偏小”)。
【实验二、测定水泥样品中 的含量】
的含量】
称取0.4000g水泥样品,经过上述处理后得到草酸,再用重新配制的 标准溶液滴定,充分反应后消耗36.00mL溶液。
标准溶液滴定,充分反应后消耗36.00mL溶液。
(4)草酸与 反应的原理为:
反应的原理为: (未配平),请配平该离子方程式:
(未配平),请配平该离子方程式:_______ 。
(5)经过计算,该水泥样品中钙的质量分数为_______ 。
 )沉淀,将此沉淀洗涤后溶于稀硫酸可得草酸(
)沉淀,将此沉淀洗涤后溶于稀硫酸可得草酸( ),再用高锰酸钾溶液滴定即可测定水泥样品中
),再用高锰酸钾溶液滴定即可测定水泥样品中 的含量。
的含量。【实验一、配制高锰酸钾标准溶液】
如图是该小组同学配制50mL高锰酸钾溶液的过程示意图,且步骤①中游码读数不为0。

(1)请你观察图示判断,其中不正确的操作有
(2)定容时的操作:当液面接近容量瓶刻度线时,
(3)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
【实验二、测定水泥样品中
 的含量】
的含量】称取0.4000g水泥样品,经过上述处理后得到草酸,再用重新配制的
 标准溶液滴定,充分反应后消耗36.00mL溶液。
标准溶液滴定,充分反应后消耗36.00mL溶液。(4)草酸与
 反应的原理为:
反应的原理为: (未配平),请配平该离子方程式:
(未配平),请配平该离子方程式:(5)经过计算,该水泥样品中钙的质量分数为
您最近一年使用:0次
2 . 二氧化钒( )是一种新型热敏材料,实验室以
)是一种新型热敏材料,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为
的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为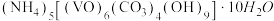 },过程如下:
},过程如下:

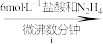
 溶液
溶液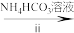 氧钒(IV)简式碳酸铵晶体
氧钒(IV)简式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)步骤ⅰ中生成 同时生成
同时生成 的化学方程式为
的化学方程式为___________ 。常温下,只用浓盐酸与 反应也能制备
反应也能制备 溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是___________ (用化学方程式和必要的文字说明)。
(2)步骤ⅱ可用下图仪器组装完成。___________ (用各接口字母表示)。
②饱和 溶液的作用是
溶液的作用是___________ 。
③反应结束后,将三颈烧瓶置于 保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和
保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和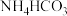 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和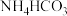 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是___________ (填阴离子的电子式)。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:

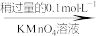

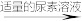

 消耗滴定的体积如下:
消耗滴定的体积如下:
滴定反应为 。
。
①滴定时,向锥形瓶中加入几滴___________ (填化学式)溶液作指示剂。
②粗产品中钒的质量分数为___________ %。
 )是一种新型热敏材料,实验室以
)是一种新型热敏材料,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为
的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为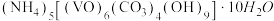 },过程如下:
},过程如下:
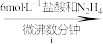
 溶液
溶液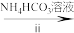 氧钒(IV)简式碳酸铵晶体
氧钒(IV)简式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)步骤ⅰ中生成
 同时生成
同时生成 的化学方程式为
的化学方程式为 反应也能制备
反应也能制备 溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是(2)步骤ⅱ可用下图仪器组装完成。

②饱和
 溶液的作用是
溶液的作用是③反应结束后,将三颈烧瓶置于
 保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和
保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和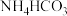 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和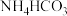 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:

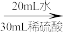
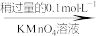


 消耗滴定的体积如下:
消耗滴定的体积如下:| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.99 |
| 2 | 1.10 | 21.10 |
| 3 | 1.56 | 21.57 |
 。
。①滴定时,向锥形瓶中加入几滴
②粗产品中钒的质量分数为
您最近一年使用:0次
2023-05-11更新
|
239次组卷
|
2卷引用:福建省百校联盟2023届高三下学期第三次模拟考试化学试题
名校
解题方法
3 . 大力发展新能源汽车产业是我国兑现碳中和承诺的重要战略之一。随着这一产业的发展,如何处理废旧锂电池成为一个亟需解决的问题。某废弃的钴酸锂( )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:

已知: 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的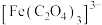 ,
,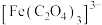 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。
(1)操作①的名称为______ ;由此可推测,氧化铝______ (填“能”或“不能”)溶于氢氧化钠溶液。
(2)溶液②中所含主要溶质为LiCl、 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)______ 。
(3)将溶液中的 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是__________________ 。
(4)为证明操作④获得的 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入______ ,若无白色沉淀生成,则证明沉淀洗涤干净。
(5)取3.66 g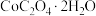 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为______ (填化学式);在956℃条件下反应完全后,剩余固体相对最开始反应前失重59%,此时固体成分的化学式为 ,
,
______ 。
(6)某同学设计如图装置测定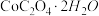 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是______ (填选项)。

A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以______ 离子形态存在,应加入______ 后再进行后续操作。
(8) 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为______ (填选项)。
A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为______ 。
 )电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
)电池中含有少量氧化铝、氧化铁和碳单质,为回收利用有关元素,某小组设计如下实验流程:
已知:
 与草酸根离子(
与草酸根离子( )结合生成较稳定的
)结合生成较稳定的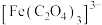 ,
,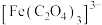 在强酸性条件下分解重新生成
在强酸性条件下分解重新生成 。
。(1)操作①的名称为
(2)溶液②中所含主要溶质为LiCl、
 ,请写出
,请写出 和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)
和盐酸反应的化学方程式中LiCoO2和HCl的最简系数比(提示:产物有氯气)(3)将溶液中的
 转化为
转化为 沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是
沉淀也是常用的沉钴方案。在此流程中选用草酸铵而不用碳酸盐的原因是(4)为证明操作④获得的
 沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入
沉淀表面的杂质已被洗涤干净,所需进行的实验操作为:取少量的最后一次洗涤液于试管中,加入(5)取3.66 g
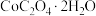 (相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为
(相对分子质量183)隔绝空气加热,在205℃条件下反应完全后,剩余固体质量为2.94 g,此时分解产生的气体为 ,
,
(6)某同学设计如图装置测定
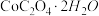 晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
晶体中结晶水的含量以检验样品的纯度。下列有关说法不正确的是
A. B中应装入浓硫酸,目的是除去水蒸气
B. 利用干燥管前后质量差可计算出结晶水的含量
C. 图中半透膜可让气体通过又可防止固体粉末进入导管
D. 反应结束后,应先停止加热,一段时间后再停止通空气
(7)溶液④中,铁元素主要以
(8)
 溶液在工业上常用于电路板的蚀刻,发生的反应为
溶液在工业上常用于电路板的蚀刻,发生的反应为 。某同学向含有
。某同学向含有 、
、 和
和 三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为
三种溶质的溶液中加入一定量的铁粉,若反应完成后有固体剩余,则固体的成分可能为A. Fe B. Fe和Zn C. Fe和Cu D. Cu和Zn
(9)某a g混合粉末中含有铁、石墨、硫和碳酸氢铵,在空气中充分加热至完全反应后,重新称量剩余固体质量,仍为a g,则混合物中铁的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 工业上,处理低品位黄铜矿[二硫化亚铁铜(CuFeS2)含量较低]常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)。相关流程如图。
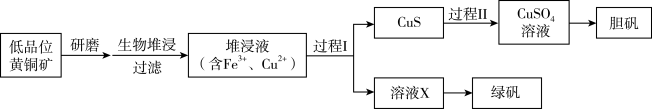
已知:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如表。
(1)生物堆浸前,需先将矿石进行研磨,目的是____ 。
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2+4H++O2 Cu2++Fe2++2S+2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为____ 。
(3)结合已知推断:生物堆浸过程中,应控制溶液的pH在____ 范围内。
(4)过程I中,加入Na2S2O3固体会还原堆浸液中的Fe3+,得到溶液X。为检验溶液X中Fe2+,可取少量溶液X,向其中加入____ 试剂(填试剂的化学式),观察反应现象。
(5)过程II中,用H2O2和稀硫酸处理,CuS完全反应,过滤生成的沉淀物后,可得CuSO4溶液。用离子方程式表示H2O2的作用是____ 。
(6)绿矾的纯度可通过KMnO4滴定法测定。取mg绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的KMnO4溶液滴定。至恰好完全反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的表达式为___ 。(已知:FeSO4•7H2O的摩尔质量为278g/mol)

已知:①生物堆浸使用的氧化亚铁硫杆菌(T.f细菌)在pH1.0~6.0范围内可保持活性。
②金属离子沉淀的pH如表。
| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀时的pH | 1.5 | 4.2 | 6.3 |
| 完全沉淀时的pH | 2.8 | 6.7 | 8.3 |
(1)生物堆浸前,需先将矿石进行研磨,目的是
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为:CuFeS2+4H++O2
 Cu2++Fe2++2S+2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为
Cu2++Fe2++2S+2H2O,第二阶段的反应为Fe2+继续被氧化转变成Fe3+,反应的离子方程式为(3)结合已知推断:生物堆浸过程中,应控制溶液的pH在
(4)过程I中,加入Na2S2O3固体会还原堆浸液中的Fe3+,得到溶液X。为检验溶液X中Fe2+,可取少量溶液X,向其中加入
(5)过程II中,用H2O2和稀硫酸处理,CuS完全反应,过滤生成的沉淀物后,可得CuSO4溶液。用离子方程式表示H2O2的作用是
(6)绿矾的纯度可通过KMnO4滴定法测定。取mg绿矾晶体,加适量稀硫酸溶解。用物质的量浓度为cmol/L的KMnO4溶液滴定。至恰好完全反应时,消耗KMnO4溶液的体积为VmL。绿矾晶体质量分数的表达式为
您最近一年使用:0次
解题方法
5 . 二氧化钒( )是一种新型热敏材料,实验室以
)是一种新型热敏材料,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为
的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为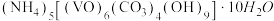 },过程如下:
},过程如下:
回答下列问题:
(1)步骤ⅰ中生成 同时生成
同时生成 的化学方程式为
的化学方程式为___________ 。常温下,只用浓盐酸与 反应也能制备
反应也能制备 溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是___________ (用化学方程式和必要的文字说明)。
(2)步骤ii可用下图仪器组装完成。___________ (用各接口字母表示)。
②饱和 溶液的作用是
溶液的作用是___________ 。
③反应结束后,将三颈烧瓶置于 保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和
保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和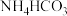 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是___________ (填阴离子的电子式)。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:
滴定反应为 。
。
①滴定时,向锥形瓶中加入几滴___________ (填化学式)溶液作指示剂。
②粗产品中钒的质量分数为___________ %。
 )是一种新型热敏材料,实验室以
)是一种新型热敏材料,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为
的氧钒(Ⅳ)碱式碳酸铵晶体{化学式为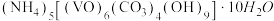 },过程如下:
},过程如下: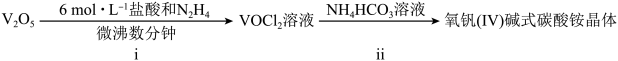
回答下列问题:
(1)步骤ⅰ中生成
 同时生成
同时生成 的化学方程式为
的化学方程式为 反应也能制备
反应也能制备 溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是
溶液,但该方法未被推广,从环保角度分析该方法未被推广的主要原因是(2)步骤ii可用下图仪器组装完成。

②饱和
 溶液的作用是
溶液的作用是③反应结束后,将三颈烧瓶置于
 保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和
保护下的干燥器中,静置过滤可得到紫红色晶体,然后抽滤,先用饱和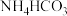 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和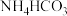 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品中钒的含量。实验步骤如下:

| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.00 | 19.99 |
| 2 | 1.10 | 21.10 |
| 3 | 1.56 | 21.57 |
 。
。①滴定时,向锥形瓶中加入几滴
②粗产品中钒的质量分数为
您最近一年使用:0次
解题方法
6 . 硝酸铈铵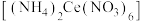 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。

(1)“沉淀1”时,溶液中 转化为
转化为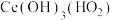 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:_______ 。
(2)“酸溶2”时,控制反应温度为80℃,硝酸与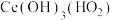 分解产生的
分解产生的 反应生成
反应生成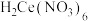 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是_______ 。
(3)“沉淀2”时,控制其他条件一定,改变加入 固体的量,测得
固体的量,测得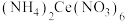 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是_______ 。
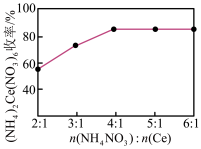
(4)实验小组以 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中,_______ ,得 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)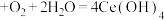 (黄色沉淀),
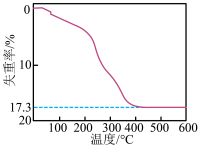
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、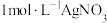 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为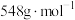 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用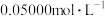 硫酸亚铁铵
硫酸亚铁铵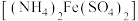 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数______ 。
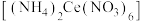 、二氧化铈(
、二氧化铈( )均是常见的强氧化剂,可以以
)均是常见的强氧化剂,可以以 为原料进行制取。
为原料进行制取。
(1)“沉淀1”时,溶液中
 转化为
转化为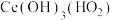 沉淀。写出沉淀1反应的化学方程式:
沉淀。写出沉淀1反应的化学方程式:(2)“酸溶2”时,控制反应温度为80℃,硝酸与
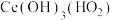 分解产生的
分解产生的 反应生成
反应生成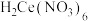 ,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将
,反应过程中有少量红棕色气体逸出。“酸溶2”时需控制硝酸的温度为80℃,同时将 分批加入硝酸中,原因是
分批加入硝酸中,原因是(3)“沉淀2”时,控制其他条件一定,改变加入
 固体的量,测得
固体的量,测得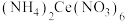 沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入
沉淀的收率如图所示。“沉淀2”时,不是采用反应计量数之比,而是控制加入 的目的是
的目的是
(4)实验小组以
 为原料制取
为原料制取 ,请补充完整实验方案:将
,请补充完整实验方案:将 完全溶解于盐酸中,
完全溶解于盐酸中, 固体。[已知:
固体。[已知: (白色沉淀)
(白色沉淀)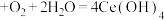 (黄色沉淀),
(黄色沉淀), 受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂:
受热分解时失重百分比与温度的关系如图所示。可选用的仪器和试剂: 氨水、
氨水、 、
、 、
、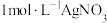 溶液、马弗炉(可用于固体的高温加热)]
溶液、马弗炉(可用于固体的高温加热)]
(5)实验制得的硝酸铈铵(摩尔质量为
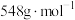 )含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用
)含量可用如下方法测定:准确称取16.0g硝酸铈铵样品,加水充分溶解,并转移至100mL容量瓶中定容、摇匀,得硝酸铈铵溶液试样。准确量取5mL的硝酸铈铵溶液试样,移入250mL锥形瓶中,加入适量硫酸和磷酸,并加入2滴0.25%邻二氮杂菲指示剂,用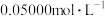 硫酸亚铁铵
硫酸亚铁铵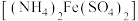 标准溶液滴定至终点(滴定过程中
标准溶液滴定至终点(滴定过程中 被还原为
被还原为 ),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
),消耗标准溶液24.00mL。计算该样品中硝酸铈铵的质量分数
您最近一年使用:0次
7 . 煤化学链技术具有成本低、能耗低的 捕集特性。以铁矿石(主要含铁物质为
捕集特性。以铁矿石(主要含铁物质为 )为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
)为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。

(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是___________ 。
(2)分离燃烧反应器中产生的 (g)和
(g)和 ,可进行
,可进行 高纯捕集和封存,其分离方法是
高纯捕集和封存,其分离方法是___________ 。
(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡( )溶液。
)溶液。
ii.用重铬酸钾( )标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时
)标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时 溶液过量会对测定结果产生影响,分析影响结果及其原因
溶液过量会对测定结果产生影响,分析影响结果及其原因___________ 。
(4)测定燃烧反应后产物中单质铁含量:取a g样品,用 溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
 溶标准液,消耗
溶标准液,消耗 标准液V mL。已知
标准液V mL。已知 被还原为
被还原为 ,样品中单质铁的质量分数为
,样品中单质铁的质量分数为___________ 。
(5)⼯艺中不同价态铁元素含量测定结果如下。
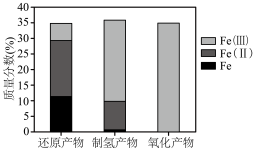
①制氢产物主要为 ,写出蒸汽反应器中发生反应的化学方程式
,写出蒸汽反应器中发生反应的化学方程式___________ 。
②⼯艺中可循环使用的物质是___________ (填化学式)。
 捕集特性。以铁矿石(主要含铁物质为
捕集特性。以铁矿石(主要含铁物质为 )为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
)为载氧体的煤化学链制氢⼯艺如下图。测定反应前后不同价态铁的含量,对工艺优化和运行监测具有重要意义。
(1)进入燃烧反应器前,铁矿石需要粉碎,煤需要烘干研磨,其目的是
(2)分离燃烧反应器中产生的
 (g)和
(g)和 ,可进行
,可进行 高纯捕集和封存,其分离方法是
高纯捕集和封存,其分离方法是(3)测定铁矿石中全部铁元素含量。
i.配制铁矿石待测液:铁矿石加酸溶解,向其中滴加氯化亚锡(
 )溶液。
)溶液。ii.用重铬酸钾(
 )标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时
)标准液滴定可测定样品中全部铁元素含量。配制铁矿石待测液时 溶液过量会对测定结果产生影响,分析影响结果及其原因
溶液过量会对测定结果产生影响,分析影响结果及其原因(4)测定燃烧反应后产物中单质铁含量:取a g样品,用
 溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
溶液充分浸取(FeO不溶于该溶液),向分离出的浸取液中滴加b
 溶标准液,消耗
溶标准液,消耗 标准液V mL。已知
标准液V mL。已知 被还原为
被还原为 ,样品中单质铁的质量分数为
,样品中单质铁的质量分数为(5)⼯艺中不同价态铁元素含量测定结果如下。

①制氢产物主要为
 ,写出蒸汽反应器中发生反应的化学方程式
,写出蒸汽反应器中发生反应的化学方程式②⼯艺中可循环使用的物质是
您最近一年使用:0次
8 . 钒的化合物能有效调节血糖,化合物丁有望成为抗糖尿病的新型药物,其制备流程如下:
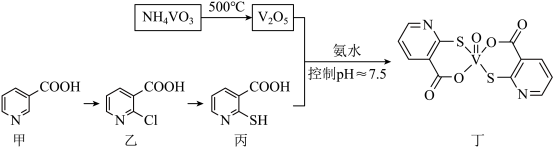
(1)钒在元素周期表中的位置为_______ ,基态V的原子结构示意图为_______ 。
(2) 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(3)下列说法正确的是_______(填字母)
(4)分析丙的分子结构与性质
①比较丙中 键角和
键角和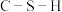 键角的大小并解释原因:
键角的大小并解释原因:_______
②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式_______ 。
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。
(6)丁是一种配合物含有化合物丁的样品中,含钒量的测定方法是:先把样品中的钒元素经处理转化为 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗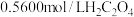 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为_______ (写出计算结果)。

(1)钒在元素周期表中的位置为
(2)
 转化为
转化为 的化学方程式是
的化学方程式是(3)下列说法正确的是_______(填字母)
A.元素的第一电离能: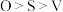 |
B.共价键的极性:丙中 乙中 乙中 |
| C.甲分子中所有原子可能在同一平面内 |
D.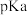 :乙>甲 :乙>甲 |
①比较丙中
 键角和
键角和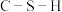 键角的大小并解释原因:
键角的大小并解释原因:②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。A. | B. | C. | D. |
 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗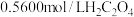 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
9 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
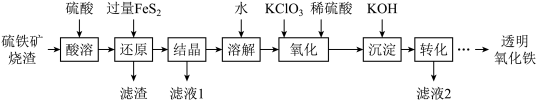
已知:Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)“滤渣”中的主要成分是___________ 。
(2)流程中“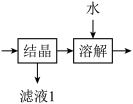 ”环节的目的是
”环节的目的是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以___________ 。
(5)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
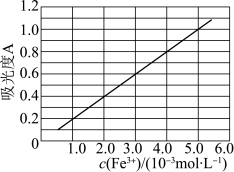
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为___________ %(保留小数点后一位);若吸光度A减小,则氧化铁红的含量将___________ (填“增大”或“减小”)。

已知:Ⅰ.透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
Ⅱ.Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)“滤渣”中的主要成分是
(2)流程中“
 ”环节的目的是
”环节的目的是(3)“还原”过程中涉及的离子方程式为
(4)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(5)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红的质量分数为
您最近一年使用:0次
解题方法
10 . I.利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如图:
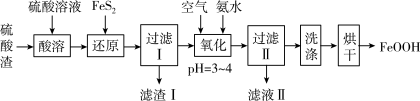
(1)滤渣I的主要成分是FeS2、S和_______ (填化学式);Fe3+被FeS2还原的离子方程式为_______ 。
(2)“氧化”中,生成FeOOH的离子方程式为_______ 。
II.聚合硫酸铁[Fex(OH)y(SO4)z]m简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
(3)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下图所示:

可知聚合硫酸铁PFS最佳投加量是_______ ,最佳pH是_______ 。
(4)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②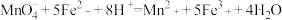
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c.用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求_______ (填“符合”或“不符合”)。

(1)滤渣I的主要成分是FeS2、S和
(2)“氧化”中,生成FeOOH的离子方程式为
II.聚合硫酸铁[Fex(OH)y(SO4)z]m简称PFS,是一种高效絮凝剂,广泛用于水的净化,其中铁元素为+3价。
(3)用聚合硫酸铁PFS进行模拟净化高岭土废水(用高岭土与自来水配制而成,其中质量浓度为100 mg·L-1)。该高岭土废水净化效果(即浊度去除率)受絮凝剂的投加量及pH的影响如下图所示:

可知聚合硫酸铁PFS最佳投加量是
(4)已知:①聚合硫酸铁一等品质总铁含量性能指标要求:铁的质量分数大于11.0%。
②
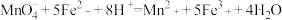
为测定某聚合硫酸铁样品中铁的含量是否达到一级品质指标要求,进行如下实验:
a.准确称取1.500 g该聚合硫酸铁样品溶于适量硫酸,配成100.00 mL溶液A。
b.准确量取20.00 mL溶液A,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗涤的滤出液合并配成溶液B。
c.用0.0100 mol·L-1的酸性KMnO4溶液滴加到溶液B中至恰好反应完全,消耗酸性KMnO4溶液13.20 mL。
请通过计算确定该聚合硫酸铁样品中铁的含量是否符合指标要求
您最近一年使用:0次



