解题方法
1 . 雷雨天 转化为
转化为 的流程为:
的流程为: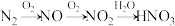
(1) 转化为NO的化学方程式是“
转化为NO的化学方程式是“_____ 。”
(2)NO转化为 的化学方程式是“
的化学方程式是“_____ 。”
(3) 转化为
转化为 的化学方程式是“
的化学方程式是“_____ 。”
 转化为
转化为 的流程为:
的流程为: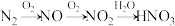
(1)
 转化为NO的化学方程式是“
转化为NO的化学方程式是“(2)NO转化为
 的化学方程式是“
的化学方程式是“(3)
 转化为
转化为 的化学方程式是“
的化学方程式是“
您最近半年使用:0次
2 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有_______ (填序号,下同),属于非电解质的有_______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为_______ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_______ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式_______ :
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
3 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。 的一种制备方法如下图所示:
的一种制备方法如下图所示: 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为_______ ,生成的沉淀与硝酸反应,生成_______ 后可循环使用。
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
 粉进行转化反应的离子方程式为
粉进行转化反应的离子方程式为
您最近半年使用:0次
解题方法
4 . 在催化剂作用下,肼蒸气受热可分解生成N2和一种能使湿润红色石蕊试纸变蓝的气体。写出该反应的化学方程式:_____________ 。
您最近半年使用:0次
解题方法
5 . 在酸性条件下,黄铁矿( ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
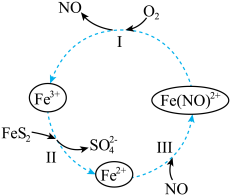
总反应:
(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:_______ 。
②反应Ⅱ:_______ 。
(2)NO在总反应中的作用是_______ 。
 ,其中S为~1价)催化氧化的反应转化如图所示。
,其中S为~1价)催化氧化的反应转化如图所示。
总反应:

(1)分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
您最近半年使用:0次
23-24高一下·全国·课前预习
6 . 氨可在加热条件下和氧化铜反应生成铜和氮气,反应的化学方程式为____ 。
您最近半年使用:0次
名校
7 . 高铁酸钾是一种新型水处理剂,使用说明书如下。
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在___________ (填“酸性”“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,错误的是
的说法中,错误的是___________ (填字母)。
a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4) 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为___________ ;该反应消耗 转移的电子数为
转移的电子数为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(5)消毒净化 水,至少需要
水,至少需要 的质量为
的质量为___________  。
。
(6)产生 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是___________ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着  减小,稳定性下降。 减小,稳定性下降。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 能与水反应放出氧气并通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用。 胶体,可除去水中细微的悬浮物,有净水作用。【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放 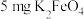 即可达到卫生标准 即可达到卫生标准 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,错误的是
的说法中,错误的是a.是具有强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)
 与水反应生成
与水反应生成 胶体、
胶体、 和
和 反应的化学方程式为
反应的化学方程式为 转移的电子数为
转移的电子数为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(5)消毒净化
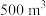 水,至少需要
水,至少需要 的质量为
的质量为 。
。(6)产生
 胶体时,该分散系区别于其他分散系的本质特征是
胶体时,该分散系区别于其他分散系的本质特征是
您最近半年使用:0次
8 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ (填“氧化”或“还原”,下同)。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。
①配平上述氧化还原反应方程式___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为:
的反应为: 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1mol 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为___________ ,转移电子的数目为___________ 。
②用“单线桥”标出反应中电子转移的方向与数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为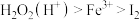 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为___________ 。
(1)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。①配平上述氧化还原反应方程式
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为:
的反应为: 。
。①该反应中的还原产物是
 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为②用“单线桥”标出反应中电子转移的方向与数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是a.
 b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为
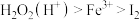 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近半年使用:0次
名校
9 . 滴定是一种重要的定量实验方法。现拟用KMnO4溶液去测定市场上售卖的草酸的纯度,步骤如下:(已知:M(H2C2O4)=90g·mol-1)
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式___________ 。
(2)滴定时盛装KMnO4标准溶液所用仪器为___________ 。
(3)由如图可知消耗KMnO4溶液体积为___________ mL。

(4)滴定终点的现象为___________ 。
(5)通过上述数据,求得草酸的纯度为___________ 。(精确度保留到0.1)
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果___________ (偏大、偏小或无影响,下同);
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果___________ ;
③滴定前有气泡,滴定后气泡消失,引起实验结果___________ ;
④滴定前正确读数,滴定后俯视,引起实验结果___________ 。
①称取1.260g草酸样品,将其制成100mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适的稀H2SO4;
③用浓度为0.05000mol·L-1的KMnO4标准溶液进行滴定。
(1)请写出与滴定有关反应的离子方程式
(2)滴定时盛装KMnO4标准溶液所用仪器为
(3)由如图可知消耗KMnO4溶液体积为

(4)滴定终点的现象为
(5)通过上述数据,求得草酸的纯度为
(6)误差分析:
①以标准KMnO4溶液滴定样品溶液的浓度时,未用标准KMnO4溶液润洗滴定管,引起实验结果
②用酸式滴定管量取待测液时,未用待测液润洗滴定管,引起实验结果
③滴定前有气泡,滴定后气泡消失,引起实验结果
④滴定前正确读数,滴定后俯视,引起实验结果
您最近半年使用:0次
名校
10 . 工业上常常使用过氧化氢,它是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用于消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250 mL___________ (填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。_______
 MnO
MnO +
+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ H2O+
H2O+ ___________
___________
(3)滴定时,将高锰酸钾标准溶液注入___________ (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________ 。
(4)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________ 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果___________ (填“偏高”或“偏低”)。
(1)移取10.00 mL密度为ρ g·mL-1的过氧化氢溶液至250 mL
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
 MnO
MnO +
+ H2O2+
H2O2+ H+=
H+= Mn2++
Mn2++ H2O+
H2O+ ___________
___________(3)滴定时,将高锰酸钾标准溶液注入
(4)重复滴定三次,平均耗用c mol·L-1 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
您最近半年使用:0次



