解题方法
1 . 甘肃矿产资源丰富,镍、钴、铂等金属储量全国领先,有色金属冶炼在国民经济发展有着重要作用。利用紫硫镍铁矿石提取粗镍并回收铁、铜、钴等元素的工艺流程如下:
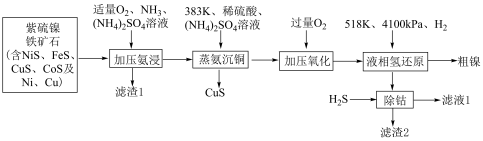
已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为: ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。
②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为___________ 。
(2)结合下列图表选择“加压氨浸”的最佳条件___________ 。

(3)“加压氨浸”过程中“加压”的目的是___________ 、___________ ;Cu发生反应的化学方程式为___________ 。
(4)“加压氧化”的目的是氧化残留的___________ (填离子符号)。
(5)“除钴”过程中发生反应的离子方程式为___________ 。
(6)流程中可以循环利用的物质有___________ (填化学式)。

已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为:
 ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为
(2)结合下列图表选择“加压氨浸”的最佳条件

(3)“加压氨浸”过程中“加压”的目的是
(4)“加压氧化”的目的是氧化残留的
(5)“除钴”过程中发生反应的离子方程式为
(6)流程中可以循环利用的物质有
您最近一年使用:0次
名校
解题方法
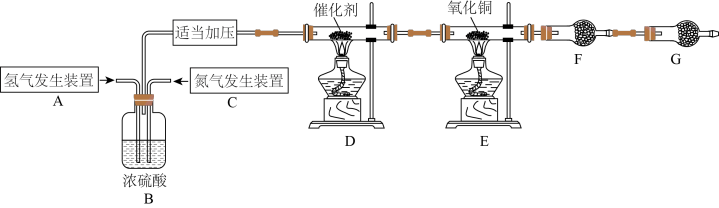
2 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下: 。请回答下列问题:
。请回答下列问题:
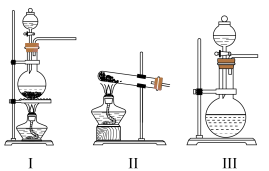
(1)C装置应选用______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②______ ;③______ 。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为____________________ 。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
(5)G装置的作用是①______ ;②______ 。
若没有G装置,测得结果Ar(Cu)______ (填“偏大”“偏小”或“无影响”)。
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。______ (填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=______ (用含有m1、m2、m3的式子表示)。
 。请回答下列问题:
。请回答下列问题:(1)C装置应选用
(2)装置B的作用是:①使气体混合均匀;②
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
| A.五氧化二磷 | B.无水CuSO4 | C.碱石灰 | D.无水CaCl2 |
(5)G装置的作用是①
若没有G装置,测得结果Ar(Cu)
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
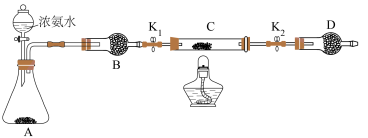
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近一年使用:0次
2024-03-12更新
|
592次组卷
|
5卷引用:甘肃省兰州第一中学2023-2024学年高一下学期3月月考化学试题
名校
3 . 三氧化二砷(俗称砒霜,分子式As2O3)微溶于水。主要用于提炼单质砷及冶炼砷合金和制造半导体。从硫化砷渣(含As2S3、CuS、Bi2S3)中回收As2O3的流程如下:

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为___________ ,该工序需要将硫化砷渣粉碎,其目的是___________ ;碱浸渣的主要成分为___________ (写化学式)。
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为___________ 。
(3)下列有关硫黄的性质和用途的说法错误的是___________ (填字母)。
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
(4)“还原”时,反应的离子方程式为___________ ;该过程中,反应温度对产物中As2O3含量和砷的回收率的影响如图所示。随着温度升高,As2O3含量和砷的回收率逐渐降低的原因可能是___________ (写一点即可)。
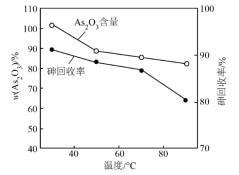
(5)设计流程a、b的目的是___________ 。

回答下列问题:
(1)“碱浸”时,As2S3反应生成Na3AsO3和Na3AsS3的离子方程式为
(2)“氧化脱硫”时,Na3AsS3反应的化学方程式为
(3)下列有关硫黄的性质和用途的说法错误的是
a.不溶于水,易溶于乙醇 b.可用于制造农药、火柴、火药
c.易溶于二硫化碳 d.硫黄在足量氧气中燃烧生成三氧化硫
(4)“还原”时,反应的离子方程式为

(5)设计流程a、b的目的是
您最近一年使用:0次
名校
解题方法
4 . 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:
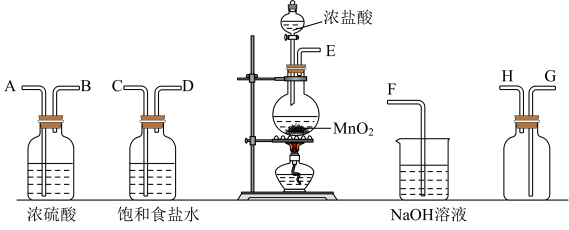
(1)盛有浓盐酸的仪器名称_______ ,装置的正确连接顺序为E→_______ →F。
(2)气体发生装置中发生反应的化学方程式为_______ 。
(3)装置中饱和食盐水的作用是_______ 。
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用_______ 。
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:
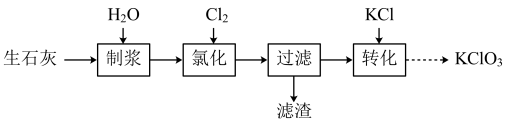
注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是_______ 。
(6)根据如图的溶解度曲线(如图),回答下列问题。
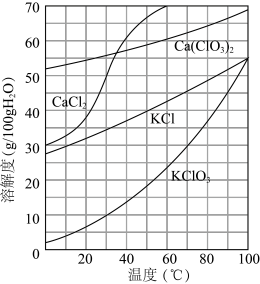
向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是_______ 。若溶液中KClO3的含量为100g•L-1,从该溶液中尽可能多地析出KClO3固体的方法是_______ 。
I.某化学小组设计如图装置制备少量纯净干燥的氯气,试回答下列问题:

(1)盛有浓盐酸的仪器名称
(2)气体发生装置中发生反应的化学方程式为
(3)装置中饱和食盐水的作用是
(4)请用离子方程式表示装置中的氢氧化钠溶液的作用
II.一种以氯气和生石灰(CaO)为原料制备KClO3的流程如图:

注:氯化过程中Cl2与Ca(OH)2作用生成Ca(ClO)2,Ca(ClO)2进一步转化为Ca(ClO3)2。
(5)氯化过程中需缓慢通入Cl2的目的是
(6)根据如图的溶解度曲线(如图),回答下列问题。

向滤液中加入过量KCl固体可将溶液中Ca(ClO3)2转化为KClO3固体而析出的原因是
您最近一年使用:0次
名校
解题方法
5 . 硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出):
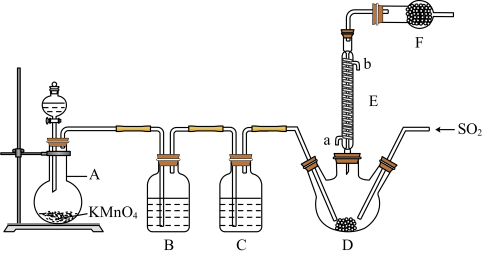
已知:
①SO2(g)+Cl2(g) SO2Cl2(1) △H=-97.3kJ/mol。
SO2Cl2(1) △H=-97.3kJ/mol。
②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ 。
(2)装置B的作用为_______ ,若缺少装置C,装置D中SO2与Cl2还可能发生反应的化学方程式为_______ 。
(3)仪器F的名称为_______ ,E中冷凝水的入口是_______ (填“а”或“b”),F的作用除了防止空气中水蒸气进入D装置内之外,还可以_______ 。
(4)当装置A中排出氯气1.12L(已折算成标准状况)时,最终得到4.05g纯净的硫酰氯,则硫酰氯的产率为_______ 。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______ (填序号)。
①加热三颈烧瓶
②控制气流速率,不宜过快
③若三颈烧瓶发烫,可适当降温
④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是_______ 。

已知:
①SO2(g)+Cl2(g)
 SO2Cl2(1) △H=-97.3kJ/mol。
SO2Cl2(1) △H=-97.3kJ/mol。②硫酰氯常温下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。
回答下列问题:
(1)装置A中发生反应的离子方程式为
(2)装置B的作用为
(3)仪器F的名称为
(4)当装置A中排出氯气1.12L(已折算成标准状况)时,最终得到4.05g纯净的硫酰氯,则硫酰氯的产率为
①加热三颈烧瓶
②控制气流速率,不宜过快
③若三颈烧瓶发烫,可适当降温
④先通冷凝水,再通气
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯2ClSO3H=SO2Cl2+H2SO4,分离产物的方法是
| A.重结晶 | B.过滤 | C.蒸馏 | D.萃取 |
您最近一年使用:0次
名校
解题方法
6 . 高铁酸钾((K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如图:
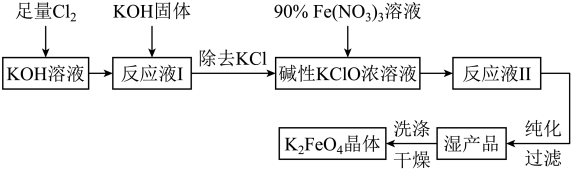
已知:①Cl2与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO、H2O;温度较高时产物为NaCl、NaClO3、H2O。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出此工艺流程中Cl2通入KOH溶液的化学方程式:_______ 。
(2)在“反应液I”中加入KOH固体的目的是①_______ ,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO浓溶液反应的离子方程式:_______ 。
(4)从“反应液Ⅱ”中分离出K2FeO4后,副产品是_______ (写化学式)。
(5)K2FeO4可作为新型多功能水处理剂的原因是:①_______ ,②_______ 。
(6)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为_______ mol。

已知:①Cl2与NaOH溶液反应的产物与反应温度有关,温度较低时产物为NaCl、NaClO、H2O;温度较高时产物为NaCl、NaClO3、H2O。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出此工艺流程中Cl2通入KOH溶液的化学方程式:
(2)在“反应液I”中加入KOH固体的目的是①
(3)写出Fe(NO3)3溶液与碱性KClO浓溶液反应的离子方程式:
(4)从“反应液Ⅱ”中分离出K2FeO4后,副产品是
(5)K2FeO4可作为新型多功能水处理剂的原因是:①
(6)该工艺每得到1.98kgK2FeO4,理论上消耗Cl2的物质的量为
您最近一年使用:0次
2023-11-07更新
|
171次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
7 . 氮化锂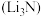 是一种优良的贮氢材料,遇水剧烈反应,在加热的条件下锂和与氮气反应生成氮化锂。某化学实验小组设计了如图实验装置制备氮化锂(部分夹持装置省略)并测定其纯度。回答下列问题:
是一种优良的贮氢材料,遇水剧烈反应,在加热的条件下锂和与氮气反应生成氮化锂。某化学实验小组设计了如图实验装置制备氮化锂(部分夹持装置省略)并测定其纯度。回答下列问题:
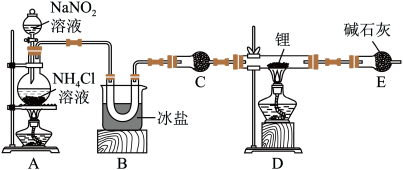
已知:
i.实验室可用饱和 溶液与
溶液与 溶液加热后反应制取
溶液加热后反应制取 ,该反应为放热反应;
,该反应为放热反应;
ii.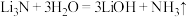
(1)氮化锂的制备:
①连接好装置开始实验前必须进行的操作是___________ 。
②盛装 溶液的仪器名称为
溶液的仪器名称为___________ ;装置A中反生的离子方程式为___________ 。
③实验开始先点燃A处酒精灯,这样做的目的是___________ 。
④经查阅资料得知,装置A处不需要持续加热,分析可能原因___________ ;装置E的作用是___________ 。
(2)氮化锂纯度的测定:
①取 产品于蒸馏烧瓶中,打开止水夹,通过安全漏斗向蒸馏烧瓶中加入足量的水,装置如下图所示。G中的液体可选择
产品于蒸馏烧瓶中,打开止水夹,通过安全漏斗向蒸馏烧瓶中加入足量的水,装置如下图所示。G中的液体可选择___________ (填标号)。
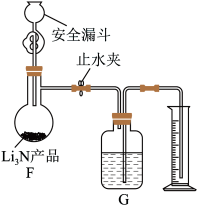
A.煤油 B.蒸馏水 C.四氯化碳 D.饱和食盐水
②当反应完全后,测得 体积为
体积为 (已折合成标准状况)。该
(已折合成标准状况)。该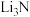 产品的纯度为
产品的纯度为_______ %。(结果精确到小数点后两位)
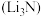 是一种优良的贮氢材料,遇水剧烈反应,在加热的条件下锂和与氮气反应生成氮化锂。某化学实验小组设计了如图实验装置制备氮化锂(部分夹持装置省略)并测定其纯度。回答下列问题:
是一种优良的贮氢材料,遇水剧烈反应,在加热的条件下锂和与氮气反应生成氮化锂。某化学实验小组设计了如图实验装置制备氮化锂(部分夹持装置省略)并测定其纯度。回答下列问题:
已知:
i.实验室可用饱和
 溶液与
溶液与 溶液加热后反应制取
溶液加热后反应制取 ,该反应为放热反应;
,该反应为放热反应;ii.
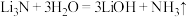
(1)氮化锂的制备:
①连接好装置开始实验前必须进行的操作是
②盛装
 溶液的仪器名称为
溶液的仪器名称为③实验开始先点燃A处酒精灯,这样做的目的是
④经查阅资料得知,装置A处不需要持续加热,分析可能原因
(2)氮化锂纯度的测定:
①取
 产品于蒸馏烧瓶中,打开止水夹,通过安全漏斗向蒸馏烧瓶中加入足量的水,装置如下图所示。G中的液体可选择
产品于蒸馏烧瓶中,打开止水夹,通过安全漏斗向蒸馏烧瓶中加入足量的水,装置如下图所示。G中的液体可选择
A.煤油 B.蒸馏水 C.四氯化碳 D.饱和食盐水
②当反应完全后,测得
 体积为
体积为 (已折合成标准状况)。该
(已折合成标准状况)。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
名校
解题方法
8 . 无机非金属元素在化工生产中扮演着重要的角色,请利用相关知识回答下列问题:
(1)硅单质可作为硅半导体材料,三氯硅烷( )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。
①硅在周期表中的位置是___________ 。
②工业上原料石英砂常用 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为___________ 。
③写出制粗硅的化学方程式___________ 。
④整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是___________ (填名称);在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是___________ 。
⑤用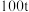 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为___________ t(结果精确到小数点后两位)。
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(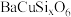 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。
(3)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是___________(填序号)。
(1)硅单质可作为硅半导体材料,三氯硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
 ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。①硅在周期表中的位置是
②工业上原料石英砂常用
 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为③写出制粗硅的化学方程式
④整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是 ,可能引起的后果是
,可能引起的后果是⑤用
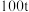 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(
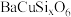 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。A. | B.可用氧化物形式表示为  |
| C.硅酸铜钡易溶于强酸和强碱 | D.唐宋时期,我国的瓷器已享誉海内外 |
| A.压电陶瓷 | B.高温结构陶瓷 | C.生物陶瓷 | D.超导陶瓷 |
您最近一年使用:0次
2023-05-03更新
|
206次组卷
|
2卷引用:甘肃省兰州第一中学2022-2023学年高一下学期4月期中考试化学试题
名校
9 . 实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。

已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;
②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;
③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A中制取氯气的方程式_______ ,其中需使用恒压漏斗的原因是_______ 。
(2)为防止装置C中K2FeO4分解,可以采取的措施是_______ 和_______ 。
(3)①装置C中生成K2FeO4反应的离子方程式为_______ 。
②高铁酸钾作为水处理剂发挥的作用是_______ 。
③在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______ 。
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是_______ 。

(5)验证酸性条件下氧化性FeO >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,_______ 。(可选择的试剂和用品有:浓盐酸、NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO ,而第(5)小题实验表明,Cl2和FeO
,而第(5)小题实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。

已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;
②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;
③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A中制取氯气的方程式
(2)为防止装置C中K2FeO4分解,可以采取的措施是
(3)①装置C中生成K2FeO4反应的离子方程式为
②高铁酸钾作为水处理剂发挥的作用是
③在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
A.H2O B.稀KOH溶液、异丙醇
C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是

(5)验证酸性条件下氧化性FeO
 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO
 ,而第(5)小题实验表明,Cl2和FeO
,而第(5)小题实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
10 . 实验题
(1)全球一半左右的甸是以智力硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取相关反应如下,请配平该反应:_
___NaIO3 + _____NaHSO3 =_____ NaHSO4 + ____Na2SO4 +_____I2+ _____H2O
(2)实验探究-加碘盐中碘元素的检验
①加碘盐中碘元素的存在形式:__ 。
②检验原理:在酸性条件下,IO 与I- 反应的离子方程式
与I- 反应的离子方程式___ ,生成的单质碘用淀粉溶液检验,现象是______ 。
③用试纸和生活中的常见物质检验加碘盐中碘元素存在方案:
a.将食盐水溶解,加入适量___________ ,
b.蘸取少量溶液,滴在___________ 试纸上。
c.实验现象及结论:试纸___________ ,证明有碘元素存在。
(1)全球一半左右的甸是以智力硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取相关反应如下,请配平该反应:
___NaIO3 + _____NaHSO3 =_____ NaHSO4 + ____Na2SO4 +_____I2+ _____H2O
(2)实验探究-加碘盐中碘元素的检验
①加碘盐中碘元素的存在形式:
②检验原理:在酸性条件下,IO
 与I- 反应的离子方程式
与I- 反应的离子方程式③用试纸和生活中的常见物质检验加碘盐中碘元素存在方案:
a.将食盐水溶解,加入适量
b.蘸取少量溶液,滴在
c.实验现象及结论:试纸
您最近一年使用:0次



