名校
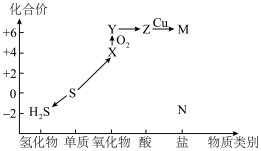
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系: 的电子式为
的电子式为________ ;将 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为________ 。
(2)S粉与热的Z浓溶液反应可转化为________ ,反应的化学方程式为________ 。
(3)配平下列反应:_____
____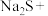 ____
____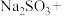 ____
____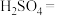 ____
____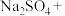 ____
____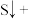 ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。________ 。
②C的作用是________ ,装置D中试管口放置的棉花应浸有一种液体,这种液体是________ 。
 的电子式为
的电子式为 与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为
与X混合,可生成黄色固体,该反应氧化产物与还原产物的质量之比为(2)S粉与热的Z浓溶液反应可转化为
(3)配平下列反应:
____
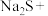 ____
____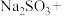 ____
____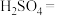 ____
____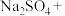 ____
____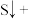 ____
____
(4)下列有关硫及其化合物的性质,说法正确的是
| A.X能使溴水褪色,证明X有漂白性 | B.将X通入 溶液中有白色沉淀生成 溶液中有白色沉淀生成 |
C.硫在过量的 中燃烧可以生成Y 中燃烧可以生成Y | D.若N为钠盐,则N与Z的稀溶液反应可生成 |
(5)某同学为探究Cu与浓硫酸的反应,用如图所示的装置进行有关实验。

②C的作用是
您最近一年使用:0次
解题方法
2 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(主要是 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
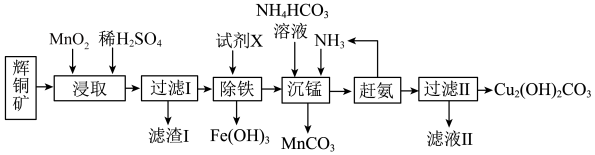
(1)Cu位于元素周期表第______ 周期第______ 族。
(2)滤渣Ⅰ经 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于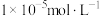 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用______ (写化学式),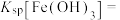
______ 。
(4)实验室检验碱式碳酸铜是否洗净的操作为______ 。
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
请根据原子结构分析Cu的第二电离能比Zn的第二电离能大的原因:______ 。
 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
(1)Cu位于元素周期表第
(2)滤渣Ⅰ经
 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于
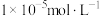 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用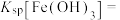
(4)实验室检验碱式碳酸铜是否洗净的操作为
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
元素 | 第一电离能/( | 第二电离能/( |
Cu | 746 | 1958 |
Zn | 906.4 | 1733 |
您最近一年使用:0次
2024-03-11更新
|
185次组卷
|
2卷引用:甘肃省天水市麦积区2024届高三下学期2月第二次模拟检测化学试题
3 . NaHSO3是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有着广泛的应用。为探究NaHSO3溶液的性质,甲同学配制了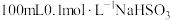 溶液。做了如下实验:
溶液。做了如下实验:
(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、_____ 、_____ 。
(2)常温下,用pH计测量新配制的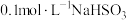 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。
①若在实验室用pH试纸测量溶液的pH,其简单操作为_____ 。
②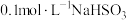 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2_____ (填“>”、“<”或“=”) 的第二步水解常数
的第二步水解常数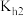 。
。
(3)将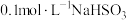 溶液与
溶液与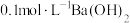 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:_____ 。
探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c._____
验证猜想:
乙同学认为猜想b不正确,原因为_____
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若_____ ,证明猜想c正确。
(4)将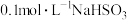 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:_____ 。该现象说明NaHSO3溶液具有_____ (填“氧化性”、“还原性”或“氧化性和还原性”)。
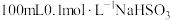 溶液。做了如下实验:
溶液。做了如下实验:(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、
(2)常温下,用pH计测量新配制的
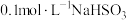 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。①若在实验室用pH试纸测量溶液的pH,其简单操作为
②
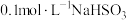 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2 的第二步水解常数
的第二步水解常数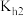 。
。(3)将
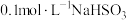 溶液与
溶液与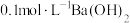 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c.
验证猜想:
乙同学认为猜想b不正确,原因为
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若
(4)将
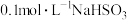 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
您最近一年使用:0次
2023-10-02更新
|
95次组卷
|
2卷引用:广东省东莞市部分名校高三上(9月联考)-化学试题
解题方法
4 . 亚硝酸钠是一种工业盐,外观与食盐非常相似,但毒性较强,食品中添加亚硝酸钠必须严格控制用量。NaNO2既有氧化性又有还原性,回答下列问题:
(1)将等物质的量的一氧化氮和二氧化氮通入氢氧化钠溶液中即可制得NaNO2,反应的化学方程式为_______ 。
(2)现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应生成气体的成分。已知:NO2和 NO的沸点分别是21℃和-152℃。

①盛装70%硫酸的仪器名称是_______ ,如图组装好实验仪器,在加入药品前应先_______ 。
②打开弹簧夹K1,关闭K2,通入N2一段时间后,关闭K1。打开分液漏斗活塞,滴入70%硫酸,A中产生红棕色气体,确认产生的气体中还有NO的依据是_______ 。
③反应结束后还需要继续通入N2的目的是_______ 。
(3)人体正常的血红蛋白含有Fe2+,若误食NaNO2,则导致血红蛋白中的Fe(Ⅱ)转化为Fe(Ⅲ),形成高铁血红蛋白而中毒。为证明酸性条件下NaNO2具有氧化性,实验操作为_______ (可选用的试剂;1mol/L稀硫酸、1 mol/L稀硝酸、淀粉碘化钾试纸、0.1mol/L高锰酸钾溶液等)。
(4)称取m g NaNO2试样于锥形瓶中,加入适量水溶解,c mol/L的酸性KMnO4溶液进行滴定,当锥形瓶中的溶液变为浅红色,且半分钟内不褪色即为滴定终点。重复上述操作2次,滴定至终点时平均消耗V mL标准溶液。滴定过程中发生反应的离子方程式为_______ ,产品的纯度为_______ (用含c、m、V的代数式表示)。
(1)将等物质的量的一氧化氮和二氧化氮通入氢氧化钠溶液中即可制得NaNO2,反应的化学方程式为
(2)现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应生成气体的成分。已知:NO2和 NO的沸点分别是21℃和-152℃。

①盛装70%硫酸的仪器名称是
②打开弹簧夹K1,关闭K2,通入N2一段时间后,关闭K1。打开分液漏斗活塞,滴入70%硫酸,A中产生红棕色气体,确认产生的气体中还有NO的依据是
③反应结束后还需要继续通入N2的目的是
(3)人体正常的血红蛋白含有Fe2+,若误食NaNO2,则导致血红蛋白中的Fe(Ⅱ)转化为Fe(Ⅲ),形成高铁血红蛋白而中毒。为证明酸性条件下NaNO2具有氧化性,实验操作为
(4)称取m g NaNO2试样于锥形瓶中,加入适量水溶解,c mol/L的酸性KMnO4溶液进行滴定,当锥形瓶中的溶液变为浅红色,且半分钟内不褪色即为滴定终点。重复上述操作2次,滴定至终点时平均消耗V mL标准溶液。滴定过程中发生反应的离子方程式为
您最近一年使用:0次
2022-07-26更新
|
809次组卷
|
4卷引用:甘肃省天水市甘谷县2023-2024学年高三上学期第一次检测化学试题
甘肃省天水市甘谷县2023-2024学年高三上学期第一次检测化学试题云南省保山市2021-2022学年高三第一次教学质量监测理科综合化学试题(已下线)专题讲座(九) 化学实验中规范答题(练)-2023年高考化学一轮复习讲练测(全国通用)云南省保山市2022届高三上学期第一次教学质量监测理综化学试题
名校
5 . 我国拥有很长的海岸线,海洋资源的开发利用具有广阔前景。
I.海水的淡化多用蒸馏法,蒸馏法的优点是设备简单、操作简便、淡水质量好,但也有明显缺陷。
(1)海水淡化的方法还有_______ 、_______ 。
II.空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如图。
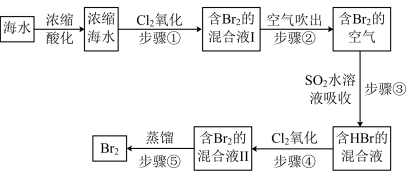
(2)步骤①中获得 的离子方程式为
的离子方程式为_______ 。
(3)步骤②用空气将溴吹出,是因为溴单质_______(填序号)
(4)步骤③中反应的化学方程式为_______ 。
(5)根据上述反应可判断 、
、 、
、 三种物质氧化性由强到弱的顺序
三种物质氧化性由强到弱的顺序_______ 。
III.海带灰中富含以I-形式存在的碘元素。实验室提取 的流程如图所示。
的流程如图所示。
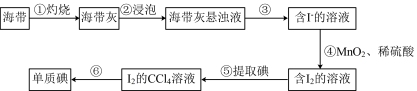
(6)步骤③的实验操作名称为_______ 。
(7)步骤④中反应的离子方程式为_______ 。
(8)检验步骤⑤提取碘后的水溶液中是否含有单质碘,可用的试剂为_______ 。
I.海水的淡化多用蒸馏法,蒸馏法的优点是设备简单、操作简便、淡水质量好,但也有明显缺陷。
(1)海水淡化的方法还有
II.空气吹出法是用于工业规模海水提溴的常用方法。其工艺流程如图。

(2)步骤①中获得
 的离子方程式为
的离子方程式为(3)步骤②用空气将溴吹出,是因为溴单质_______(填序号)
| A.化学性质稳定 | B.沸点低,易挥发 | C.不溶于水 | D.易升华 |
(5)根据上述反应可判断
 、
、 、
、 三种物质氧化性由强到弱的顺序
三种物质氧化性由强到弱的顺序III.海带灰中富含以I-形式存在的碘元素。实验室提取
 的流程如图所示。
的流程如图所示。
(6)步骤③的实验操作名称为
(7)步骤④中反应的离子方程式为
(8)检验步骤⑤提取碘后的水溶液中是否含有单质碘,可用的试剂为
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.(化学与生活)2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和___________ (填化学式)。
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的___________ (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是___________ (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为___________ (请写出其总反应方程式)。
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1___________ T2(填“>”“<”或“=”)。

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为___________ 。
②该反应的平衡常数K的值为___________ 。(结果保留小数点后两位)
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是___________ mol/L。
(1)汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为CO2和
(2)明矾可用作废水处理的混凝剂,Al3+水解生成的
(3)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是
Ⅱ.(化学反应原理)
(4)对反应N2O4(g)⇌2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。T1

(5)在100℃时,将0.400mol的NO2气体充入2L真空定容密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为
②该反应的平衡常数K的值为
③若在相同情况下最初向该容器充入的是N2O4,要达到上述同样的平衡状态,N2O4的起始浓度是
您最近一年使用:0次
名校
解题方法
7 . 氧化剂和还原剂在生产生活中广泛使用。
(1)KMnO4和HBr溶液可以发生如下反应:2KMnO4+16HBr=2KBr+2MnBr2+8H2O+5Br2
①其中还原剂和氧化剂的物质的量之比为_________
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为_________ ,转移电子数目_______ 。
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为______________ ,但Fe2+在酸性条件下很容易被空气中的O2氧化,写出该反应的离子方程式_________________
(3)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,可与足量的NaOH完全中和生成NaH2PO2,NaH2PO2溶液可使酚酞试液变红,回答下列问题:
①H3PO2中,磷元素的化合价为______ ②写出H3PO2电离方程式__________________________
③H3PO2及NaH2PO2均可将溶液中的Ag+还原为金属银,从而用于化学镀银。利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,写出该反应的离子方程式_________
(1)KMnO4和HBr溶液可以发生如下反应:2KMnO4+16HBr=2KBr+2MnBr2+8H2O+5Br2
①其中还原剂和氧化剂的物质的量之比为
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为
(2)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(3)次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,可与足量的NaOH完全中和生成NaH2PO2,NaH2PO2溶液可使酚酞试液变红,回答下列问题:
①H3PO2中,磷元素的化合价为
③H3PO2及NaH2PO2均可将溶液中的Ag+还原为金属银,从而用于化学镀银。利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,写出该反应的离子方程式
您最近一年使用:0次
2020-10-13更新
|
151次组卷
|
2卷引用:甘肃省天水市第一中学2021届高三上学期第一学段考试化学试题
名校
解题方法
8 . 以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4⋅2H2O)

已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:_________ 、________ (填写2条)。
(2)“除锰”反应后,溶液的pH__________ (填“增大”“减小”或“不变”)。
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=________________ 。
(4)“除铜”反应的离子方程式为________ 。
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是__________ 。
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为____ 、___________ 。


已知:常温下Ksp[Fe(OH)3]=2.6×10-39, Ksp[Cu(OH)2]=2.2×10-20。
请问答下列问题:
(1)为了提高“酸浸”时锌元素的浸出率,可以采取的措施有:
(2)“除锰”反应后,溶液的pH
(3)常温下“除铁”反应中,加入ZnCO3可调节溶液的pH,使得Fe3+和部分Cu2+被除去,当两种沉淀共存且溶液的pH=8时,c(Cu2+)/ c( Fe3+)=
(4)“除铜”反应的离子方程式为
(5)若“沉淀”过程中采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,应该在搅拌下,将Na2C2O4溶液缓慢加入ZnCl2溶液中,如果顺序颠倒,会产生的不良后果是
(6)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率(剩余固体的质量/原始固体的质量×100%)随温度的变化如图所示,则A、B点固体的化学式分别为

您最近一年使用:0次
2020-05-05更新
|
198次组卷
|
3卷引用:甘肃省天水市第一中学2020届高三下学期诊断考试化学试题
名校
解题方法
9 . 次磷酸钠(NaH2PO2)是有机合成的常用还原剂,一般制备方法是将黄磷(P4)和过量烧碱溶液混合、加热,生成次磷酸钠和PH3,PH3是一种无色、有毒且能自燃的气体。实验装置如图所示:

回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开K1,通入N2一段时间,关闭K1,打开磁力加热搅拌器,滴加烧碱溶液。
①仪器a的名称是______ ,已知NaH2PO2能与盐酸反应但不能与NaOH溶液反应,则次磷酸(H3PO2)是_______ 元弱酸。
②反应开始时,首先打开K1,通入N2一段时间,其目的是________ 。
③为了尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是_________ ,a中反应的化学方程式为_______ 。
(2)装置c中生成NaH2PO2和NaCl,相关物质溶解度(S)如下,通过______ 的方法可分离出NaH2PO2固体。
(3)产品纯度测定:
取产品m g配成250mL溶液,取25mL于锥形瓶中,然后用0.01 mol/L KMnO4标准溶液滴定至终点(氧化产物是PO43-),达到滴定终点时消耗V1 mL KMnO4标准溶液,产品纯度为________ 。

回答下列问题:
(1)在a中加入黄磷、活性炭粉末,打开K1,通入N2一段时间,关闭K1,打开磁力加热搅拌器,滴加烧碱溶液。
①仪器a的名称是
②反应开始时,首先打开K1,通入N2一段时间,其目的是
③为了尽可能避免PH3造成的空气污染,拆卸装置前还要进行的一项操作是
(2)装置c中生成NaH2PO2和NaCl,相关物质溶解度(S)如下,通过
 |  | |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
取产品m g配成250mL溶液,取25mL于锥形瓶中,然后用0.01 mol/L KMnO4标准溶液滴定至终点(氧化产物是PO43-),达到滴定终点时消耗V1 mL KMnO4标准溶液,产品纯度为
您最近一年使用:0次
名校
10 . 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+ = □Fe(OH)3↓+□Cl-+ 。_________
(2)检验滤液B中是否还含有Fe2+的方法为:__________ 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为______ (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、_________ (填操作名称)、过滤、洗涤。
(5)滤渣的主要成分是____________ (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为____ (填代号),该反应的化学方程式是 ________________________ 。
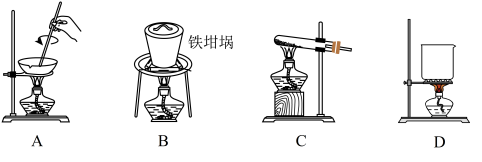

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+ = □Fe(OH)3↓+□Cl-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为:
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
(5)滤渣的主要成分是

您最近一年使用:0次
2019-10-09更新
|
457次组卷
|
3卷引用:甘肃省甘谷第一中学2020届高三上学期第二次检测考试化学试题

 )
)

