名校
解题方法
1 . 以高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2和硫酸盐)为原料制备聚合硫酸铁[Fe2(OH)x(SO4)y]n和明矾的部分工艺流程如下:
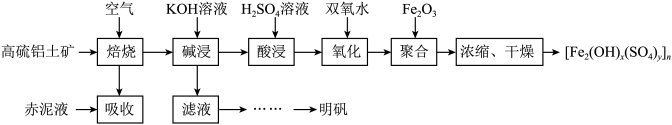
已知:赤泥液的主要成分为Na2CO3.下列说法错误的是

已知:赤泥液的主要成分为Na2CO3.下列说法错误的是
| A.赤泥液的作用是吸收“焙烧”阶段中产生的SO2 |
| B.从“滤液”到“明矾”的过程中还应有“除硅”步骤 |
| C.聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关 |
| D.在“聚合”阶段,若增加Fe2O3用量,会使[Fe2(OH)x(SO4)y]n中x变大 |
您最近一年使用:0次
2023-08-28更新
|
315次组卷
|
7卷引用:江西省五市九校2022-2023学年高三上学期第一次联考化学试题
解题方法
2 . 为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是
| A.NaHCO3溶液(Na2CO3),通入过量的CO2气体 |
| B.SiO2(Al2O3),加入过量的稀盐酸,过滤 |
| C.FeCl3溶液(AlCl3),加入足量的氨水,过滤 |
| D.CO2(SO2),将混合气体通入饱和NaHCO3溶液 |
您最近一年使用:0次
名校
解题方法
3 . SAH(NaAIH4)还原性非常强。纯的四氢铝钠是白色晶状固体,在干燥空气中相对稳定,遇水发生剧烈反应。以铝合金废边脚料为原料(含有少量Al2O3、Fe2O3、MgO、PbO和SiO2等杂质)制备四氢铝钠的流程如下:

请回答下列问题:
(1)试剂A中溶质的阴、阳离子所含电子数相等,其化学式为_______
(2)滤渣1的成分为_______
(3)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图甲所示。当硫酸浓度大于C0mol·L-1时,浸出率降低的原因可能是_______

(4)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式_______
(5)NaAlH4与水反应的化学方程式为_______
(6)测定NaAIH4粗产品的纯度。称取m g NaAlH4粗产品按如图乙所示装置进行实验,测定产品的纯度。

①已知实验前C管读数为V1mL,向A中加入适量蒸馏水使NaAlH4完全反应,当A中反应完全后,冷却至室温后C管读数为V2 mL(均折合成标准状况)。则该产品的纯度为_______ (用含m、V1和V2的代数式表示,忽略加入蒸馏水的体积)。
②若实验前读数时B中液面和C管液面相平,实验后读数时B中液面高于C管,则测得的结果_______ (填“偏高”“偏低”或“无影响”)。

请回答下列问题:
(1)试剂A中溶质的阴、阳离子所含电子数相等,其化学式为
(2)滤渣1的成分为
(3)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图甲所示。当硫酸浓度大于C0mol·L-1时,浸出率降低的原因可能是

(4)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式
(5)NaAlH4与水反应的化学方程式为
(6)测定NaAIH4粗产品的纯度。称取m g NaAlH4粗产品按如图乙所示装置进行实验,测定产品的纯度。

①已知实验前C管读数为V1mL,向A中加入适量蒸馏水使NaAlH4完全反应,当A中反应完全后,冷却至室温后C管读数为V2 mL(均折合成标准状况)。则该产品的纯度为
②若实验前读数时B中液面和C管液面相平,实验后读数时B中液面高于C管,则测得的结果
您最近一年使用:0次
名校
解题方法
4 . 以粉煤灰(主要成分为Al2O3、SiO2、含少量Fe2O3)为原料,制取Al2O3部分工艺流程如下:
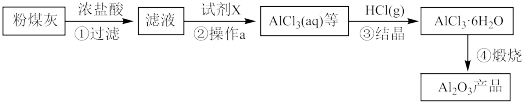
已知25℃时:Ksp[Al(OH)3]=1×10−33,Ksp[Fe(OH)3]=1×10−38,当离子浓度低于10−5 mol·L−1时认为沉淀完全。
(1)粉煤灰加入到NaOH溶液中,反应后所得溶液中溶质有过量的NaOH、_______ (填化学式)。
(2)“操作a”的名称是_______ 。
(3)为达步骤②的目的,控制pH的最小值是_______ 。
(4)步骤③“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因是_______ 。
(5)上述流程可循环利用的物质是_______ 。(填化学式)。
(6)工业上通过产品Al2O3制取铝单质的化学方程式是_______ 。
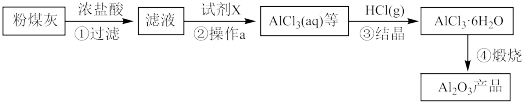
已知25℃时:Ksp[Al(OH)3]=1×10−33,Ksp[Fe(OH)3]=1×10−38,当离子浓度低于10−5 mol·L−1时认为沉淀完全。
(1)粉煤灰加入到NaOH溶液中,反应后所得溶液中溶质有过量的NaOH、
(2)“操作a”的名称是
(3)为达步骤②的目的,控制pH的最小值是
(4)步骤③“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因是
(5)上述流程可循环利用的物质是
(6)工业上通过产品Al2O3制取铝单质的化学方程式是
您最近一年使用:0次
2022-11-10更新
|
152次组卷
|
4卷引用:江西稳派2022-2023学年高三上学期期中联考化学试题
名校
解题方法
5 . 工业上用铝土矿(主要成分Al2O3,含SiO2、Fe2O3等杂质)冶炼铝的主要流程如下:
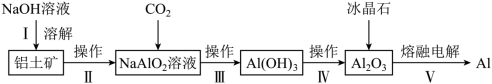
(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是

(注:SiO2碱溶时转变为铝硅酸钠沉淀)
下列叙述错误的是
| A.操作I增大NaOH溶液用量可提高Al2O3的浸取率 |
| B.操作II、III均需用到分液漏斗,操作IV需用到蒸发皿 |
C.通入过量CO2的离子方程式为 |
| D.加入的冰晶石目的是降低Al2O3的熔融温度 |
您最近一年使用:0次
6 . 利用铝灰(主要成分为 ,含少量杂质
,含少量杂质 )制备超细
)制备超细 ,的实验流程如下:
,的实验流程如下:

回答下列问题:
(1)铝灰中氧化铝与硫酸反应的化学方程式为___________ 。
(2)图中“滤渣”的主要成分为___________ (填化学式)。
(3)“氧化”时反应离子反应方程式为___________ 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为
将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是___________ (填化学式)。
②足量饱和 溶液吸收的物质除大部分
溶液吸收的物质除大部分 外还有
外还有___________ (填化学式)。
③ 溶液褪色反应的离子反应方程式为
溶液褪色反应的离子反应方程式为___________ ( 被还原为
被还原为 )。
)。
 ,含少量杂质
,含少量杂质 )制备超细
)制备超细 ,的实验流程如下:
,的实验流程如下:
回答下列问题:
(1)铝灰中氧化铝与硫酸反应的化学方程式为
(2)图中“滤渣”的主要成分为
(3)“氧化”时反应离子反应方程式为
(4)煅烧硫酸铝铵晶体,发生的主要反应为

将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是
②足量饱和
 溶液吸收的物质除大部分
溶液吸收的物质除大部分 外还有
外还有③
 溶液褪色反应的离子反应方程式为
溶液褪色反应的离子反应方程式为 被还原为
被还原为 )。
)。
您最近一年使用:0次
2022-10-06更新
|
597次组卷
|
4卷引用:江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷
江西省宜春市丰城市东煌学校2022-2023学年高三上学期期中考试化学试卷山西省2022-2023学年高三上学期9月质量检测化学试题湖南省邵阳市部分校2022-2023学年高三上学期第一次联考化学试题(已下线)回归教材重难点04 “9种”物质的性质及应用-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
名校
7 . 一种以明矾石[主要成分为 ,含少量
,含少量 ]为原料制备铵明矾[
]为原料制备铵明矾[ ]的工艺流程如图所示,下列说法错误的是
]的工艺流程如图所示,下列说法错误的是

 ,含少量
,含少量 ]为原料制备铵明矾[
]为原料制备铵明矾[ ]的工艺流程如图所示,下列说法错误的是
]的工艺流程如图所示,下列说法错误的是
A.“焙烧”生成的 可回收利用作为制取硫酸的原料 可回收利用作为制取硫酸的原料 |
B.明矾石“焙烧”反应中,转移2mol 可生成1mol 可生成1mol |
| C.“酸溶”中使用的硫酸可用盐酸代替 |
D. 为强电解质 为强电解质 |
您最近一年使用:0次
解题方法
8 . 新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
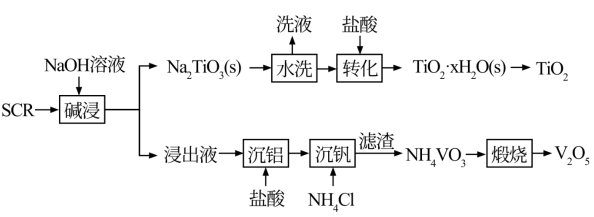
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
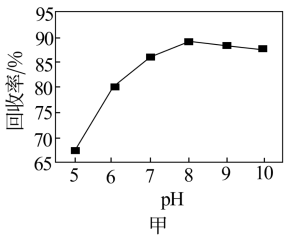
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
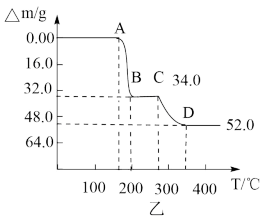
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
名校
解题方法
9 . 某厂废镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
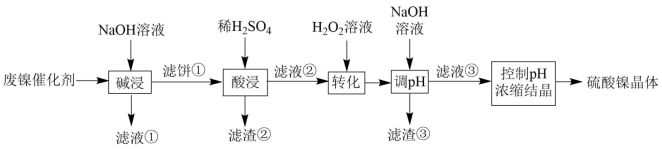
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的作用是:溶解废镍催化剂中的_______ 。为回收该金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式_______ 。
(2)“滤液②”中含有的金属离子是_______ 。
(3)“转化”中可替代H2O2的物质是_______ 。若工艺流程改为先“调pH”后“转化”,即
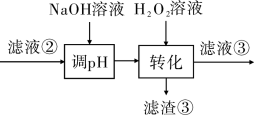
“滤液③”中可能含有的杂质离子为_______ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=_______ 。如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是_______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
(1)“碱浸”中NaOH的作用是:溶解废镍催化剂中的
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代H2O2的物质是

“滤液③”中可能含有的杂质离子为
(4)利用上述表格数据,计算Ni(OH)2的Ksp=
您最近一年使用:0次
2021-03-02更新
|
86次组卷
|
2卷引用:江西省抚州市金溪县第一中学2021-2022学年高二下学期第二次月考化学试题



