名校
1 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料生产Al2O3并获得Fe3O4的工艺流程如下,下列叙述中不正确的是


| A.隔绝空气焙烧时反应炉中FeS2与Fe2O3的最佳质量比为3:64 |
| B.加入CaO的目的是防止焙烧产生的SO2排放到大气中污染环境 |
| C.加入NaOH溶液的目的是通过溶解Al2O3实现铝、铁元素的分离 |
| D.该工艺流程能耗低,原料利用充分,符合绿色化学的思想 |
您最近一年使用:0次
2023-02-17更新
|
328次组卷
|
3卷引用:湖北省当阳市第一高级中学2022-2023学年高三上学期期中考试化学试题
湖北省当阳市第一高级中学2022-2023学年高三上学期期中考试化学试题(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)黑龙江省大庆铁人中学2022-2023学年高一下学期期中考试化学试题
2 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4∙6H2O):

室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH有两个作用:除去_______ 和溶解铝及其氧化物,写出NaOH溶液溶解Al2O3的离子方程式_______ 。
(2)“滤液②”中含有的金属离子除了Na+、Ni2+,还有_______ 。
(3)用离子方程式表示“转化”中H2O2的作用_______ ,若工艺流程改为先“调pH”后“转化”,则“滤液③”中可能含有的杂质离子为_______ 。

(4)利用上述表格数据求算Ni(OH)2的溶度积Ksp=_______ 。
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是_______ 。
(6)煅烧制得的硫酸镍晶体(NiSO4∙6H2O),剩余固体与温度变化曲线如图,该曲线中B段所表示氧化物为_______ (填化学式)。


室温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时 (c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1×10-5mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH有两个作用:除去
(2)“滤液②”中含有的金属离子除了Na+、Ni2+,还有
(3)用离子方程式表示“转化”中H2O2的作用

(4)利用上述表格数据求算Ni(OH)2的溶度积Ksp=
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(6)煅烧制得的硫酸镍晶体(NiSO4∙6H2O),剩余固体与温度变化曲线如图,该曲线中B段所表示氧化物为

您最近一年使用:0次
3 . 工业上用铝土矿(主要成分为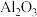 ,还含有杂质
,还含有杂质 和
和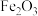 )提取氧化铝并冶炼Al的操作过程如下图,下列说法错误的是
)提取氧化铝并冶炼Al的操作过程如下图,下列说法错误的是

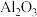 ,还含有杂质
,还含有杂质 和
和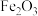 )提取氧化铝并冶炼Al的操作过程如下图,下列说法错误的是
)提取氧化铝并冶炼Al的操作过程如下图,下列说法错误的是
| A.在步骤I增大稀硫酸的浓度有利于铝土矿溶解 |
B.步骤III发生反应的离子方程式为: |
C.生成的滤渣B的化学式为 |
D.滤液C的主要成分的 |
您最近一年使用:0次
名校
解题方法
4 . 某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体( )和胆矾晶体(
)和胆矾晶体( )。
)。

请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为_______ ,涉及到的分离操作是_______ 。
(2)试剂X是_______ ;溶液D是_______ 。
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化_______ 。
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取 并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体减少,可采取的改进措施是
并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体减少,可采取的改进措施是_______ 。
(5)从 溶液中获得胆矾的操作是
溶液中获得胆矾的操作是_______ 。
(6)工业上常用溶液E制取净水剂 ,流程如图:
,流程如图:

写出由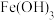 制取
制取 的离子方程式
的离子方程式_______ 。
 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体( )和胆矾晶体(
)和胆矾晶体( )。
)。
请回答:
(1)步骤Ⅰ中,发生的氧化还原反应的离子方程式为
(2)试剂X是
(3)溶液E在空气中易被氧化,请设计一个简单的实验方案检验溶液E是否被氧化
(4)在步骤Ⅱ时,若用大理石与浓盐酸制取
 并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体减少,可采取的改进措施是
并直接通入溶液A中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体减少,可采取的改进措施是(5)从
 溶液中获得胆矾的操作是
溶液中获得胆矾的操作是(6)工业上常用溶液E制取净水剂
 ,流程如图:
,流程如图:
写出由
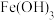 制取
制取 的离子方程式
的离子方程式
您最近一年使用:0次
2022-07-17更新
|
618次组卷
|
2卷引用:湖北省问津联合体2022-2023学年高二上学期10月质量检测化学试题
名校
解题方法
5 . 自然资源的开发是利用化学服务社会的重要努力方向。以铝土矿(主要成分为 ,含少量
,含少量 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下:

(1)“碱溶”时生成偏铝酸钠的离子方程式为_______ ,“滤渣”的成分主要是_______ (填化学式)。
(2)向“过滤I”所得滤液中加入 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为_______ 。
(3)用化学方程式表示“电解I”发生的变化_______ 。
(4)以金红石(主要成分为 为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入
为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入 ,得到
,得到 ,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用
,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用 和
和 ,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式
,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式_______ ,_______ ,稀有气体氛围的作用是_______ 。
 ,含少量
,含少量 和
和 等杂质)为原料制备铝的一种工艺流程如下:
等杂质)为原料制备铝的一种工艺流程如下:
(1)“碱溶”时生成偏铝酸钠的离子方程式为
(2)向“过滤I”所得滤液中加入
 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为(3)用化学方程式表示“电解I”发生的变化
(4)以金红石(主要成分为
 为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入
为原料生产金属钛的步骤主要为:高温下,向金红石和焦炭的混合物中通入 ,得到
,得到 ,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用
,和一种可燃性气体,在稀有气体(如氩)氛围和加热的条件下。用 和
和 ,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式
,反应可得到单质钛。请写出上述生产步骤中发生反应的化学方程式
您最近一年使用:0次
2022-06-30更新
|
260次组卷
|
2卷引用:湖北省武汉市部分重点中学2021-2022学年高一下学期期末联考化学试题
6 . 明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料(主要含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如图:

(1)“酸浸”过程中的应选择____ (写酸的化学式),适当增大酸的浓度、将废料粉碎可提高浸出速率。
(2)操作Ⅰ的名称是___ ,浸渣1的主要成分是____ 。
(3)检验溶液A中是否存在Fe2+的实验操作是____ 。
(4)将炼铝厂废料投入氢氧化钠溶液中生成气体的化学方程式是____ ,在溶液A中加入酸性高锰酸钾发生反应的离子方程式为____ 。
(5)已知:生成氢氧化物沉淀的pH如表所示
调节pH=3的目的是____ 。

(1)“酸浸”过程中的应选择
(2)操作Ⅰ的名称是
(3)检验溶液A中是否存在Fe2+的实验操作是
(4)将炼铝厂废料投入氢氧化钠溶液中生成气体的化学方程式是
(5)已知:生成氢氧化物沉淀的pH如表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
您最近一年使用:0次
7 . 某研究小组以工厂废渣(Fe3O4、Al2O3)为原料制取Fe2O3工艺流程如图。回答下列问题:

(1)“碱浸”时发生的化学反应方程式为___________ 。“酸溶”时发生反应的化学方程式为___________ 。
(2)“操作a”的名称为___________ 。
(3)“氧化”的目的是___________ 。检验氧化不完全可加入的试剂是___________ 。
(4)“沉铁”步骤可观察到现象是___________ ,___________ (填能或否)用氨水代替NaOH溶液。
(5)操作c中所发生的化学反应方程式为___________ 。

(1)“碱浸”时发生的化学反应方程式为
(2)“操作a”的名称为
(3)“氧化”的目的是
(4)“沉铁”步骤可观察到现象是
(5)操作c中所发生的化学反应方程式为
您最近一年使用:0次
解题方法
8 . 铍作为一种新兴材料日益被重视,有“超级金属”之称。工业上常用绿柱石(主要成分为3BeO·Al2O3·6SiO2,还含有铁等杂质)冶炼铍,工艺流程如图所示:
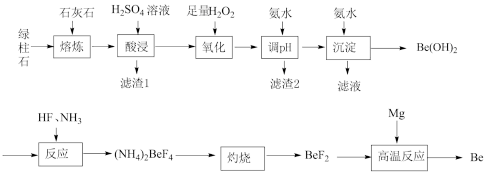
已知:①按元素周期表的对角线规则Be和Al性质相似;
②几种物质沉淀时的pH如下表:
回答下列问题:
(1)“酸浸”时将熔炼后的熔块粉碎的目的是___________ 。
(2)“调pH”得到沉淀的合理pH范围是___________ 。
(3)“沉淀" 反应不宜使用NaOH溶液的原因是(用离子方程式表示)___________ 。
(4)从“反应”后的溶液中得到(NH4)2BeF4固体的实验操作是___________ 、___________ 、过滤、洗涤、干燥。
(5)“ 高温反应”需要在隔绝空气的环境中进行,其原因是___________ 。
(6)3BeO·Al2O3·6SiO2中O、Si、Al元素第一电离能由大到小的顺序为___________ 。绿柱石中Be元素的质量分数为a%,上述过程中 Be的产率为b%。则1 t该绿柱石理论上能生产含铍量1%的镀铜合金___________ t。

已知:①按元素周期表的对角线规则Be和Al性质相似;
②几种物质沉淀时的pH如下表:
| Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Be(OH)2 | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 5.2 |
| 沉淀完全时 | 3.7 | 5.0 | 9.7 | 8.8 |
(1)“酸浸”时将熔炼后的熔块粉碎的目的是
(2)“调pH”得到沉淀的合理pH范围是
(3)“沉淀" 反应不宜使用NaOH溶液的原因是(用离子方程式表示)
(4)从“反应”后的溶液中得到(NH4)2BeF4固体的实验操作是
(5)“ 高温反应”需要在隔绝空气的环境中进行,其原因是
(6)3BeO·Al2O3·6SiO2中O、Si、Al元素第一电离能由大到小的顺序为
您最近一年使用:0次
解题方法
9 . 工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是


| A.按上述流程,试剂X可以是氢氧化钠溶液,也可以是盐酸 |
| B.反应①过滤后所得沉淀为氢氧化铁 |
| C.图中所有的转化反应都不是氧化还原反应 |
D.反应②的离子方程式为AlO +CO2+2H2O=Al(OH)3↓+HCO +CO2+2H2O=Al(OH)3↓+HCO |
您最近一年使用:0次
2022-01-11更新
|
701次组卷
|
2卷引用:湖北省武汉新高考联合体2021-2022学年高一下学期期末考试化学试题
名校
10 . 以高硫铝土矿(主要成分为A12O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图:
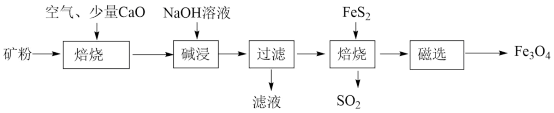
请回答下列问题:
(1)矿粉焙烧时加少量CaO,主要目的是将SiO2转化为_______ (填化学式)。
(2)过滤后的固体焙烧时产生的SO2气体可以用_______ (填标号)吸收;
A.浓硫酸 B.NaOH溶液 C.水
(3)可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色,能否证明产品中含有FeO_______ (填“能”或“否”,)原因是_______ ;
(4)过滤后的滤液中的铝元素主要以_______ (填化学式)离子存在,可以往滤液中通入过量二氧化碳,经过滤、灼烧生产氧化铝。请写出往滤液中通入过量二氧化碳的离子方程式_______ 。

请回答下列问题:
(1)矿粉焙烧时加少量CaO,主要目的是将SiO2转化为
(2)过滤后的固体焙烧时产生的SO2气体可以用
A.浓硫酸 B.NaOH溶液 C.水
(3)可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色,能否证明产品中含有FeO
(4)过滤后的滤液中的铝元素主要以
您最近一年使用:0次
2021-10-27更新
|
271次组卷
|
3卷引用:湖北省襄阳市第一中学2021-2022学年高一下学期3月月考化学试题



