名校
解题方法
1 . 下列由实验现象得出的结论正确的是
A.为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有 |
B.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有 |
C.将铁铜混合物投入 溶液中,当Fe、Cu均有剩余时,溶液中一定有 溶液中,当Fe、Cu均有剩余时,溶液中一定有 、 、 ,无 ,无 |
D.将 试样溶于稀硝酸,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 试样溶于稀硝酸,滴加KSCN溶液,出现血红色,说明检验前该试样已变质 |
您最近一年使用:0次
2023-01-04更新
|
819次组卷
|
5卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
2 . 铁是人们生活中常见的金属。掌握铁及其化合物的性质才能让其更好的为人类服务。
(1)取氯化亚铁固体,配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_______ 。
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入几滴_______ ,溶液变红,该同学认为是Cl2将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______ 。
(3)乙同学取2 mL FeCl2溶液,向其中滴入NaOH溶液,观察到的实验现象是_______ 。
(4)高铁酸钠(Na2FeO4)是一种新型的净水剂,它的氧化性比高锰酸钾、次氯酸等还强。可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;高铁酸钠中,铁元素的化合价是_______ ;上述制取铁酸钠的反应中,铁元素被_______ (填“还原”或“氧化”)。
(5)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为: 。28g铁粉中含有的Fe原子数是
。28g铁粉中含有的Fe原子数是_______ NA,若铁粉完全反应,析出Cu单质的质量为_______ g。
(1)取氯化亚铁固体,配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是
(2)甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入几滴
(3)乙同学取2 mL FeCl2溶液,向其中滴入NaOH溶液,观察到的实验现象是
(4)高铁酸钠(Na2FeO4)是一种新型的净水剂,它的氧化性比高锰酸钾、次氯酸等还强。可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;高铁酸钠中,铁元素的化合价是
(5)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:
 。28g铁粉中含有的Fe原子数是
。28g铁粉中含有的Fe原子数是
您最近一年使用:0次
名校
解题方法
3 . 某实验小组同学探究“氧化剂对KSCN检验Fe2+的影响”,进行如图实验:
(1)向2mL0.5mol/LFeSO4溶液中滴加1滴0.5mol/LKSCN溶液,无明显现象,通入O2,无明显变化。
①该实验的目的是______ 。
②用离子方程式表示I中出现浅红色的原因:______ 、______ 。
(2)对I中溶液呈浅红色的原因,甲同学提出以下假设。
假设1:氯水加入量少,氧化Fe2+生成的Fe3+浓度低。
设计实验i排除了假设1:取Ⅰ中浅红色溶液,操作 a ,观察到溶液浅红色消失。
假设2:氯水氧化性强,氧化了部分SCN-。
(已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为SO )
)
进行实验ii:向2mL水中滴加1滴0.5mol/LKSCN溶液,滴加1滴饱和氯水,加入一定试剂,产生白色沉淀,证明溶液里含有SO 。
。
①操作a为_____ 。
②补全ii中SCN-被Cl2氧化的离子方程式:_____
______SCN-+______Cl2+______=______+2CO2+N2+______SO +______
+______
(3)乙同学认为实验ii的设计不能证明假设2成立,并设计如下实验。分别取上述溶液于试管中,向其中滴加一定浓度的AgNO3溶液至溶液红色褪去,记录消耗AgNO3溶液的体积。实验记录如表:
(已知:上述过程中产生白色沉淀,该沉淀仅为AgSCN。)
①实验ii不能证明假设2成立的原因______ ;
②由IV~VII可以得出的结论是______ 。
| 实验 | 试剂 | 现象 | |
| 试管 | 滴管(各1滴) | ||
 | 2mL0.5mol/LFeSO4溶液与1滴0.5mol/LKSCN溶液 | 饱和氯水 | I.溶液立即变为浅红色 |
| 稀硝酸 | II.溶液立即变为红色 | ||
| 5%H2O2溶液 | III.溶液立即变为深红色,无气体产生 | ||
(1)向2mL0.5mol/LFeSO4溶液中滴加1滴0.5mol/LKSCN溶液,无明显现象,通入O2,无明显变化。
①该实验的目的是
②用离子方程式表示I中出现浅红色的原因:
(2)对I中溶液呈浅红色的原因,甲同学提出以下假设。
假设1:氯水加入量少,氧化Fe2+生成的Fe3+浓度低。
设计实验i排除了假设1:取Ⅰ中浅红色溶液,
假设2:氯水氧化性强,氧化了部分SCN-。
(已知:Ba2+与SCN-可在溶液中大量共存;SCN-易被氧化为SO
 )
)进行实验ii:向2mL水中滴加1滴0.5mol/LKSCN溶液,滴加1滴饱和氯水,加入一定试剂,产生白色沉淀,证明溶液里含有SO
 。
。①操作a为
②补全ii中SCN-被Cl2氧化的离子方程式:
______SCN-+______Cl2+______=______+2CO2+N2+______SO
 +______
+______(3)乙同学认为实验ii的设计不能证明假设2成立,并设计如下实验。分别取上述溶液于试管中,向其中滴加一定浓度的AgNO3溶液至溶液红色褪去,记录消耗AgNO3溶液的体积。实验记录如表:
| 实验 | 试管 | 消耗AgNO3溶液的体积(mL) |
| IV | 2mL水与1滴Fe2(SO4)3溶液和1滴0.5mol/LKSCN溶液 | 2.40 |
| V | 实验Ⅰ中溶液 | 1.52 |
| VI | 实验Ⅱ中溶液 | 1.60 |
| VII | 实验Ⅲ中溶液 | 1.84 |
(已知:上述过程中产生白色沉淀,该沉淀仅为AgSCN。)
①实验ii不能证明假设2成立的原因
②由IV~VII可以得出的结论是
您最近一年使用:0次
名校
解题方法
4 . 某无色溶液中存在大量的Ba2+、OH-、I-,则该溶液中还可能大量存在的离子是
A. | B. | C. | D. |
您最近一年使用:0次
2023-01-04更新
|
201次组卷
|
3卷引用:上海市复旦大学附属中学2021-2022学年高一上学期期末考试化学试题
名校
5 . 电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。为改善环境,废物利用,可从腐蚀废液(主要含FeCl3、FeCl2、CuCl2)中回收铜并使腐蚀液再生。处理流程如图:
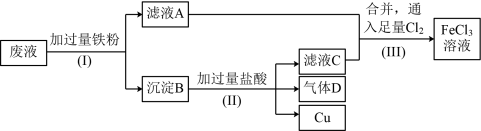
(1)检验废液中是否含有Fe3+所需要的试剂为_____ 。
(2)沉淀B中含有_____ 。
(3)步骤(I)中发生的离子反应方程式有(按反应顺序写出):_____ 。
(4)取少量滤液A于试管中,滴加NaOH溶液,现象是_____ 。
(5)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的。写出H2O2将Fe2+氧化为Fe3+的离子方程式:_____ 。

(1)检验废液中是否含有Fe3+所需要的试剂为
(2)沉淀B中含有
(3)步骤(I)中发生的离子反应方程式有(按反应顺序写出):
(4)取少量滤液A于试管中,滴加NaOH溶液,现象是
(5)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的。写出H2O2将Fe2+氧化为Fe3+的离子方程式:
您最近一年使用:0次
名校
6 . 下列离子方程式正确的是
| A.向CaCl2溶液中通入少量CO2:Ca2++CO2+H2O=CaCO3↓+2H+ |
| B.FeCl3溶液遇到KSCN溶液变为红色:Fe3++3SCN-=Fe(SCN)3↓ |
C.向氢氧化钡溶液中滴加硫酸氢钠溶液至中性:Ba2++2OH-+2H++SO =BaSO4↓+2H2O =BaSO4↓+2H2O |
| D.Cl2与水反应:Cl2+H2O=2H++Cl-+ClO- |
您最近一年使用:0次
2023-01-03更新
|
378次组卷
|
3卷引用:湖北省荆州中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 将 铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为
铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为 ,放出的气体
,放出的气体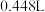 (标准状况)。则下列判断中正确的是
(标准状况)。则下列判断中正确的是
 铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为
铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为 ,放出的气体
,放出的气体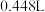 (标准状况)。则下列判断中正确的是
(标准状况)。则下列判断中正确的是A.原混合物中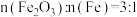 |
B.原混合物中氧化铁的质量为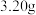 |
C.向所得溶液中滴加 溶液,溶液显红色 溶液,溶液显红色 |
D.向所得溶液中通入 ,可以将 ,可以将 完全转化为 完全转化为 |
您最近一年使用:0次
2023-01-01更新
|
590次组卷
|
6卷引用:辽宁省大连市2022-2023学年高一上学期期末考试化学试题
辽宁省大连市2022-2023学年高一上学期期末考试化学试题山东省枣庄市第八中学南校2022-2023学年高一1月线上测试化学试题(已下线)综合突破01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)河南省信阳市华中师大息县附中2022-2023学年高一下学期开学考试化学试题新疆乌鲁木齐市第八中学2022-2023学年高一下学期第一次质量检测(开学摸底)化学试题江苏省扬州中学2022-2023学年高一下学期4月期中考试化学试题
8 . 某工厂的工业废水中含有大量的 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:

(1)操作Ⅰ和操作Ⅱ的方法是_______ 。
(2)步骤①加入的铁粉应_______ (选填“过量”或“少量”),写出该步骤中发生的所有氧化还原反应的离子方程式_______ 。
(3)固体A的成分是_______ (填名称)。
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为_______ ,该物质在该反应中作_______ 剂(选填“氧化”或“还原”)。
(5)取 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式_______ 。
(6)如何检验所得 中不含有
中不含有
_______ 。
 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:
(1)操作Ⅰ和操作Ⅱ的方法是
(2)步骤①加入的铁粉应
(3)固体A的成分是
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为
(5)取
 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式(6)如何检验所得
 中不含有
中不含有
您最近一年使用:0次
2023-01-01更新
|
187次组卷
|
3卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
名校
解题方法
9 . 在下列各溶液中离子能大量共存的是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
2023-01-01更新
|
191次组卷
|
3卷引用:黑龙江省哈尔滨市2021-2022学年高一上学期期末学业质量检测化学试题
名校
10 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
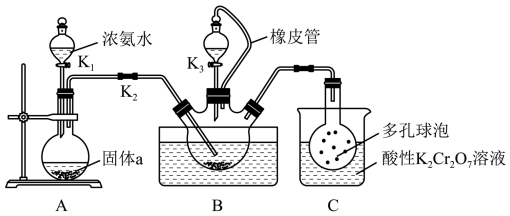
已知: 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
Ⅰ.制备 溶液
溶液
(1)装置A用于制备 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是_______ (填名称)。
(2)三颈烧瓶内盛放有 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且_______ 。
(3)一段时间后,当观察到三颈烧瓶内_______ 时,停止通入气体,反应完成。
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为_______ ;酸性 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是_______ 。
Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。
①滴定时发生的反应: (白色),则指示剂的化学式为
(白色),则指示剂的化学式为_______ (填序号)。则滴定终点的现象是_______ 。
A. B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为_______ (计算结果保留三位有效数字)。

已知:
 是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:Ⅰ.制备
 溶液
溶液(1)装置A用于制备
 ,圆底烧瓶内的固体a是
,圆底烧瓶内的固体a是(2)三颈烧瓶内盛放有
 、水和固体催化剂,发生反应
、水和固体催化剂,发生反应 。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入
。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入 中,其目的是使反应更充分且
中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
Ⅱ.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待
 完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为 溶液除可以吸收
溶液除可以吸收 外,还能吸收的气体是
外,还能吸收的气体是Ⅲ.制备KSCN晶体
先通过过滤除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。
(5)测定晶体中KSCN的含量:称取10.0 g样品,配成1000 mL溶液。量取25.00 mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000 mol/L
 标准溶液滴定,达到滴定终点,三次滴定平均消耗
标准溶液滴定,达到滴定终点,三次滴定平均消耗 标准溶液20.00 mL。
标准溶液20.00 mL。①滴定时发生的反应:
 (白色),则指示剂的化学式为
(白色),则指示剂的化学式为A.
 B.
B. C.
C. D.
D.
②晶体中KSCN的质量分数为
您最近一年使用:0次
2022-12-31更新
|
473次组卷
|
5卷引用:黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题
黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题福建省三明市2022-2023学年高三上学期期末考试化学试题江苏省盐城市北京师范大学盐城附属学校2023届高三上学期期末考试化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(实验探究题)



