名校
1 . 氯化亚铜(CuCl)是石油工业常用的脱硫剂和脱色剂,以低品位铜矿(主要成分为 和铁的氧化物)为原料制备CuCl流程如图。
和铁的氧化物)为原料制备CuCl流程如图。
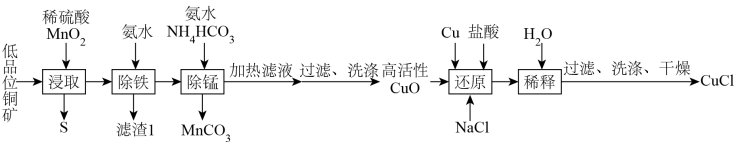
已知:CuCl难溶于醇和水,热水中能被氧化,CuCl易溶于浓度较大的 体系中(
体系中(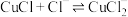 )。
)。
下列说法错误的是
 和铁的氧化物)为原料制备CuCl流程如图。
和铁的氧化物)为原料制备CuCl流程如图。
已知:CuCl难溶于醇和水,热水中能被氧化,CuCl易溶于浓度较大的
 体系中(
体系中(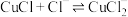 )。
)。下列说法错误的是
| A.“浸取”过程中可用浓硫酸代替稀硫酸 |
B.“除锰”过程中发生离子反应为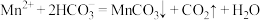 |
C.“还原”后所得产物主要为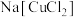 |
| D.产品CuCl可用冷的乙醇洗涤 |
您最近半年使用:0次
2 . 同组的两个反应的离子方程式不相同的是
| A.把少量BaCl2溶液分别滴入NaHSO4和Na2SO4溶液中 |
| B.向澄清石灰水中分别加入Na2CO3溶液和通入少量CO2气体 |
| C.把AgNO3溶液分别滴入盐酸和CaCl2溶液中 |
| D.将碱式碳酸铜[Cu2(OH)2CO3]分别加入稀硫酸和NaHSO4溶液中 |
您最近半年使用:0次
解题方法
3 . 下列装置不能达到相应实验目的的是
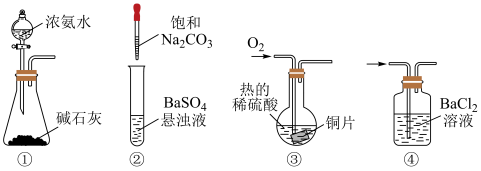

| A.装置①用于制备氨气 |
B.装置②用于验证 可转化为 可转化为 |
C.装置③可用铜制 溶液 溶液 |
D.装置④用于检验 中是否含有 中是否含有 |
您最近半年使用:0次
4 .  是一种常用的杀菌剂和催化剂。工业上制取
是一种常用的杀菌剂和催化剂。工业上制取 的工艺如图所示(制取
的工艺如图所示(制取 时需补加
时需补加 以保持反应在弱酸性条件下进行)。
以保持反应在弱酸性条件下进行)。

已知:溶液A的主要溶质M为酸式盐;化合物C为正盐;当溶液酸性减弱到一定程度时, 部分转化为
部分转化为 沉淀且满足
沉淀且满足 。
。
回答下列问题:
(1)M的化学式为___________ ;“真空蒸发”的原因是___________ 。
(2)溶液 发生反应的离子方程式为
发生反应的离子方程式为___________ ;若 产量不变,参与反应的化合物
产量不变,参与反应的化合物 与
与 物质的量之比减小时,需补加
物质的量之比减小时,需补加 的量
的量___________ (填“增大”、“减小”或“不变”)。
(3)为探究 的还原性,将一定量
的还原性,将一定量 与某浓度的硝酸反应,溶液的体积为
与某浓度的硝酸反应,溶液的体积为 ,溶液中
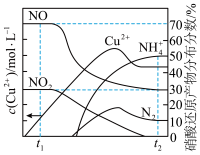
,溶液中 与硝酸还原产物的分布分数随时间的变化如图所示。则
与硝酸还原产物的分布分数随时间的变化如图所示。则 时刻,溶液中发生反应的化学方程式为
时刻,溶液中发生反应的化学方程式为___________ ; 时刻,测得溶液中
时刻,测得溶液中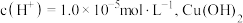 沉淀的质量为
沉淀的质量为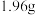 ,则此时溶液中
,则此时溶液中 为
为___________  (忽略溶液体积变化)。
(忽略溶液体积变化)。
 是一种常用的杀菌剂和催化剂。工业上制取
是一种常用的杀菌剂和催化剂。工业上制取 的工艺如图所示(制取
的工艺如图所示(制取 时需补加
时需补加 以保持反应在弱酸性条件下进行)。
以保持反应在弱酸性条件下进行)。
已知:溶液A的主要溶质M为酸式盐;化合物C为正盐;当溶液酸性减弱到一定程度时,
 部分转化为
部分转化为 沉淀且满足
沉淀且满足 。
。回答下列问题:
(1)M的化学式为
(2)溶液
 发生反应的离子方程式为
发生反应的离子方程式为 产量不变,参与反应的化合物
产量不变,参与反应的化合物 与
与 物质的量之比减小时,需补加
物质的量之比减小时,需补加 的量
的量(3)为探究
 的还原性,将一定量
的还原性,将一定量 与某浓度的硝酸反应,溶液的体积为
与某浓度的硝酸反应,溶液的体积为 ,溶液中
,溶液中 与硝酸还原产物的分布分数随时间的变化如图所示。则
与硝酸还原产物的分布分数随时间的变化如图所示。则 时刻,溶液中发生反应的化学方程式为
时刻,溶液中发生反应的化学方程式为 时刻,测得溶液中
时刻,测得溶液中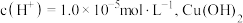 沉淀的质量为
沉淀的质量为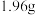 ,则此时溶液中
,则此时溶液中 为
为 (忽略溶液体积变化)。
(忽略溶液体积变化)。
您最近半年使用:0次
名校
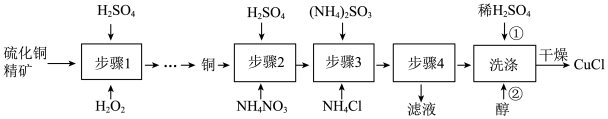
5 . 氯化亚铜(CuCl)广泛应用于冶金工业,也用作催化剂和杀菌剂。以硫化铜精矿为原料生产CuCl的工艺如图:
已知:CuCl难溶于醇和水,溶于 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。
(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是___________ 。
(2)步骤4进行的实验操作是___________ 。
(3)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是___________ 。用乙醇洗涤的目的是___________ 。
(4)产品纯度测定:称取CuCl产品ag于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000mol/LKMnO4标准溶液滴定Fe2+,消耗KMnO4溶液bmL(本实验中 的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
①CuCl溶于Fe2(SO4)3溶液的离子方程式是___________ 。
②产品中CuCl的质量分数为___________ (列计算式即可)。

已知:CuCl难溶于醇和水,溶于
 较大的体系
较大的体系 ,潮湿空气中易水解氧化。
,潮湿空气中易水解氧化。(1)步骤1是“氧化酸浸”的过程,该过程生成蓝色溶液和浅黄色沉淀,化学方程式是
(2)步骤4进行的实验操作是
(3)洗涤过程中不能用硝酸代替硫酸进行“酸洗”,理由是
(4)产品纯度测定:称取CuCl产品ag于锥形瓶中,加入足量的酸性Fe2(SO4)3溶液使其充分溶解,然后用0.1000mol/LKMnO4标准溶液滴定Fe2+,消耗KMnO4溶液bmL(本实验中
 的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。
的被还原为Mn2+,不与产品中杂质和Cl﹣反应)。①CuCl溶于Fe2(SO4)3溶液的离子方程式是
②产品中CuCl的质量分数为
您最近半年使用:0次
名校
6 . 氧化亚铜主要用于制造船底防污漆(用来杀死低级海生动物)、杀虫剂,以及各种铜盐、分析试剂、红色玻璃,还用于镀铜及镀铜合金溶液的配制。用某铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下图:
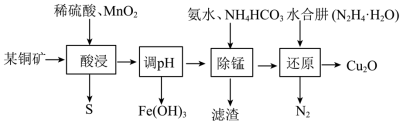
已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
请回答下列问题:
(1)基态Cu原子价层电子的排布图为_______ 。
(2)滤渣的主要成分是_______ (填化学式)。
(3)“酸浸”中加入MnO2的作用是_______ ;写出其中生成单质S的化学方程式_______ 。
(4)“调pH”的范围是_______ 。
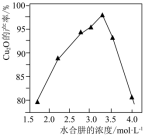
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为_______ ;一定体积下,保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。当水合肼浓度大于3.25mol·L-1时,[Cu(NH3)4]2+的转化率仍增大,但Cu2O的产率下降,其可能的原因是_______ 。

已知:常温下,相关金属离子生成氢氧化物沉淀的pH见表:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 4.8 | 1.9 | 7.5 | 8.8 |
| 沉淀完全的pH | 6.4 | 3.2 | 9.7 | 10.4 |
(1)基态Cu原子价层电子的排布图为
(2)滤渣的主要成分是
(3)“酸浸”中加入MnO2的作用是
(4)“调pH”的范围是
(5)“还原”前Cu元素以[Cu(NH3)4](OH)2的形式存在,水合肼被氧化的化学方程式为

您最近半年使用:0次
名校
解题方法
7 . 某同学利用实验室中几种等浓度(相同体积的溶液里含相同数目的溶质)溶液:
①NaOH溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。
(1)将表格补充完整。a___________ b___________
(2)该同学认为从理论上即可推测①与④不反应,依据是:___________
(3)写出②与④发生反应的离子反应方程式:___________
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,___________ (从操作、现象、结论方面描述)。
①NaOH溶液 ②
 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液,进行以下实验。
溶液,进行以下实验。| 序号 | 操作 | 现象 | 离子方程式 |
| ⅰ | 向盛有2mL①的试管中加入1mL③ | 产生蓝色沉淀 | a |
| ⅱ | 向盛有2mL②的试管中加入1mL④ | b |
(2)该同学认为从理论上即可推测①与④不反应,依据是:
(3)写出②与④发生反应的离子反应方程式:
(4)该同学认为①与②可发生反应但无明显现象,因此选用以上给出的四种溶液设计了简单实验证明了反应确实发生。将该同学的实验方案补充完整:向盛有2mL①的试管中加入1mL②,
您最近半年使用:0次
解题方法
8 . 某化学研究小组,用杂铜(含有较多杂质的铜粉),通过不同的途径制取胆矾,杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物。灼烧后含有少量铜的原因不可能是
| A.灼烧过程中部分氧化铜被有机物还原 |
| B.灼烧不充分铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.灼烧过程中生成了还原性物质将氧化铜还原 |
您最近半年使用:0次
解题方法
9 . 碲元素被誉为现代工业、国防与尖端技术的维生素。一种利用工业铜沉淀渣(主要成分为Cu、Cu2Se、Cu2Te及Ag等)回收粗碲粉和银粉的工艺流程如下:
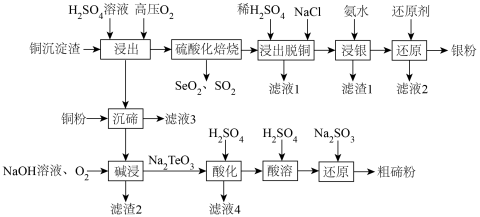
已知:①TeO2是两性氧化物;②“浸出”所得溶液主要成分为H2TeO4和CuSO4。
回答下列问题:
(1)H2TeO4中碲元素化合价为___________ 。
(2)“硫酸化焙烧”时Cu2Se发生反应的化学方程式为___________ 。
(3)“浸出脱铜”过程中补充NaCl固体,结合化学用语,从平衡移动角度解释其作用为_________ 。
(4)“沉碲”过程中所得固体主要成分为Cu2Te,经“碱浸”后,滤渣2的主要成分为Cu(OH)2,“碱浸”过程中发生反应的化学方程式为___________ 。“酸化”操作时控制溶液pH为4.5~5.0以生成TeO2,若硫酸浓度过大,将导致___________ 。
(5)“还原”得到粗碲粉过程中,氧化剂与还原剂的物质的量之比为___________ 。

已知:①TeO2是两性氧化物;②“浸出”所得溶液主要成分为H2TeO4和CuSO4。
回答下列问题:
(1)H2TeO4中碲元素化合价为
(2)“硫酸化焙烧”时Cu2Se发生反应的化学方程式为
(3)“浸出脱铜”过程中补充NaCl固体,结合化学用语,从平衡移动角度解释其作用为
(4)“沉碲”过程中所得固体主要成分为Cu2Te,经“碱浸”后,滤渣2的主要成分为Cu(OH)2,“碱浸”过程中发生反应的化学方程式为
(5)“还原”得到粗碲粉过程中,氧化剂与还原剂的物质的量之比为
您最近半年使用:0次
名校
10 . 下列离子或分子在同一水溶液中能大量共存的是
A. 、 、 、 、 、 、 |
B. 、 、 、 、 、 、 |
C. 、 、 、 、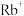 、 、 |
D. 、 、 、 、 、 、 |
您最近半年使用:0次



