1 . 氯化亚铜(CuCl)是一种易水解的白色固体。以低品位铜矿砂(主要成分CuS)为原料制备CuCl的工艺流程如图所示。
(1)“酸溶1”时,CuS作_______ (填“氧化剂”或“还原剂”)。
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为_______ 。将生成的MnCO3分离出来的实验操作为_______ 。
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有_______ (只答一种方法)。
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生_______ 气体。
(5)“洗涤”应先用稀盐酸洗涤,其目的是_______ 。

(1)“酸溶1”时,CuS作
(2)“除锰”时,Cu2+转化为Cu(NH3)4CO3,Mn2+转化为MnCO3沉淀。沉锰的反应化学方程式为
(3)“酸溶2”投料后,以一定的速率搅拌反应,可提高铜浸出率的措施有
(4)合成步骤加入Na2SO3的速率不宜过快,否则会产生
(5)“洗涤”应先用稀盐酸洗涤,其目的是
您最近半年使用:0次
名校
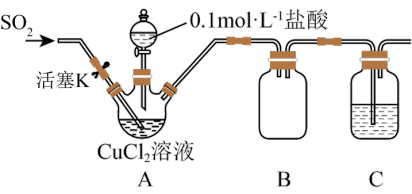
2 . 氯化亚铜(CuCl)是一种重要的化工原料,化学小组用如图装置(部分夹持装置略去)制备CuCl。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是_______ ,置C中的试剂为_______ 。
(2)步骤I中通入SO2发生反应的离子方程式是_______ 。
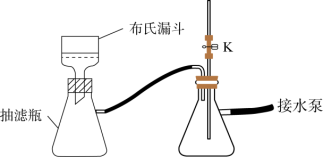
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:_____ ;抽滤采用下图装置。滤完毕需进行下列操作,从实验安全角度考虑,你认为最合理的第一步操作为_______ (填标号)。
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl- CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液__________ (填操作),若观察到有白色沉淀析出,证明猜想一正确。
猜想二:________ 。设计验证猜想二是否成立的实验方案:________ 。
②在酸性条件下,某些中间价态的离子能发生自身氧化还原反应。
实验步骤:
I.打开分液漏斗活塞,向三颈瓶中加盐酸调pH至2~3,打开活塞K,通入SO2,溶液中产生白色沉淀,待反应完全后,再通一段时间气体。
Ⅱ.将反应混合液过滤、洗涤、干燥得CuCl粗产品,纯化后得CuCl产品。
回答下列问题:
(1)装置B的作用是
(2)步骤I中通入SO2发生反应的离子方程式是
(3)步骤Ⅱ中采用抽滤法过滤的主要目的是:
(4)某小组同学发现,将分液漏斗中的0.1 mol·L-1盐酸换为6 mol·L-1盐酸,通入SO2,最终未得到白色沉淀。对此现象有如下猜想:
猜想一:Cl-浓度过大,与CuCl发生反应查阅资料知: CuCl+Cl-
 CuCl
CuCl ,据此设计实验:将上述未得到沉淀的溶液
,据此设计实验:将上述未得到沉淀的溶液猜想二:
您最近半年使用:0次
解题方法
3 . 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
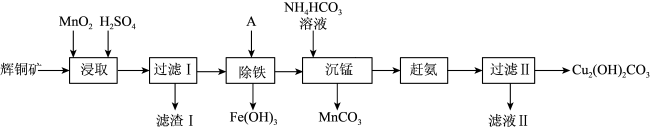
(1)下列措施能加快浸取速率的是___________ 。(填字母)
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:___________ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(5)滤液Ⅱ所含溶质主要是___________ (填化学式)。

(1)下列措施能加快浸取速率的是
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(5)滤液Ⅱ所含溶质主要是
您最近半年使用:0次
4 . 氯化铜晶体(CuCl2·2H2O)常用作玻璃、陶瓷着色剂和饲料添加剂等。工业上用粗制氧化铜粉(含杂质FeO和SiO2)制备无水氯化铜,制取流程如下:

已知:氯化亚砜( 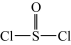 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:
(1)为避免引入杂质,试剂x可选用___________ (填字母)
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~________________ ,从而除去Fe3+而不引入杂质。试剂y可选用下列物质中的___________ (填字母)
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为___________ 。
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是__________________ 。

| Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 6.7 |
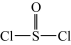 )熔点-101℃,沸点76℃,易水解。回答下列问题:
)熔点-101℃,沸点76℃,易水解。回答下列问题:(1)为避免引入杂质,试剂x可选用
a.KMnO4溶液 b.Cl2水 c.Br2水 d.H2O2溶液
(2)溶液C中加入试剂y可以调节溶液pH,控制pH的取值范围为______~_____
a.Cu b.CuO c.Cu2(OH)2CO3 d.NaOH
(3)SOCl2与水反应的化学方程式为
(4)SOCl2与CuCl2·2H2O混合并加热,可得到无水CuCl2的原因是
您最近半年使用:0次
名校
解题方法
5 . 在下列反应中,HCl作氧化剂的是
| A.NaOH+HCl=NaCl+H2O | B.Zn+2HCl=ZnCl2+H2↑ |
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ | D.CuO+2HCl=CuCl2+H2O |
您最近半年使用:0次
2024-01-08更新
|
37次组卷
|
2卷引用:海南省农垦中学2023-2024学年高一上学期期末考试化学试题(重点班)
解题方法
6 . 以黄铜矿(主要成分是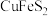 ,含
,含 杂质)为原料制备高纯度铁红和化工产生
杂质)为原料制备高纯度铁红和化工产生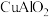 ,流程如下:
,流程如下:
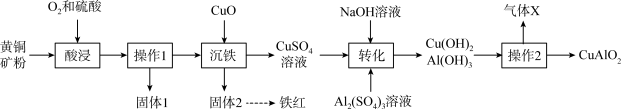
回答下列问题:
(1)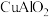 中铜元素的化合价为
中铜元素的化合价为___________ 。“固体1”的主要成分是___________ (填化学式)。
(2)实验室进行操作1需要使用的玻璃仪器有___________ (填名称)。
(3)“酸浸”时 发生反应生成
发生反应生成 、
、 ,离子方程式为
,离子方程式为___________ 。
(4)分离“固体2”时的操作包括过滤、洗涤和干燥,检验洗涤液中不含 的操作是
的操作是___________ 。
(5)“操作2”为高温灼烧,发生反应的化学方程式为___________ 。
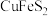 ,含
,含 杂质)为原料制备高纯度铁红和化工产生
杂质)为原料制备高纯度铁红和化工产生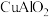 ,流程如下:
,流程如下:
回答下列问题:
(1)
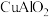 中铜元素的化合价为
中铜元素的化合价为(2)实验室进行操作1需要使用的玻璃仪器有
(3)“酸浸”时
 发生反应生成
发生反应生成 、
、 ,离子方程式为
,离子方程式为(4)分离“固体2”时的操作包括过滤、洗涤和干燥,检验洗涤液中不含
 的操作是
的操作是(5)“操作2”为高温灼烧,发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
7 . 黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下图(杂质不溶于水、不参与反应):
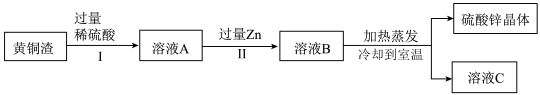
下列说法正确的是

下列说法正确的是
| A.溶液A中的溶质有2种 |
| B.Ⅰ、Ⅱ中的操作均包含过滤 |
| C.溶液A的质量大于溶液B |
| D.溶液C中溶质的质量分数小于溶液B |
您最近半年使用:0次
8 . 在一支试管中加入2 mL CuSO4溶液,再将一段光洁的铁丝插入CuSO4溶液中。有说法错误的是
| A.铁丝表面变红 | B.铁丝作还原剂 |
| C.铜比铁更活泼 | D.古时用此反应炼铜 |
您最近半年使用:0次
名校
9 . 金属单质及其化合物在生产生活中应用非常广泛,废旧金属的回收利用是重要研究课题。某学习小组在实验室中模拟利用含铜废料(主要成分为Cu和CuO,还有少量的Al、Fe及其氧化物)生产胆矾,其实验方案如下:

回答问题:
(1)上述流程中,将废铜料“研磨”的目的是___________ ;
(2)“碱浸”时Al发生反应的化学方程式___________ ;
(3)请写出“酸溶”过程中单质铜发生反应的化学方程式___________ ;
(4)试剂X可以是___________ ;
(5)实验证明,溶液D能将 氧化为
氧化为 。某同学通过实验证实,只能是
。某同学通过实验证实,只能是 将
将 氧化为
氧化为 ,写出该同学的实验方案及结果
,写出该同学的实验方案及结果___________ (不要求写具体操作过程)。

回答问题:
(1)上述流程中,将废铜料“研磨”的目的是
(2)“碱浸”时Al发生反应的化学方程式
(3)请写出“酸溶”过程中单质铜发生反应的化学方程式
(4)试剂X可以是
(5)实验证明,溶液D能将
 氧化为
氧化为 。某同学通过实验证实,只能是
。某同学通过实验证实,只能是 将
将 氧化为
氧化为 ,写出该同学的实验方案及结果
,写出该同学的实验方案及结果
您最近半年使用:0次
名校
10 . 纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,以主要成分为CuFeS2的黄铜矿(含有杂质SiO2)为原料制取纳米Cu2O的一种工艺流程如图所示:

请回答下列问题:
(1)“滤渣1”中含有硫单质及___________ 。
(2)“调pH”的过程中也能用___________ (写出一种物质即可)来代替CuO,要使Fe3+完全沉淀,则溶液的pH至少为___________ (已知该工艺条件下Ksp[Fe(OH)3]≈8×10-38,Kw≈1×10-14,lg2≈0.3,化学上认为当离子浓度小于1×10-5mol·L-1时沉淀完全)。
(3)现代工业也可用铜作电极,电解食盐水制备Cu2O,写出:a.阴极的电极反应式为___________ ;b.制备氧化亚铜的化学方程式为___________ ;c.电解过程中Cl-的浓度___________ 。(填“变小”“变大”“不变”)

请回答下列问题:
(1)“滤渣1”中含有硫单质及
(2)“调pH”的过程中也能用
(3)现代工业也可用铜作电极,电解食盐水制备Cu2O,写出:a.阴极的电极反应式为
您最近半年使用:0次



