1 . 纯碱是一种重要的化工原料,具有广泛的用途。实验室利用氯化钠和碳酸氢铵制备纯碱并测定产品中碳酸氢钠的含量,具体步骤如下:
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
步骤ⅱ.制备纯碱
在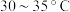 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸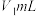 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。
已知:相关物质的溶解度如下
说明:“—”表示该物质在相应温度下已开始分解。
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为________________ ;
(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为________________ ;
(3)步骤ⅱ中,选择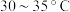 水浴的原因为
水浴的原因为________________ ;
(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为________________ ;
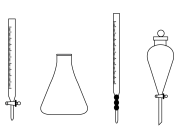
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的________ (填仪器名称);________ ;滴定过程中,盐酸需要逐滴加入并不断振荡的原因为________________ ;选择指示剂N时,滴定终点溶液颜色变化为________________ ;
(7)产品中碳酸氢钠的质量分数为________ (用含字母的代数式表示)。
步骤i.精制氯化钠
取饱和粗盐水并加热,向其中加入饱和
 溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。
溶液调节pH至11,有大量胶状沉淀析出;继续加热至沸,趁热过滤,滤液用盐酸调节pH至7。步骤ⅱ.制备纯碱
在
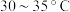 水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。
水浴条件下,向上述滤液中加入碳酸氢铵粉末,搅拌至反应完全;冷却后过滤得到碳酸氢钠晶体;用碳酸氢钠饱和过的酒精水溶液洗涤晶体;加热使其分解得到产品。步骤ⅲ.产品中碳酸氢钠含量的测定
称取a g产品加水溶解,滴加指示剂M,用
 盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸
盐酸逐滴滴定,并不断振荡,到达终点时消耗盐酸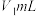 ;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积
;滴加指示剂N,继续用上述盐酸滴定,到达终点时消耗盐酸总体积 。
。已知:相关物质的溶解度如下
温度 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
| 15.8 | 21.0 | 27.0 | — | — | — | — |
| 8.15 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 |
回答下列问题:
(1)步骤ⅰ中,胶状沉淀的成分为
 ,生成该沉淀的离子方程式为
,生成该沉淀的离子方程式为(2)步骤ⅰ中,沉淀析出后需继续加热煮沸一段时间,其目的为
(3)步骤ⅱ中,选择
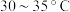 水浴的原因为
水浴的原因为(4)步骤ⅱ中,用碳酸氢钠饱和过的酒精水溶液洗涤晶体可除去的杂质为
(5)步骤ⅲ中,用到的玻璃仪器除胶头滴管外还需要下列仪器中的
(7)产品中碳酸氢钠的质量分数为
您最近一年使用:0次
2 .  和
和 是重要的工业原料。
是重要的工业原料。
(1) 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的________ 空隙。(填“正四面体”或“正八面体”)

(2)铜-氧化物(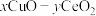 ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。

①反应Ⅰ中Ce的化合价变化为:________ 。(已知反应Ⅰ中Cu、Ce的化合价均发生变化)
②若反应Ⅱ中通入 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有________ 种。
(3)用pH约为7的 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将________ 溶液缓慢滴加到________ 溶液中。(填化学式)
(4)准确称取1.00g 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将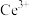 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数_____ (写出计算过程)。
 和
和 是重要的工业原料。
是重要的工业原料。(1)
 晶胞见图-1,其中O原子位于Ce构成的
晶胞见图-1,其中O原子位于Ce构成的
(2)铜-氧化物(
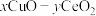 ,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
,其中O均为-2价)可催化氧化除去氢气中少量CO,其反应机理见图-2所示。
①反应Ⅰ中Ce的化合价变化为:
②若反应Ⅱ中通入
 ,检测反应Ⅳ的产物,其中含有
,检测反应Ⅳ的产物,其中含有 有
有(3)用pH约为7的
 溶液与
溶液与 溶液反应制备
溶液反应制备 沉淀。若制备
沉淀。若制备 含量少的
含量少的 ,采用的加料方式为:将
,采用的加料方式为:将(4)准确称取1.00g
 样品置于锥形瓶中,加入适量过二硫酸铵[
样品置于锥形瓶中,加入适量过二硫酸铵[ ]溶液恰好将
]溶液恰好将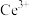 氧化为
氧化为 ,然后加入40.00mL
,然后加入40.00mL 与之恰好反应完全。已知:
与之恰好反应完全。已知: 。求该样品中
。求该样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
3 . 磷酸铁锂( )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:

已知: 是种难溶于水的物质。
是种难溶于水的物质。
(1)基态 原子的单电子数目为
原子的单电子数目为___________ 。
(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是___________ 。
(3) 水解生成
水解生成 的离子方程式为
的离子方程式为___________ 。
(4)加入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果___________ (填“偏高”、“偏低”或“无影响”),滴定终点的现象是___________ 。滴定分析时,称取ag钛铁矿,处理后,用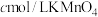 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为___________ 。
 )被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
已知:
 是种难溶于水的物质。
是种难溶于水的物质。(1)基态
 原子的单电子数目为
原子的单电子数目为(2)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是
(3)
 水解生成
水解生成 的离子方程式为
的离子方程式为(4)加入
 发生反应的离子方程式为
发生反应的离子方程式为(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取
 标准液滴定
标准液滴定 的方法:(不考虑
的方法:(不考虑 与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果
与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果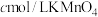 标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
标准液滴定,消耗VmL,则铁元素的质量分数的表达式为
您最近一年使用:0次
解题方法
4 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: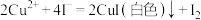 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: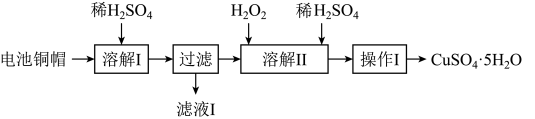
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
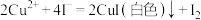 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
5 . 选择性催化还原法(SCR法)去除 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。
(1)以 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
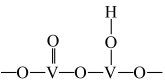
①五价钒在pH为10~13的溶液中会以焦钒酸根( )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式___________ ;
②其他条件相同, 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,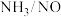 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是___________ 。
(2)以 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:

①请写出脱硝过程中总反应方程式:___________ 。
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:___________ 。
(3)以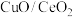 为催化剂
为催化剂
①理想 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的___________ (填“四面体”或“八面体”)空隙中。

②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同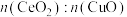 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于___________ 上(填“ ”或“CuO”);
”或“CuO”);
③测定某催化剂中 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为___________ (写出计算过程 ,计算结果保留4位有效数字)
 是脱硝问题研究的热点,催化剂的选取是技术的核心。
是脱硝问题研究的热点,催化剂的选取是技术的核心。(1)以
 为催化剂的催化原理:
为催化剂的催化原理: 与
与 形成能提供氢离子的酸性位(如图所示),
形成能提供氢离子的酸性位(如图所示), 吸附在酸性位上生成中间体继续与NO反应。
吸附在酸性位上生成中间体继续与NO反应。
①五价钒在pH为10~13的溶液中会以焦钒酸根(
 )形式存在,请写出该离子的结构式
)形式存在,请写出该离子的结构式②其他条件相同,
 、NO以一定速率,通过一定量
、NO以一定速率,通过一定量 催化剂催化脱硝,当NO含量一定,
催化剂催化脱硝,当NO含量一定,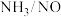 比值大于1.0后NO脱除率变化不大,其原因可能是
比值大于1.0后NO脱除率变化不大,其原因可能是(2)以
 为催化剂的反应机理如图1所示:
为催化剂的反应机理如图1所示:
①请写出脱硝过程中总反应方程式:
②NO脱除率随温度变化如图2所示,温度高于1000℃时NO脱除率明显下降,可能原因是:
(3)以
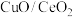 为催化剂
为催化剂①理想
 晶胞如图3所示,实际晶体中会含有部分氧空位。部分
晶胞如图3所示,实际晶体中会含有部分氧空位。部分 填充在由
填充在由 构成的
构成的
②Cu基催化剂对于使用CO脱去NO有着极为优异的催化性能,现探究不同
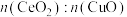 情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在
情况下脱硝、脱碳的情况。已知反应机理是CO首先吸附在 或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于
或CuO表面的活性位点上,由图像可以推断,CO反应的活性位点位于 ”或“CuO”);
”或“CuO”);③测定某催化剂中
 质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用
质量分数,取催化剂产品0.8000g,用30mL高氯酸和20mL磷酸混合液加热溶解,冷却至室温后,用 硫酸亚铁铵[
硫酸亚铁铵[ ]溶液滴定,已知滴定时发生反应为
]溶液滴定,已知滴定时发生反应为 ,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
,达到滴定终点时消耗硫酸亚铁铵溶液20.50mL,则该产品的纯度为
您最近一年使用:0次
6 . I.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用CH4与CO2制备“合成气”CO、H2,合成气可直接制备甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。
(1)若要该反应自发进行,___________ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g) HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③O2(g)+2H2(g) 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1
则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:___________ 。
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=___________ =___________ 。(第一空写表达式,第二空保留三位有效数字)
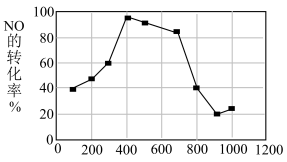
(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是___________ ;___________ 。
 CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体中碳元素的质量分数不再改变 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.2v(H2)正=v(CO)逆 |
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g)
 HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1③O2(g)+2H2(g)
 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。

A.电解池的阴极电极反应式为2CO2+2e-+H2O=HCOO-+HCO |
| B.b为电源正极 |
| C.电解一段时间后,阳极区的KHCO3 溶液浓度降低 |
| D.若以氢氧碱性燃料电池作直流电源,那么负极的电极反应式为H2-2e-+2OH-=2H2O |
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。

| A.a | B.b | C.c | D.d |
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为
 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
您最近一年使用:0次
解题方法
7 . 从某铋(Bi)、锌的冶炼厂的高铟烟灰(主要含ZnO、 、
、 、
、 、
、 )中提取铟和铋的流程如图:
)中提取铟和铋的流程如图:
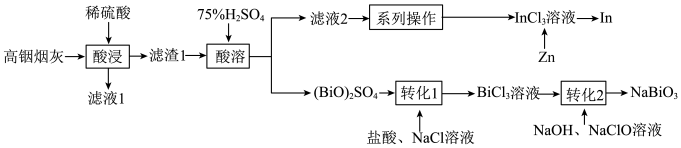
已知: 不溶于稀硫酸;
不溶于稀硫酸; 难溶于水。
难溶于水。
回答下列问题:
(1)“滤液1”中含有的金属阳离子有_______ (填离子符号)。
(2)“酸浸”过程中使用稀硫酸而不用75%的) 溶液,其原因是
溶液,其原因是_______ 。
(3)“酸溶”生成的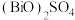 中,Bi元素的化合价为
中,Bi元素的化合价为_______ 。
(4)“转化2”时发生反应的化学方程式为_______ 。
(5)“系列操作”的流程如下:
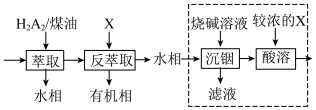
已知:“萃取”时发生反应: (金属阳离子)
(金属阳离子)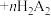 (有机液)
(有机液) (有机液)
(有机液)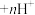 ;
; 与
与 相似,易水解。
相似,易水解。
①试剂X的名称为_______ ,“萃取”和“反萃取”的目的是_______ 。
②关于虚线框内的实验步骤,下列说法正确的是_______ (填标号)。
A.可以提高 溶液的浓度
溶液的浓度
B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)akg的高铟烟灰经上述流程后,得到 质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为_______ (用含a、b、w的计算式表示)。
 、
、 、
、 、
、 )中提取铟和铋的流程如图:
)中提取铟和铋的流程如图:
已知:
 不溶于稀硫酸;
不溶于稀硫酸; 难溶于水。
难溶于水。回答下列问题:
(1)“滤液1”中含有的金属阳离子有
(2)“酸浸”过程中使用稀硫酸而不用75%的)
 溶液,其原因是
溶液,其原因是(3)“酸溶”生成的
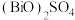 中,Bi元素的化合价为
中,Bi元素的化合价为(4)“转化2”时发生反应的化学方程式为
(5)“系列操作”的流程如下:

已知:“萃取”时发生反应:
 (金属阳离子)
(金属阳离子)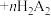 (有机液)
(有机液) (有机液)
(有机液)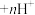 ;
; 与
与 相似,易水解。
相似,易水解。①试剂X的名称为
②关于虚线框内的实验步骤,下列说法正确的是
A.可以提高
 溶液的浓度
溶液的浓度B.烧碱溶液可用纯碱溶液代替
C.需用到分液漏斗、烧杯、玻璃棒等仪器
(6)akg的高铟烟灰经上述流程后,得到
 质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
质量分数为w的产品bg,则高铟烟灰中Bi的百分含量为
您最近一年使用:0次
名校
8 . I. 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为:
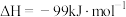 。
。
(1)若要该反应自发进行,_______ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______。
(3)把 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:
①
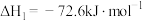
②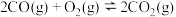

③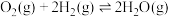
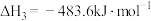
则 与
与 合成
合成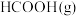 反应的热化学方程式:
反应的热化学方程式:_______ 。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下,此反应为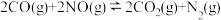
 可有效降低汽车尾气污染物排放。
可有效降低汽车尾气污染物排放。
(4)探究温度、压强 对反应的影响,如图下所示,表示
对反应的影响,如图下所示,表示 的是曲线
的是曲线_______ 。 的恒容密闭容器充入
的恒容密闭容器充入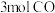 和
和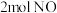 ,当反应达到平衡时NO的体积分数为
,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数
_______ 
_______ 。(第一空写表达式,第二空保留三位有效数字)
(6)使用相同催化剂,测得相同时间内NO的转化率随温度的变化曲线如下图,解释NO的转化率在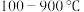 范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
范围内随温度升高先上升后下降,且下降由缓到急的主要原因是____ 。
 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为:
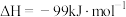 。
。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______。
| A.混合气体中碳元素的质量分数不再改变 |
| B.混合气体的密度不再变化 |
C. 的百分含量不再变化 的百分含量不再变化 |
D.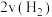 正 正 逆 逆 |
(3)把
 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:①

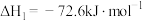
②
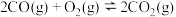

③
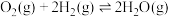
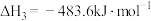
则
 与
与 合成
合成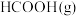 反应的热化学方程式:
反应的热化学方程式:Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下,此反应为
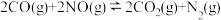
 可有效降低汽车尾气污染物排放。
可有效降低汽车尾气污染物排放。(4)探究温度、压强
 对反应的影响,如图下所示,表示
对反应的影响,如图下所示,表示 的是曲线
的是曲线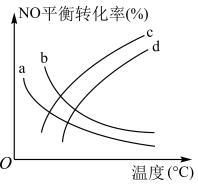
 的恒容密闭容器充入
的恒容密闭容器充入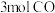 和
和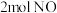 ,当反应达到平衡时NO的体积分数为
,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数

(6)使用相同催化剂,测得相同时间内NO的转化率随温度的变化曲线如下图,解释NO的转化率在
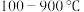 范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
范围内随温度升高先上升后下降,且下降由缓到急的主要原因是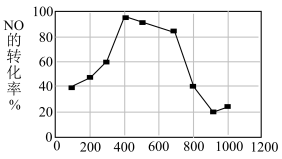
您最近一年使用:0次
名校
9 . Ⅰ.将氮氧化物进行无害化处理对治理大气污染、建设生态文明具有重要意义。
(1) 的氧化性强于
的氧化性强于 ,能更有效地氧化NO。已知:
,能更有效地氧化NO。已知:

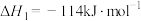

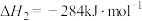
则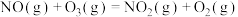
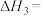
______  。
。
(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:
①
 ,反应能自发进行所需温度条件
,反应能自发进行所需温度条件_______ (填“高温”或“低温”)。
②已知:反应
 ,
, 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:
第一步;
第二步:
反应过程的能量变化如图所示:
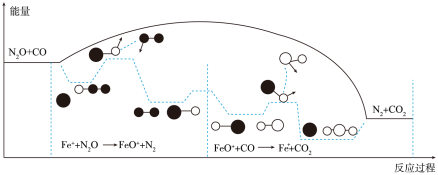
决定总反应速率的是________ (填“第一步”或“第二步)
(3)某温度下,在催化剂的作用下发生反应: ,测得密闭容器中不同时间时CO和NO的浓度如表。
,测得密闭容器中不同时间时CO和NO的浓度如表。
①温度下,该反应的平衡常数为______ 。
②该恒温恒容条件下,下列能说明该反应达到化学平衡状态的是________ (填序号)。
a.体系的压强保持不变 b.
c.混合气体的密度不变 d.NO的转化率保持不变
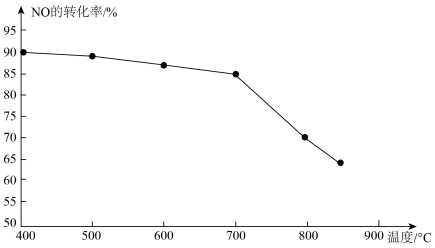
③恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是________ 。
Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液VmL。
溶液VmL。
(4)在进行滴定操作时, 溶液盛装在
溶液盛装在_____ (填“酸式”或“碱式”)滴定管中。当滴入最后半滴 溶液,
溶液,_______ 时达到滴定终点。
(5)以下操作造成测定结果偏高的是________。
(6)滴定过程中发生反应的离子方程式是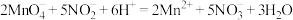 ,测得该样品中
,测得该样品中 的质量分数为
的质量分数为______ 。( 的摩尔质量
的摩尔质量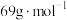 )
)
(1)
 的氧化性强于
的氧化性强于 ,能更有效地氧化NO。已知:
,能更有效地氧化NO。已知:
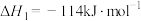

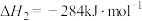
则
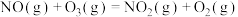
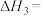
 。
。(2)在汽车排气管上安装催化转化器,能有效消除尾气对环境的污染:
①

 ,反应能自发进行所需温度条件
,反应能自发进行所需温度条件②已知:反应

 ,
, 和CO在
和CO在 作用下发生的反应分两步进行:
作用下发生的反应分两步进行:第一步;

第二步:

反应过程的能量变化如图所示:

决定总反应速率的是
(3)某温度下,在催化剂的作用下发生反应:
 ,测得密闭容器中不同时间时CO和NO的浓度如表。
,测得密闭容器中不同时间时CO和NO的浓度如表。| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
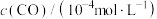 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
 | 10.0 | 4.5 | 2.5 | 1.5 | 1.0 | 1.0 |
②该恒温恒容条件下,下列能说明该反应达到化学平衡状态的是
a.体系的压强保持不变 b.

c.混合气体的密度不变 d.NO的转化率保持不变
③恒容条件下,上述反应中若NO和CO的起始浓度一定,催化反应相同时间,测得NO的转化率随温度的变化如图所示,当温度超过700℃时,随温度的升高,NO的转化率下降明显,原因是

Ⅱ.由于亚硝酸钠和食盐性状相似,曾多次发生过将
 误当食盐食用的事件。欲测定某样品中
误当食盐食用的事件。欲测定某样品中 的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成100mL溶液。②取25.00mL溶液于锥形概中,用 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液VmL。
溶液VmL。(4)在进行滴定操作时,
 溶液盛装在
溶液盛装在 溶液,
溶液,(5)以下操作造成测定结果偏高的是________。
A.滴定管未用 标准溶液润洗 标准溶液润洗 |
| B.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失 |
| C.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数 |
| D.若滴定过程中刚出现颜色变化就停止滴定 |
(6)滴定过程中发生反应的离子方程式是
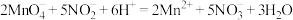 ,测得该样品中
,测得该样品中 的质量分数为
的质量分数为 的摩尔质量
的摩尔质量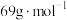 )
)
您最近一年使用:0次
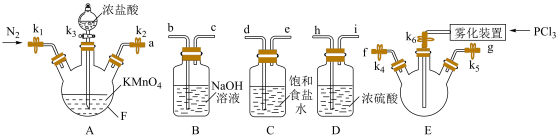
10 .  常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备
常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备 并测定产品的含量。一些物质相关性质如表所示:
并测定产品的含量。一些物质相关性质如表所示:
Ⅰ.制备 :
: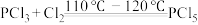
(1)仪器F的名称是___________ ,E中使用雾化装置的优点是___________ 。
(2)按气流从左往右的方向,上述装置的合理连接顺序为a→d→e→___________ (填小写字母,仪器可以重复使用)
(3)固体 为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出
为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出 的电离方程式:
的电离方程式:___________ 。
Ⅱ.测定 产品的含量
产品的含量
实验结束后,准确称取4.20克 产品(含杂质),置于盛有
产品(含杂质),置于盛有 足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成
足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成 溶液。取
溶液。取 溶液于锥形瓶中,加入几滴
溶液于锥形瓶中,加入几滴 做指示剂,加入足量
做指示剂,加入足量 后,用
后,用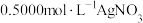 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。
已知:①磷酸银溶于硝酸
②常温下,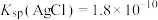 ,
,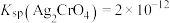
③ 为二元弱酸,具有强还原性。
为二元弱酸,具有强还原性。
(4) 和足量
和足量 溶液完全反应的离子方程式为
溶液完全反应的离子方程式为___________ 。
(5)若滴定完成后使溶液中 浓度为
浓度为 时,则溶液中
时,则溶液中 和
和 浓度之比为
浓度之比为______ 。
(6)产品中 的质量分数为
的质量分数为___________  (保留三位有效数字)。
(保留三位有效数字)。
 常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备
常用于有机合成的氯化剂、催化剂,某实验小组在实验室中模拟制备 并测定产品的含量。一些物质相关性质如表所示:
并测定产品的含量。一些物质相关性质如表所示:| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
 | -112.0 | 76.0 | 137.5 | 无色液体,易水解,易被氧化 |
 | 148 | 160 | 208.5 | 白色或淡黄色晶体,162℃升华,在潮湿空气中易水解 |

Ⅰ.制备
 :
: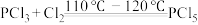
(1)仪器F的名称是
(2)按气流从左往右的方向,上述装置的合理连接顺序为a→d→e→
(3)固体
 为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出
为氯化铯型晶体,由具有正四面体结构和正八面体结构的两种离子构成,写出 的电离方程式:
的电离方程式:Ⅱ.测定
 产品的含量
产品的含量实验结束后,准确称取4.20克
 产品(含杂质),置于盛有
产品(含杂质),置于盛有 足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成
足量氢氧化钠溶液的锥形瓶中至产品完全水解,将水解液配成 溶液。取
溶液。取 溶液于锥形瓶中,加入几滴
溶液于锥形瓶中,加入几滴 做指示剂,加入足量
做指示剂,加入足量 后,用
后,用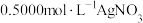 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。
。已知:①磷酸银溶于硝酸
②常温下,
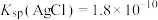 ,
,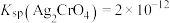
③
 为二元弱酸,具有强还原性。
为二元弱酸,具有强还原性。(4)
 和足量
和足量 溶液完全反应的离子方程式为
溶液完全反应的离子方程式为(5)若滴定完成后使溶液中
 浓度为
浓度为 时,则溶液中
时,则溶液中 和
和 浓度之比为
浓度之比为(6)产品中
 的质量分数为
的质量分数为 (保留三位有效数字)。
(保留三位有效数字)。
您最近一年使用:0次








