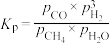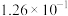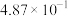(1)反应A(g)+B(g)
 C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。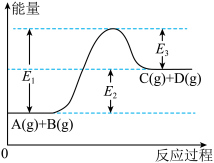
②在反应体系中加入催化剂,反应速率增大,E3
③当反应达到平衡时,升高温度,A的转化率
(2)一定条件下,一氧化碳与氢气反应可以合成甲醇。已知:
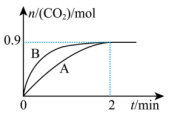
CH3OH(g)+1.5O2(g)=CO2(g)+2H2O(l) △H1=a kJ•mol﹣1
CO(g)+0.5O2(g)=CO2(g) △H2=b kJ•mol﹣1
H2(g)+0.5O2(g)=H2O(l) △H3=c kJ•mol﹣1
则CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=(3)一定压强下,在容积为2L的密闭容器中充入1mol CO与2mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)
 CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) △H,平衡转化率与温度、压强的关系如图所示。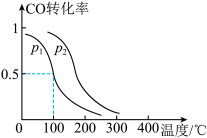
Ⅰ.

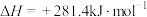
Ⅱ.
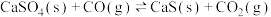
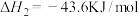
(1)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应Ⅰ,下列能说明该反应已达到平衡状态的是
a.容器内的压强不发生变化 b.

c.容器内气体的密度不发生变化 d.
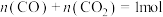
(2)一定温度下,体积为1L的容器中加入CaSO4(s)和1molCO,若只发生反应Ⅱ,测得CO2的物质的量随时间变化如图中曲线A所示:

②曲线B表示过程与曲线A相比,改变的反应条件可能为
③若要提高反应体系中CO2的体积分数,可采取的措施为
(3)以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.

Ⅱ.


Ⅲ.


回答下列问题:

I.近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)=H2O(g)+CO(g) ∆H1=+41.1kJ/mol
CO(g)+2H2(g)=CH3OH(g) ∆H2=-90.0kJ/mol
则CO2催化氢化合成甲醇的热化学方程式:
II.工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)(2)判断反应达到平衡状态的依据是(填字母序号)___________。
| A.生成CH3OH的速率与消耗CO的速率相等 |
| B.CH3OH、CO、H2的浓度都不再发生变化 |
| C.混合气体的相对平均分子质量不变 |
| D.混合气体的密度不变 |
| 温度℃ | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②在250℃,将2mol CO和6mol H2充入2L的密闭容器中,充分反应后,某时刻测得c(CO)=0.3mol/L,则此时化学反应向
III.在一定条件下, A(g)+3B(g)
 C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。
C(g)+D(g) ∆H=-49.0kJ/mol,体系中A的平衡转化率(α)与L和X的关系如图所示,L和X分别表示温度或压强。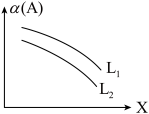
(5)判断L1与L2的大小关系:L1

几种物质中化学键的键能如下表所示。
| 化学键 |  中 中 键 键 |  中 中 键 键 |  中 中 键 键 |  中 中 键 键 |  中 中 键 键 |
| 键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
A.总反应为 | B.过程Ⅰ吸收了926kJ能量 |
| C.过程Ⅱ放出了574kJ能量 | D.过程Ⅲ属于放热反应 |
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
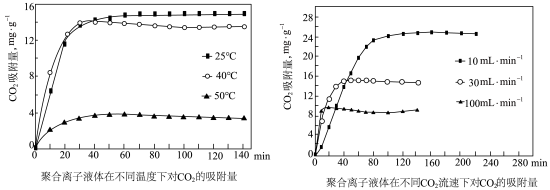
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。
(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
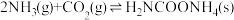
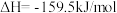
第二步:

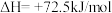
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示: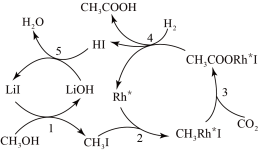
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
6 . I.研究炭的气化处理及空气中碳的氧化物的相关反应,有利于节能减排。已知
①C(s)+H2O(g) CO(g)+H2(g) ΔH=+113.5kJ·mol-1
CO(g)+H2(g) ΔH=+113.5kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) ΔH=-90.4kJ·mol-1
CH3OH(g) ΔH=-90.4kJ·mol-1
③CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.5kJ·mol-1
(1)若某反应的平衡常数表达式为K=
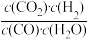 ,则此反应的热化学方程式为
,则此反应的热化学方程式为(2)在一定条件下反应②达到化学平衡状态后,若改变下列条件,既能使反应②增大反应速率又能使平衡向正反应方向移动的是___________(填字母)。
| A.升高温度 | B.及时把CH3OH(g)移走 | C.增大压强 | D.加入合适的催化剂 |
a.恒温恒容容器 b.恒容绝热容器 c.恒压绝热容器 d.恒温恒压容器
II.在一定条件下发生反应:CO(g)+H2O(g) CO2(g)+H2(g),回答下列问题:
CO2(g)+H2(g),回答下列问题:
(4)830K时,若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,平衡时CO的转化率为60%,则该温度下的平衡常数K的值为
(5)830K时,若只将起始时c(H2O)改为6mol·L-1,c(CO)不变,3分钟后达到平衡,则以水蒸气表示这段时间内的平均反应速率为
(6)若830K时,起始浓度c(CO)=a mol·L-1,c(H2O)=b mol·L-1,H2的平衡浓度c(H2)=cmol·L-1,则:①a、b、c之间的关系式是c=
(7)830K时,若起始时c(CO)=0.5mol·L-1,c(H2O)=0.75mol·L-1,c(CO2)=0.3mol·L-1,c(H2)=0.8mol·L-1,此时该反应是
7 . 如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是

| A.热稳定性:MgF2<MgCl2<MgBr2<MgI2 |
| B.22.4L F2(g)与足量的Mg充分反应,放热1124kJ |
| C.由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) ΔH<-117kJ/mol |
| D.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量 |
8 . 已知化学反应A2(g)+B2(g)=2AB(g) ΔH=+100kJ·mol-1的能量变化如图所示,判断下列叙述中错误的是

| A.加入催化剂,该反应的反应热ΔH将不变 | B.每形成2molA—B键,将放出bkJ能量 |
| C.每生成2分子AB吸收(a-b)kJ热量 | D.该反应正反应的活化能大于100kJ·mol-1 |
9 . 合成气(CO、 )可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
)可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
(1)用天然气制备合成气的原理如下:

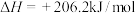
该反应的压强平衡常数(Kp)随温度的变化如下表:
温度/℃ | 700 | 750 | 800 | 850 | 900 |
|
|
| 1.00 | 5.23 |
|
根据热力学状态函数自由能(∆G)的数学表达式: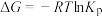 (R为大于0的常数,T为热力学温度),可以推知当温度超过
(R为大于0的常数,T为热力学温度),可以推知当温度超过
(2)用转炉熔渣(未冷却)制备合成气时,涉及反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

反应温度与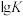 的关系如图所示。
的关系如图所示。
①
②反应: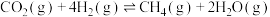 的
的
 、
、 表示)。
表示)。
③用转炉熔渣制取合成气的优点是
(3)在三个密闭容器中,按起始物质的量之比
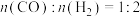 ,将CO和
,将CO和 充入容器中,在不同的温度和压强下,发生反应:
充入容器中,在不同的温度和压强下,发生反应: 。CO的转化率
。CO的转化率 与温度的关系如图所示:
与温度的关系如图所示: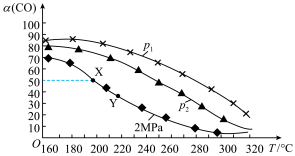
①
 (填“>”“<”或“=”);反应速率
(填“>”“<”或“=”);反应速率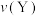
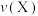 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②X点处,该反应的平衡常数为 (用平衡分压表示,分压等于总压乘以物质的量分数)。
(用平衡分压表示,分压等于总压乘以物质的量分数)。
③提高CO的转化率除改变温度和压强外还可采取的措施是
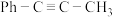 )可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:
)可用作医药中间体,制备帕瑞昔布钠。一定条件下,苯基甲基乙炔可与HCl发生催化加成,反应过程如下:
已知:
 ,下列说法正确的是
,下列说法正确的是A.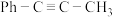 中最多4个碳原子共线 中最多4个碳原子共线 |
B.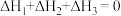 |
| C.产物Ⅱ比产物I稳定,两者互为立体异构体 |
| D.反应I的活化能大于反应Ⅱ |