1 . 已知:Fe2O3(s)+ C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ/mol,
则2Fe(s)+ O2(g)=Fe2O3(s)的ΔH是( )
O2(g)=Fe2O3(s)的ΔH是( )
 C(s)=
C(s)= CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol,
CO2(g)+2Fe(s) ΔH=+234.14 kJ/mol, C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ/mol,
则2Fe(s)+
 O2(g)=Fe2O3(s)的ΔH是( )
O2(g)=Fe2O3(s)的ΔH是( )| A.-824.39 kJ/mol | B.-627.6 kJ/mol | C.-744.7 kJ/mol | D.-169.4 kJ/mol |
您最近一年使用:0次
2020-10-13更新
|
1897次组卷
|
68卷引用:【全国百强校】福建省仙游第一中学2017-2018学年高二上学期期中考试化学试题
【全国百强校】福建省仙游第一中学2017-2018学年高二上学期期中考试化学试题福建省平潭翰英中学2022-2023学年高二上学期第一次月考化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题福建省宁德第一中学2020-2021学年高二上学期第一次月考化学试题(已下线)2010-2011学年山西省临汾一中高二上学期期末考试化学试卷(已下线)2010-2011学年广东省惠阳高级中学高二下学期理综)化学部分(已下线)2013-2014学年海南三亚一中高二上学期期中考试理科化学试卷(B)(已下线)2013-2014河南师大附中第一学期期中考试高二化学试卷2014-2015四川省雅安中学高二下学期开学考试化学试卷2014-2015湖北省武汉市部分重点中学高二下学期期中考试化学试卷2015-2016学年河北大名县第一中学高二上学期第一次月考试化学试卷2016-2017学年山东省枣庄八中高二上10月月考化学卷2016-2017学年河南省师大附中高二上期中化学试卷2016-2017学年山东省曲阜师大附中高二上期中化学试卷2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题新疆石河子第二中学2017-2018学年高二上学期第一次月考化学试题山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题1山东省临沂市蒙阴县实验中学2017-2018学年高二上学期期中考试化学试题2【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高二上学期10月月考化学试题陕西省黄陵中学2019-2020学年高二上学期期中考试化学试题广东省潮州市潮安区颜锡祺中学2019-2020学年高二上学期期中考试化学试题山东省泰安市泰山国际学校2019-2020学年高二上学期第一次月考化学试题山西省运城市景胜中学2019-2020学年高二上学期期中考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题贵州省雷山县第四中学2019-2020学年高二上学期期末考试化学试题北京市东城区北京景山学校2019-2020学年高二下学期期末考试化学试题北京市顺义区2019—2020学年高二下学期期末质量检测化学试题山东省济宁市泗水县2019-2020学年高二上学期期中考试化学试题甘肃省临夏中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时3 反应焓变的计算高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练湖南省长沙市芙蓉区铁路第一中学2019-2020学年高二下学期第一次阶段性测试化学试题天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题江苏省南通市包场高级中学2020-2021学年高二上学期第一次学情检测化学(选修)试题湖南省岳阳市平江县第一中学2020-2021学年高二上学期10月联考化学试题内蒙古赤峰市翁牛特旗乌丹第二中学2020-2021学年高二上学期期中考试化学试题河北省鸡泽县第一中学2020-2021学年高二下学期4月月考化学试题内蒙古杭锦后旗奋斗中学2020-2021学年高二上学期期中考试化学试题浙江省金华市第八中学2021-2022学年高二上学期9月月考化学试题浙江省磐安县第二中学2021-2022学年高二10月份竞赛化学试题广西柳州市第三中学2021-2022学年高二下学期4月月考化学试题宁夏永宁县永宁中学2021-2022学年高二上学期期中考试化学试题内蒙古自治区赤峰学院附属中学2020-2021学年高二下学期期中考试化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题河南省平顶山市鲁山县第一高级中学2021-2022学年高二上学期10月考试化学试题新疆哈密市第八中学2022-2023学年高二上学期期中考试化学试题(已下线)专题02 盖斯定律、反应热的计算【考题猜想】(6大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)北京市顺义区第一中学2023-2024学年高二上学期期中考试化学试题 2009年普通高等学校招生统一考试化学试题(海南卷)(已下线)2011届广东省中山市实验高中高三12月月考(理综)化学部分(已下线)2012届湖北省襄阳五中高三上学期期中考试化学试卷(已下线)2013学年海南省琼海市嘉积中学高一下学期教学质量监测(二)理科化学卷2015届广东省中山市高三下学期第二次模拟考试理科综合化学试卷2014-2015辽宁省实验中学分校高一下学期期中考试化学试卷2015-2016学年辽宁省东北育才学校高一下期中化学试卷2015-2016学年辽宁省实验中学分校高一下期中化学试卷2017届湖北省大冶一中高三上学期8月月考化学试卷2016-2017学年河北省辛集中学高一下学期第二次月考化学试卷河北省张家口市第一中学2016-2017学年高一(实验班、普通班)6月月考(理)化学试题河北省深州中学2016-2017学年高一下学期期末考试化学试题(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(押题专练)2019年秋高三化学复习强化练习—— 盖斯定律及应用2020年安徽省全省教学质量检测统一考试(练习检测一)河南省平顶山市鲁山县第一高级中学2019-2020高一下学期5月考试化学试题海南省北京师范大学万宁附属中学2019-2020学年高一下学期期末考试化学试题(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
2 . CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量___ (填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是____ (填序号)。
A.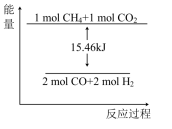 B.
B.  C.
C. 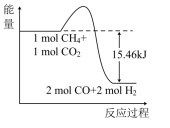 D.
D.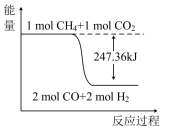
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为___ 。

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=____ 。
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是____ (填序号)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
您最近一年使用:0次
2020-10-12更新
|
645次组卷
|
11卷引用:【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题
【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷2016-2017学年天津市静海一中高二上9月调研化学试卷重庆市南开中学2018-2019学年高二上学期第一次月考化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练江苏省南通西藏民族中学2020-2021学年高二上学期期中考试化学(选修)试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)选择性必修1(SJ)专题1第一单元易错疑难集训(二)广西浦北中学2021-2022学年高二上学期第一次月考化学试题
名校
解题方法
3 . 以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程如图所示。
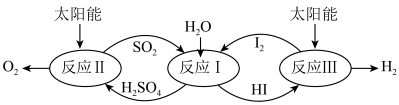
相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+ O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1
反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是

相关反应的热化学方程式为:
反应Ⅰ:SO2(g)+I2(g)+2H2O(l)=2HI(aq)+H2SO4(aq) H1=-213kJ•mol-1
反应Ⅱ:H2SO4(aq)=SO2(g)+H2O(l)+
 O2(g) H2=+327kJ•mol-1
O2(g) H2=+327kJ•mol-1反应Ⅲ:2HI(aq)=H2(g)+I2(g) H3=+172kJ•mol-1
下列说法不正确的是
| A.该过程实现了太阳能到化学能的转化 |
| B.SO2和I2对总反应起到了催化作用 |
| C.总反应的热化学方程式为2H2O(l)=2H2(g)+O2(g) H=+286kJ•mol-1 |
| D.该过程降低了水分解制氢的活化能,但总反应的H不变 |
您最近一年使用:0次
2020-10-12更新
|
2830次组卷
|
28卷引用:福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题
福建省厦门市集美中学2023-2024学年高二上学期10月第一次月考化学试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练湖北省部分省重点中学2020-2021学年高二上学期期中联考化学试题湖北省部分重点中学2020-2021学年高二上学期期中考试化学试题(已下线)高中化学《新教材变化解读与考法剖析》第一章 化学反应的热效应(人教版2019选择性必修1)山东省聊城第三中学2021-2022学年高二上学期第三次质量检测化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题山东省聊城市第二中学2022-2023学年高二上学期第一次月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题山东省临沂市平邑县第一中学2022-2023学年高二上学期10月月考化学试题湖南省衡阳市第八中学2022-2023学年高二下学期5月月考化学试题湖南省南雅中学2023-2024学年高二上学期第一次月考化学试题江西省宜春市上高二中2023-2024学年高二上学期第一次月考化学试题河北省唐山市丰润区2023-2024学年高二上学期期中考试化学试题【区级联考】北京市海淀区2019届高三第一学期上学期期末考试化学试题【全国百强校】浙江省学军中学2019届高三下学期4月选考模拟冲刺化学试题【全国百强校】内蒙古自治区赤峰二中2018-2019学年高一下学期第二次月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省实验中学2020届高三12月月考化学试题北京市2020届高三12月月考(新高考选考模式)化学试题北京市2020届高三质量监测化学试题(已下线)考点06 化学能与热能-2020年高考化学命题预测与模拟试题分类精编山东省济南市历城第二中学2021届高三10月份学情检测化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)安徽省怀宁中学2020-2021学年高一下学期第一次月考化学试题 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题(已下线)2023年北京卷高考真题变式题(选择题11-14)
名校
解题方法
4 . 现有下列四个图象:
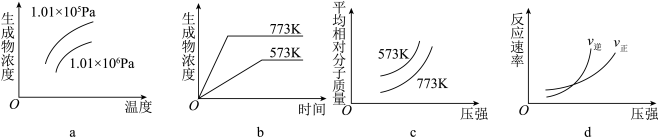
下列反应中符合上述全部图象的是()

下列反应中符合上述全部图象的是()
A. |
B. |
C. |
D. |
您最近一年使用:0次
2020-10-10更新
|
212次组卷
|
2卷引用:福建省莆田第二十五中学2021-2022学年高二上学期期中考试化学试题
解题方法
5 . 已知下列热化学方程式:
①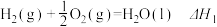
②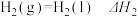
③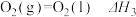
④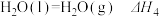
则反应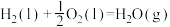 的反应热
的反应热 与
与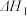 、
、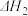 、
、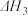 、
、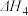 的关系正确的是
的关系正确的是
①
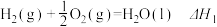
②
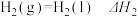
③
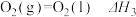
④
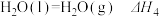
则反应
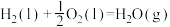 的反应热
的反应热 与
与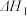 、
、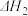 、
、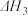 、
、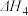 的关系正确的是
的关系正确的是A.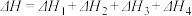 | B.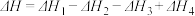 |
C. | D.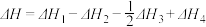 |
您最近一年使用:0次
2020-10-05更新
|
210次组卷
|
2卷引用:福建省建瓯市芝华中学2021-2022学年高二上学期第一次阶段性检测化学试题
6 . 已知胆矾溶于水溶液温度降低,胆矾分解的热化学方程式为:CuSO4•5H2O(S)=CuSO4(S)+5H2O(l)ΔH=Q1kJ·mol-1;室温下,若将1mol无水硫酸铜溶解为溶液时放热Q2kJ,则:( )
| A.Q1>Q2 | B.Q1=Q2 | C.Q1<Q2 | D.无法比较 |
您最近一年使用:0次
2020-09-20更新
|
274次组卷
|
24卷引用:福建省泉州第十六中学2019-2020学年高二上学期期中考试化学(选考班)试题
福建省泉州第十六中学2019-2020学年高二上学期期中考试化学(选考班)试题2015-2016学年安徽省合肥中科大附中高二下期中理科化学试卷2016-2017学年安徽省淮南二中高二上第一次月考化学试卷河南省南阳市第一中学校2016-2017学年高二下学期第三次月考化学试题河南省南阳市第一中学2016-2017学年高二下学期第三次月考化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高二上学期期末考试化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1内蒙古乌兰察布市北京八中乌兰察布分校2018-2019学年高二上学期第二次月考调研化学试题浙江省“七彩阳光”新高考研究联盟2018-2019学年高二下学期期中化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期开学考试化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题广东省广州市中山大学附属中学2019-2020学年高二10月月考化学试题大连市普兰店区第一中学2020-2021学年高二上学期第一阶段考试化学试题江苏省苏州实验中学2020-2021学年高二下学期3月份学情调研考试化学试题(已下线)第一章 化学反应与能量 单元综合检测-2021-2022学年高二化学课后培优练(人教版选修4)云南省弥勒市第一中学2021-2022学年高二上学期第二次月考化学试题宁夏吴忠市吴忠中学2022-2023学年高二上学期阶段性测试化学试题(已下线)2012届湖南省四市九校高三上学期第一次联考化学试卷(已下线)2011-2012学年江西省白鹭洲中学高一下学期期中考试化学试卷2017届河北省定州中学高三上月考三化学试卷辽宁省六校协作体2017-2018学年高一下学期期中考试化学试卷辽宁省2017-2018学年度下学期六校协作体高一期中考试化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第二次月考化学试题上海市2017-2018学年高一化学第一学期综合测试卷二
解题方法
7 . 已知热化学方程式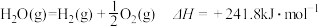 ,
,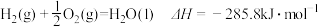 。当
。当 水蒸气变为液态水时,其焓变为
水蒸气变为液态水时,其焓变为
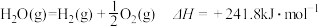 ,
,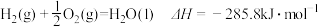 。当
。当 水蒸气变为液态水时,其焓变为
水蒸气变为液态水时,其焓变为A.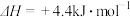 | B.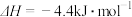 |
C.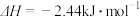 | D.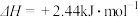 |
您最近一年使用:0次
2020-09-13更新
|
407次组卷
|
8卷引用:福建省南安市柳城中学2020-2021学年高二上学期第一次月考化学试题
8 . 工业上,冶炼铁的有关热化学方程式如下:
①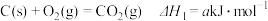 ;
;
②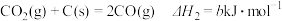 ;
;
③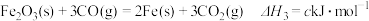
④
上述热化学方程式中,a、b、c、d均不等于0.下列说法不正确的是
①
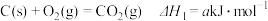 ;
;②
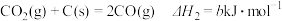 ;
;③
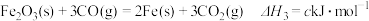
④

上述热化学方程式中,a、b、c、d均不等于0.下列说法不正确的是
A. |
B.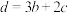 |
C.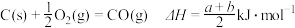 |
D. |
您最近一年使用:0次
2020-09-13更新
|
1715次组卷
|
17卷引用:福建省南安第一中学2019-2020学年高二上学期第一次阶段考试化学试题
福建省南安第一中学2019-2020学年高二上学期第一次阶段考试化学试题【全国校级联考】河南省豫南七校2017-2018学年高二下学期升级摸底考试化学试题2018-2019学年人教版高二化学选修四章:化学反应与能量末测试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)山西省长治市第二中学2019-2020学年高二上学期第一次月考化学试题安徽省霍邱县第二中学2019-2020学年高二上学期第一次月考化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节 化学反应的热效应 课时3 反应焓变的计算高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 课时1 盖斯定律 (1)四川省成都市第七中学2020-2021学年高二上学期十月阶段性考试化学试题湖南省常德市第一中学2020-2021学年高二上学期第2次月考化学试题选择性必修1专题1第一单元 课时2 反应热的测量与计算安徽省皖北县中联盟2021-2022学年 高二上学期10月第一次联考化学试题辽宁省渤海大学附属高级中学2021-2022学年高二上学期期中考试化学试题第二节 反应热的计算 第2课时 反应热的计算1.1.2反应热的测量与计算 课后四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题(已下线)题型102 反应热的大小比较
9 . 通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
| A.反应①中电能转化为化学能 |
| B.反应②为放热反应 |
| C.反应③使用催化剂,ΔH3减小 |
| D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1 |
您最近一年使用:0次
2020-09-02更新
|
3852次组卷
|
106卷引用:福建省南安第一中学2017-2018学年高二上学期期中考试化学试题
福建省南安第一中学2017-2018学年高二上学期期中考试化学试题福建省惠安惠南中学2018-2019学年高二上学期期中考试化学试题福建省福州市福清西山学校高中部2019-2020学年高二上学期期中考试化学试题福建省莆田第七中学2021-2022学年高二上学期期末考试化学试题2016-2017学年湖北省咸宁市高二上学期第一次月考化学试卷2016-2017学年山东省枣庄二中高二第二次月考化学试卷2016-2017学年江西省樟树中学高二上第二次月考化学试卷2016-2017学年云南省曲靖一中高二上期中化学试卷2016-2017学年江西省樟树中学高二上月考二化学试卷2016-2017学年山东省济宁市历城区高二上期中化学试卷2016-2017学年辽宁东北育才学校高二上阶段考二化学卷2016-2017学年江苏省扬州中学高二12月月考化学卷2016-2017学年广东省仲元中学高二上学期期末考试化学(理)试卷江苏省徐州市2016-2017学年高二下学期期中考试化学试题辽宁省辽源市金鼎高级中学2016-2017学年高二上学期期末考试化学试卷吉林省延边安图第一中学2016-2017学年高二练习化学试题山东省济南市外国语学校2017-2018学年高二10月月考(理)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高二上学期期中考试(理)化学试题山东省枣庄市薛城区2017-2018学年高二上学期期末化学试题湖南省醴陵市第一中学2018-2019学年高二上学期入学考试化学试题2018-2019学年人教版高中化学选修四模块综合测评题广东省蓝精灵中学2018-2019学年高二上学期联考化学试题【全国百强校】陕西省西安市第一中学2018-2019学年高二上学期10月月考化学试题甘肃省兰州第一中学2018-2019学年高二(理)上学期期中考试化学试题【校级联考】浙江省温州市“十五校联合体”2018-2019学年高二上学期期中联考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题安徽省青阳县第一中学2019-2020学年高二10月月考化学试题安徽省亳州市第十八中学2019-2020学年高二上学期第一次月考化学试题湖北省武汉市汉南区职教中心2019-2020学年高二上学期期中考试化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题福建省厦门市思明区厦门外国语学校2019-2020学年高三上学期周末练习12——化学试题贵州省镇远县二中2019-2020学年高二上学期期末考试化学试题江苏省扬州市江都区大桥高级中学2019-2020学年高二下学期期中考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期期中考试化学试题河南省安阳市林州市第一中学2020-2021学年高二上学期开学考试(实验班)化学试题江苏省启东中学2020-2021学年高二上学期期初考试化学试题(已下线)1.3.2 反应热的计算(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1章 综合检测高中必刷题高二选择性必修1第一章 化学反应的热效应 第一章素养检测(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)江苏省扬州中学2018-2019学年高二上学期12月月考试题 化学 Word版(已下线)【南昌新东方】9.湾里一中 梁莎陕西省西安市第八十九中学2018-2019学年高二上学期期中考试化学试题江苏省徐州市沛县2020-2021学年高二上学期第一次学情调研化学(选修)试题江西省九江市浔阳区九江市第七中学2020-2021学年高二上学期期中考试化学试题(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)江苏省盐城市阜宁中学2020-2021学年高二上学期期末考试化学试题江苏省吴江汾湖高级中学2020-2021学年高二下学期阶段性教学质量检测化学试题江苏省宜兴市张渚高级中学2020-2021学年高二下学期第一学段质量检测化学试题重庆市南开中学2020-2021学年二上学期期末考试化学试题山东省曲阜市第一中学2017-2018学年高二上学期第一次月考化学试题北京市昌平区新学道临川学校2021-2022学年高二上学期第一次月考化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第一次月考化学试题河北省保定市徐水综合高级中学2021-2022学年高二上学期第二次月考化学试题江苏省盐城市第一中学、阜宁中学2021-2022学年高二上学期期中考试化学试题河南省南阳市第六完全学校高级中学2022-2023学年高二上学期9月考试化学试题广西桂林市第十八中学2021-2022学年高二下学期开学考试化学试题山东省济宁市泗水县2021-2022学年高二上学期期中考试化学试题河南省安阳市第三十九中学2022-2023学年高二上学期第二次考试化学试题海南省三亚华侨学校(南新校区)2021-2022学年高二上学期期中考试化学试题天津市河东区 2022-2023 学年高二上学期期末质量检测化学试题广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题江苏省南菁高级中学2023-2024学年高二上学期9月调研化学试题2016年全国普通高等学校招生统一考试化学(江苏卷精编版)2015-2016学年吉林省松原市油田高中高一下期末化学试卷2017届河北沧州市第一中学高三上学期第一次月考化学试题2017届河北省沧州市第一中学高三上周测化学试卷2017届河北省石家庄二中高三上第二期联考化学试卷2017届河南省开封市高三上学期10月定位考试化学试卷2017届广西桂林十八中高三上10月月考化学试卷2017届河南省郑州一中高三上期中化学试卷2017届辽宁省沈阳二中高三上期中化学试卷2017届宁夏银川一中高三上月考四化学试卷2017届宁夏六盘山高级中学高三上月考二化学卷辽宁省鞍山市第一中学2016-2017学年高一下学期期中考试化学试题苏教版2017届高三单元精练检测六化学试题2018版化学(苏教版)高考总复习专题六对接高考精练--化学反应的热效应黑龙江省大庆实验中学2018届高三上学期期中考试理科综合化学试题(已下线)《考前20天终极攻略》-5月24日 盖斯定律及反应热的有关计算(已下线)解密08 化学反应与热能(教师版)——备战2018年高考化学之高频考点解密人教版2017届高三单元精练检测六化学试题(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(教学案)(已下线)考点08 化学反应中的热效应——备战2019年浙江新高考化学考点2016年全国普通高等学校招生统一考试化学(江苏卷参考版)(已下线)2019年4月8日 《每日一题》三轮复习——反应热的计算与盖斯定律云南省建水县第二中学2020届高三上学期开学考试化学试题2020届高三化学二轮冲刺新题专练——盖斯定律的应用2云南省昭通市绥江县二中2019-2020学年高三上学期期末考试理综化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题安徽省合肥市第一中学2020年高中毕业班教学质量监测卷理科综合化学试题湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题湖南省长沙市第一中学2019-2020学年高一下学期第三次月考化学试题吉林省白城市洮南市第一中学2019-2020学年高一下学期第三次月考化学试题黑龙江省哈尔滨市第一中学校2021届高三上学期开学测试化学试题河北省唐山市第十一中学2021届高三9月入学检测化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五中学2021届高三下学期5月月考化学试题(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)湖北省武汉市华中师范大学第一附属中学2020届高三3月份网络教学质量监测卷理综化学试题湖南省长沙市第一中学、广东省深圳实验学校2021-2022学年高三上学期联考化学试题 (已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)湖北省十堰市2016-2017学年高一下学期期末调研考试化学试题湖南省常德市第一中学 2023届高三7月摸底考试化学试题
名校
10 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的结构式是__________ 。
(2)该反应的热化学方程式为___________ 。
(3)已知H2O(l)=H2O(g) ∆H=+44kJ/mol,则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,∆H=_________ 。
(4)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为__________ 。
(5)已知: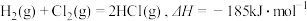 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=_________ 。
(1)过氧化氢的结构式是
(2)该反应的热化学方程式为
(3)已知H2O(l)=H2O(g) ∆H=+44kJ/mol,则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,∆H=
(4)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(5)已知:
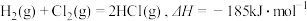 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=共价键 |
|
|
|
键能/( | 436 | 247 | a |
您最近一年使用:0次
2020-08-25更新
|
456次组卷
|
5卷引用:福建省福州第一中学2022-2023学年高二上学期12月月考化学试题
福建省福州第一中学2022-2023学年高二上学期12月月考化学试题 (已下线)第一章 化学反应的热效应(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省盘锦市第二高级中学2020-2021学年高二上学期第一次阶段性考试化学试题湖北省仙桃、天门、潜江2019-2020学年高一下学期期末考试化学试题吉林省吉化第一高级中学校2021-2022学年高一下学期复课检测化学试题







