1 . 已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。
Mn(s)+O2(g)=MnO2(s) ∆H=-520kJ/mol
S(s)+O2(g)=SO2(g) ∆H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ∆H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是
您最近一年使用:0次
2 . 当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国力争于2030年前做到碳达峰,2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳的含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如下表:
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为__________ 。
(2)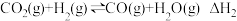
(3)以CO2、H2为原料合成CH3OH的主要反应如下:
I.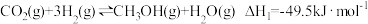
II.
III.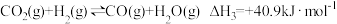
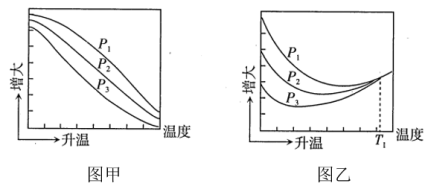
不同压强下,按照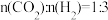 投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=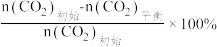
CH3OH的平衡产率=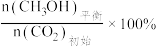
其中纵坐标表示CO2平衡转化率的是图_____ (填“甲”或“乙”);压强P1、P2、P3由大到小的顺序为____ ;图乙中T1温度时,三条曲线几乎交于一点的原因是_______ 。
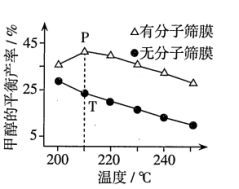
(4)恒压下,按照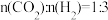 投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是
投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是_________ 。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如下表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
燃烧热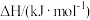 |  |  |  |
(2)
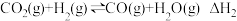
(3)以CO2、H2为原料合成CH3OH的主要反应如下:
I.
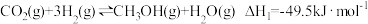
II.

III.
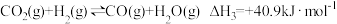
不同压强下,按照
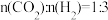 投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
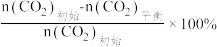
CH3OH的平衡产率=
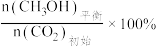
其中纵坐标表示CO2平衡转化率的是图
(4)恒压下,按照
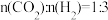 投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是
投料发生反应I,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的平衡产率随温度的变化如图所示(分子筛膜具有选择透过性)。P点甲醇的平衡产率高于T点的原因可能是
您最近一年使用:0次
3 . 碳的单质及化合物在人类生产生活中起着非常重要的作用。请回答下列问题:
(1)已知CH3OH(l)的燃烧热 ,
,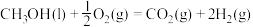
 ,则
,则
______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为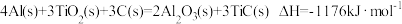 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为_________ kJ。
(4)工业上乙烯催化氧化制乙醛的反应原理为: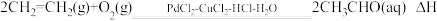 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:
I.
II.……
III.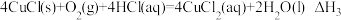
若第II步反应的反应热为 ,且
,且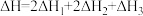 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为__ 。
(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为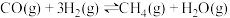 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
该反应的
__________  。
。
(1)已知CH3OH(l)的燃烧热
 ,
,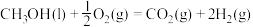
 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)Cl2(g)和H2O(g)通过灼热的炭层,生成HCl(g)和CO2(g),当有1molCl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。下列反应可制得耐高温材料,热化学方程式为
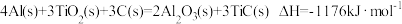 。该反应过程中每转移1mol电子放出的热量为
。该反应过程中每转移1mol电子放出的热量为(4)工业上乙烯催化氧化制乙醛的反应原理为:
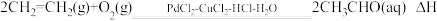 ,该反应原理可以拆解为如下三步反应:
,该反应原理可以拆解为如下三步反应:I.

II.……
III.
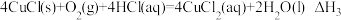
若第II步反应的反应热为
 ,且
,且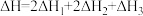 ,则第II步反应的热化学方程式为
,则第II步反应的热化学方程式为(5)山西是全国最大的炼焦用煤资源基地,炼焦过程的副产品之一焦炉煤气富含H2、CH4和CO,因此可通过甲烷化反应来提高热值,使绝大部分CO、CO2转化成CH4.甲烷化反应的主要化学原理为
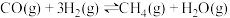 ,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):
,已知CO分子中的C与O之间为共价三键。下表所列为常见化学键的键能数据(键能指气态分子中1mol化学键解离成气态原子所吸收的能量):| 化学键 |  |  |  |  |  |  |
键能/( ) ) | 347.7 | 413.4 | 436 | 351 | 1065 | 462.8 |

 。
。
您最近一年使用:0次
名校
4 . 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g)△H1
CH3OH(g)△H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g) CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1=___ kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___ kJ·mol-1。
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:
CH4与CO2制备合成气的热化学方程式为__ 。
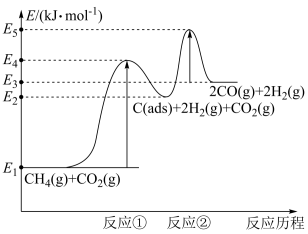
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。
①电池工作过程中,图中Pt电极附近溶液的pH__ (填“变大”或“变小”),阴极的电极反应式为___ 。
②每转移2mol电子,阴极室溶液质量增加___ g。
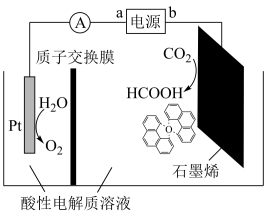
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
①放电时,正极的电极反应式为___ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为___ g。(假设放电前两电极质量相等)
①CO(g)+2H2(g)
 CH3OH(g)△H1
CH3OH(g)△H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2③CO2(g)+H2(g)
 CO(g)+H2O(g)△H3
CO(g)+H2O(g)△H3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C≡O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)科学家提出制备“合成气反应历程分两步:
反应①:CH4(g)=C(ads)+2H2(g)(慢反应)
反应②:C(ads)+CO2(g)=2CO(g)(快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图所示:

CH4与CO2制备合成气的热化学方程式为
(3)利用铜基配合物1,10—phenanthroline—Cu催化剂电催化CO2还原制备碳基燃料(包括CO、烷烃和酸等)是减少CO2在大气中累积和实现可再生能源有效利用的关键手段之,其装置原理如图所示。

①电池工作过程中,图中Pt电极附近溶液的pH
②每转移2mol电子,阴极室溶液质量增加
(4)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
2Na2CO3+C.放电时该电池“吸入CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2mol电子时,两极的质量差为
您最近一年使用:0次
2021-10-18更新
|
118次组卷
|
2卷引用:山西省运城市2021-2022学年高三上学期期中考试化学试题
2021高三·全国·专题练习
名校
5 . 我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程,该反应经历了I、II、III三个过渡态。图中显示的是反应路径中每一阶段内各驻点的能量相对于此阶段内反应物能量的能量之差。下列说法正确的是
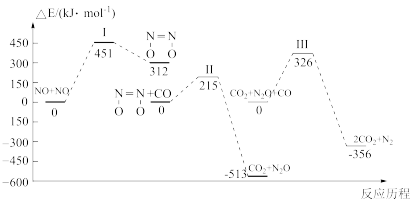

A.N2O比 更不容易与CO发生反应 更不容易与CO发生反应 |
| B.整个反应分为三个基元反应阶段,其中第一个反应阶段活化能最大 |
C.2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H>0 N2(g)+2CO2(g) ∆H>0 |
| D.其他条件不变,增大压强或使用催化剂均可以增大反应速率,提高反应物的转化率 |
您最近一年使用:0次
2021-10-13更新
|
158次组卷
|
5卷引用:山西省太原市2021-2022学年高二上学期期中考试化学试题
山西省太原市2021-2022学年高二上学期期中考试化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题河北省保定市唐县一中2021-2022学年高三上学期第二次月考化学试题
名校
6 . 由于雾霾严重,长沙市19年12月15、16日在部分路段施行了限行。已知汽车尾气排放出的 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)汽车尾气中的 和
和 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应:
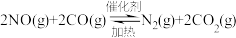

已知:① 燃烧热的
燃烧热的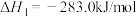
②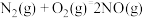
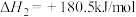 ,则
,则
__________ 。
(2)某研究小组对反应
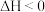 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率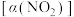 ,部分实验结果如图1所示。
,部分实验结果如图1所示。

①如果将图中 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是__________ 。
②图中 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为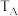 和
和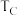 ,通过判断:
,通过判断: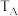
__________ 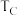 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(3)工业废气也是产生雾霾的重要原因,某厂采用湿法 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
① 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:____________________ 。
②过二硫酸钾可通过电解 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
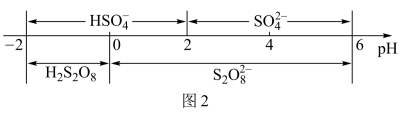
已知在阳极放电的离子主要是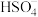 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为__________ ;阳极的电极反应式为______________________________ 。
 、
、 等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。(1)汽车尾气中的
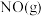 和
和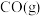 在一定温度和催化剂条件下可发生如下反应:
在一定温度和催化剂条件下可发生如下反应: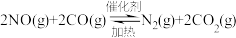

已知:①
 燃烧热的
燃烧热的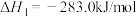
②
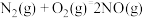
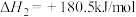 ,则
,则
(2)某研究小组对反应

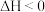 进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各次实验的温度可能相同,也可能不同),测定
进行多组实验(各次实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率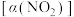 ,部分实验结果如图1所示。
,部分实验结果如图1所示。
①如果将图中
 点的平衡状态改变为
点的平衡状态改变为 点的平衡状态,应采取的措施是
点的平衡状态,应采取的措施是②图中
 、
、 两点对应的实验温度分别为
两点对应的实验温度分别为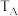 和
和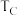 ,通过判断:
,通过判断: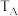
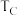 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(3)工业废气也是产生雾霾的重要原因,某厂采用湿法
 氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。
氧化脱硝综合处理燃煤锅炉烟气,提高了烟气处理效率。①
 水解时生成
水解时生成 和
和 ,写出该反应的化学方程式:
,写出该反应的化学方程式:②过二硫酸钾可通过电解
 溶液的方法制得。电解液中含硫微粒主要存在形式与
溶液的方法制得。电解液中含硫微粒主要存在形式与 的关系如图2所示。
的关系如图2所示。
已知在阳极放电的离子主要是
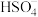 ,阳极区电解质溶液的
,阳极区电解质溶液的 范围为
范围为
您最近一年使用:0次
2021-10-12更新
|
200次组卷
|
2卷引用:山西省名校2021-2022学年高一下学期期中联合考试化学试题
名校
解题方法
7 . 已知:
①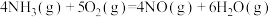
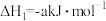
②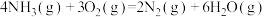
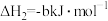
③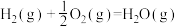

④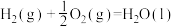

下列叙述正确的是
①
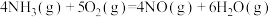
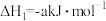
②
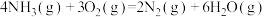
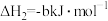
③
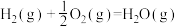

④
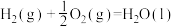

下列叙述正确的是
A.由上述热化学方程式可知 |
| B.上述四个反应中,反应物的总能量均大于生成物的总能量 |
C.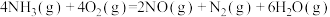 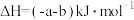 |
D.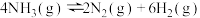 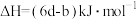 |
您最近一年使用:0次
2021-08-06更新
|
437次组卷
|
4卷引用:山西省实验中学2022-2023学年高一下学期期中考试化学试题
13-14高二·全国·课时练习
名校
解题方法
8 . 已知HCN(aq)与NaOH(aq)反应生成1mol正盐的ΔH=-12.1kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3kJ·mol-1。则HCN在水溶液中电离的ΔH等于
| A.-69.4kJ·mol-1 | B.-45.2kJ·mol-1 |
| C.+69.4kJ·mol-1 | D.+45.2kJ·mol-1 |
您最近一年使用:0次
2022-09-23更新
|
589次组卷
|
24卷引用:山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题
山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题2016-2017学年贵州省安顺平坝第一高级中学高二上期中化学卷河北省石家庄市第一中学2016-2017学年高一下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2019-2020学年高二上学期期中考试化学(理)试题江西省南昌市知行中学2021-2022学年高二上学期期中化学试题(已下线)2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(已下线)2014高考名师推荐化学盖斯定律及其应用(已下线)2015届黑龙江省哈尔滨市第三中学高三第一次测试化学试卷2016届黑龙江省哈尔滨师大附属中学高三上12月月考化学试卷2016-2017学年云南省云天化中学高二上学期期末考试化学(理)试卷辽宁省大连育明高级中学2018届高三人教版选修四同步周测三化学试题黑龙江省哈尔滨市第三中学2018届高三上学期第一次验收考试化学试题山东省济宁市微山县亚马逊中学2019届高三上学期11月月考化学试题云南省普洱市澜沧县民族中学2018-2019学年高二下学期期末考试化学试题内蒙古包头市第四中学2018-2019学年高一下学期第一次月考(3月)化学试题贵州省锦屏中学2019-2020学年高二上学期期末考试化学试题人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 章末综合检测卷湖南省常德市一中2020-2021学年高二下学期第一次月考化学试题安徽省合肥市第六中学2021-2022学年高二上学期月考化学试题甘肃省永昌县第一高级中学2020-2021学年高二上学期期末考试化学试题新疆哈密市第八中学2021-2022学年高二上学期期末考试化学试题四川省南充市白塔中学2020-2021学年高一下学期4月月考化学试题云南省玉溪市江川区第二中学2021-2022学年高二上学期12月考试化学试题云南省普洱市西盟佤族自治县第一中学2021-2022学年高二上学期12月月考化学试题
名校
解题方法
9 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
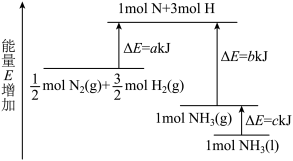
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题
山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题
2013·四川绵阳·三模
名校
解题方法
10 . 用 和
和 的混合溶液可溶出废旧印刷电路板上的铜。已知:
的混合溶液可溶出废旧印刷电路板上的铜。已知:
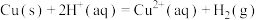
 kJ⋅mol
kJ⋅mol
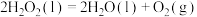
 kJ⋅mol
kJ⋅mol
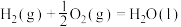
 kJ⋅mol
kJ⋅mol
在 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和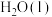 的反应热
的反应热 等于
等于
 和
和 的混合溶液可溶出废旧印刷电路板上的铜。已知:
的混合溶液可溶出废旧印刷电路板上的铜。已知: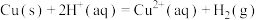
 kJ⋅mol
kJ⋅mol
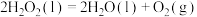
 kJ⋅mol
kJ⋅mol
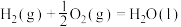
 kJ⋅mol
kJ⋅mol
在
 溶液中,Cu与
溶液中,Cu与 反应生成
反应生成 和
和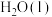 的反应热
的反应热 等于
等于A.-417.91 kJ⋅mol | B.-319.68 kJ⋅mol |
C.+546.69 kJ⋅mol | D.-448.46 kJ⋅mol |
您最近一年使用:0次
2023-06-20更新
|
315次组卷
|
62卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题2016届江西省临川区第二中学高三上学期期中测试化学试卷2016-2017学年山西省大同一中高二上10月月考化学卷2016-2017学年新疆生产建设兵团二中高二上期中化学卷陕西省西安电子科技大学附属中学2019-2020学年高二上学期期中考试化学(理)试题辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期中考试化学试题辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题新疆乌鲁木齐高级中学2022-2023学年高二上学期期中考试化学试题广东省兴宁市沐彬中学2022-2023学年高二上学期期中考试化学试题西藏昌都市第三高级中学2021-2022学年高二上学期期中考试化学试题(已下线)2013届四川省绵阳市第三次诊断性考试理综化学试卷(已下线)2014年高考化学 题型八 能量变化型专题练习卷(已下线)2015届广西桂林市第十八中学高三上学期第二次月考化学试卷(已下线)2015届广西桂林十八中高三上第二次月考化学试卷2015-2016学年安徽省合肥一中等三校高二上期末化学试卷2017届宁夏银川二中高三上学期统练二化学试卷新疆呼图壁县第一中学2017-2018学年高二上学期期中考试化学试题甘肃省岷县二中2018-2019学年高二上学期第一次月考化学试题【全国百强校】四川省成都市双流区棠湖中学2018-2019学年高二上学期第一次月考理科综合化学试题新疆维吾尔自治区昌吉市第四中学2018-2019学年第一学期高二第一次月考化学试题吉林省乾安县第七中学2018-2019学年高一下学期第二次质量检测化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用2020届高三化学二轮冲刺新题专练——盖斯定律的应用1辽宁省丹东市2020年高三线上教学质量监测(全国II卷)理综化学试题广东省广州、深圳市学调联盟2020届高三第二次调研考试化学试题湖北省武汉市蔡甸区汉阳一中2019-2020学年高一下学期3月月考化学试题(已下线)第22讲 化学反应与能量变化-2021年高考化学一轮复习名师精讲练(已下线)1.3.1 盖斯定律(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)第一章 化学反应与能量(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)江西省赣州市南康中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市一〇三中学2020-2021学年高二10月月考化学试题(已下线)1.2.2 反应热的计算 (练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省临沂市费县第二中学2020-2021学年高二上学期11月月考化学试题四川省乐山市2020-2021学年高二上学期期末考试化学试题河北省名校联盟2021届高三下学期开学考试(新高考)化学试题四川省乐山市峨山彝族自治县第一中学2020-2021学年高二下学期4月月考化学试题甘肃省静宁县第一中学2020-2021学年高一下学期第三次月考化学(普通班)试题(已下线)【浙江新东方】高中化学20210621-011【2021】【高三下】黑龙江省大庆中学2020-2021学年高一下学期期末考试化学试题(已下线)专题1.2 反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)1.3 化学反应热的计算-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)第1章 化学反应与能量(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题江西省南昌市莲塘第一中学2021-2022学年高二上学期9月质量检测化学试题(已下线)1.2 反应热的计算(基础过关A练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江西省上饶市铅山县第一中学2021-2022学年高二下学期开学考试化学试题 辽宁省抚顺市第一中学2021-2022学年高一下学期6月月考化学试题河北省邢台市2021-2022学年高一下学期期末考试化学试题湖北省恩施土家族苗族自治州2021-2022学年高一下学期期末化学试题湖北省恩施州高中教育联盟2021-2022学年高一下学期期末考试化学试题(已下线)第25练 反应热的计算-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)陕西省延安市富县高级中学2021-2022学年高一下学期期末考试化学试题(B卷)江西省金溪县第一中学2023届高三上学期第一次月考化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题(已下线)第一章 化学反应的热效应(A卷·知识通关练)-【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)安徽省安庆二中2022-2023学年高一下学期5月月考化学试题上海市杨浦高级中学2023-2024学年高二下学期摸底考试(等级)化学试题



