解题方法
1 . 由化学能产生的能量是目前人类使用的主要能源。
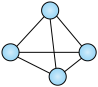
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:___ 。
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:___ 。(写出一个即可)
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:__ 。
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2__ △H1,(填“>”、“<"或“=")
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=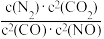 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:___ 。
(1)意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构为正四面体(如图所示),与白磷分子相似。已知断裂1molN-N键吸收167kJ热量,生成1molN
 N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
N键放出942kJ热量。根据以上信息和数据,写出N2气体转化为N4气体的热化学方程式:
(2)自嗨锅(自热火锅)的加热原理是利用发热包内的物质与水接触,释放出热量,从而使得上面隔层食材锅内的食物吸收热量后温度升高。一般自嗨锅的发热包是用碳酸钠、焙烧硅藻土、铁粉、铝粉、焦炭粉、活性炭、盐、生石灰等组成,写出发热包中的某一物质与水发生放热反应的化学方程式:
(3)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2gSiH4自燃放出热量89.2kJ,则SiH4自燃的热化学方程式为:
(4)比较下列两个热化学方程式中ΔH的大小。
4Al(s)+3O2(g)=2Al2O3(s) △H1 4Fe(s)+3O2(g)=2Fe2O3(s) △H2
△H2
(5)已知:2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+181kJ·mol-1
若某反应的平衡常数表达式为K=
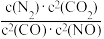 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:
您最近一年使用:0次
名校
解题方法
2 . (1)写出下列物质在水溶液中的电离方程式:
CH3COOH____ HClO4_____
Fe(OH)3____ Ba(OH)2_____
NaHSO4____
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:___ 。
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于___ 。
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
CH3COOH
Fe(OH)3
NaHSO4
(2)常温下2.3g乙醇和一定量的氧气混合,点燃恰好完全燃烧,生成液态水和CO2放出68.35kJ热量,则该反应的热化学方程式为:
(3)根据下列热化学方程式分析,C(s)的燃烧热△H等于
C(s)+H2O(l)=CO(g)+H2(g) △H1=+175.3kJ·mol-1
2CO(g) + O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g) + O2(g)=2H2O(l) △H3=-571.6kJ·mol-1
您最近一年使用:0次
名校
解题方法
3 . 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
‘
(1)该密闭容器的容积是______________ L。
(2)达到平衡状态的时刻是_______________ min(填“3”或“10”)。
(3)在前10min内,用CO2浓度的变化表示的反应速率 (CO2)=
(CO2)=_____________ mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为______ 。
(5)该温度下,反应的化学平衡常数数值是____ 。
(6)已知: ① CO(g)+2H2(g) CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为_____ ,反应在10 min内所放出的热量为_____ kJ.
 CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:‘

(1)该密闭容器的容积是
(2)达到平衡状态的时刻是
(3)在前10min内,用CO2浓度的变化表示的反应速率
 (CO2)=
(CO2)=(4)10min时体系的压强与开始时压强之比为
(5)该温度下,反应的化学平衡常数数值是
(6)已知: ① CO(g)+2H2(g)
 CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)
CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为
您最近一年使用:0次
2019-09-30更新
|
266次组卷
|
3卷引用:山西省古县第一中学2020-2021学年高二上学期期中化学试题
名校
解题方法
4 . 请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________ 。
(2)广义的水解观认为:水解的物质和水分别解离成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -b kJ/mol
③ H2O(g)= H2O(l) ΔH3= -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是_________ ,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______ 。
A.HCN B.HClO C.CH3COOH D.H2CO3
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因
(2)广义的水解观认为:水解的物质和水分别解离成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1= -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2= -b kJ/mol
③ H2O(g)= H2O(l) ΔH3= -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是
A.HCN B.HClO C.CH3COOH D.H2CO3
您最近一年使用:0次
名校
5 . 下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )

下列说法不正确的是( )
A.通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1 |
| B.通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1 |
C.若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1, 则a>286  |
| D.制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法 |
您最近一年使用:0次
2019-08-11更新
|
966次组卷
|
4卷引用:山西省太原市2019-2020学年高二上学期期中测评化学试题
山西省太原市2019-2020学年高二上学期期中测评化学试题浙江省稽阳2018-2019学年高三联考化学试题江西省吉安市遂川中学2019—2020学年高二上学期第一次月考化学试题(B)(已下线)课时28 焓变与热化学方程式-2022年高考化学一轮复习小题多维练(全国通用)
名校
解题方法
6 . 下列说法或表示方法不正确的是
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H = -57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ |
| C.由一定条件下石墨合成金刚石吸热,可知石墨比金刚石稳定 |
| D.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H = –285.8kJ/mol |
您最近一年使用:0次
2020-11-12更新
|
326次组卷
|
17卷引用:山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题
山西省晋中市平遥县第二中学2018-2019学年高二上学期期中考试化学试题安徽省池州市第一中学2019-2020学年高二上学期期中考试化学试题山西大学附属中学2019-2020学年高二10月月考化学试题河北省唐山市河北唐山外国语学校2020-2021学年高二上学期期中考试(理科)化学试题河北省尚义县第一中学2020-2021学年高二上学期期中考试化学试题湖北省巴东县第二高级中学2020-2021学年高二上学期期中考试化学试题河北省唐山市遵化市2021-2022学年高二上学期期中考试化学试题2014-2015学年山东省微山一中高二下学期期末考试化学试卷云南省曲靖市罗平县第三中学2020届高二下学期开学考试化学试题四川省成都外国语学校2020-2021学年高二10月月考化学试题(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)甘肃省天水市第六中学2019-2020学年高二上学期期末考试化学试题(普通班)内蒙古自治区第二地质中学2020-2021学年高二下学期第二次阶段检测化学试题陕西省宝鸡市金台区2021-2022学年高二上学期期末考试化学(理)试题吉林省辽源市等2地高中友好学校2022-2023学年高二上学期期末联考化学试题安徽省安庆市怀宁县第二中学2022-2023学年高二上学期期末考试化学试题吉林省辽源、通化等2市2022-2023学年高二上学期1月期末考试化学试题
10-11高二上·山西临汾·期中
名校
解题方法
7 . 已知热化学反应方程式:Zn(s)+ O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
 O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+
O2(g)=ZnO(s) ΔH=-351.5kJ·mol-1;Hg(l)+ O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为
O2(g)=HgO(s) ΔH=-90.84kJ·mol-1,则热化学反应方程式:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的ΔH为| A.ΔH=+260.66kJ·mol-1 | B.ΔH=+442.34kJ·mol-1 |
| C.ΔH=-442.34kJ·mol-1 | D.ΔH=-260.66kJ·mol-1 |
您最近一年使用:0次
2021-11-08更新
|
147次组卷
|
27卷引用:2010年山西省临汾一中高二上学期期中考试化学试题
(已下线)2010年山西省临汾一中高二上学期期中考试化学试题(已下线)2011-2012学年江西省兴国县将军中学高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2011-2012学年辽宁省抚顺县高级中学高一下学期期中考试化学试卷(已下线)2012-2013学年浙江省桐乡一中高二下学期期中考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(理)化学试卷甘肃省天水市武山县三校2020-2021学年高二上学期期中联考化学试题 (已下线)必考点01 化学反应的热效应-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)云南省红河县一中2021-2022学年高二上学期期中考试化学试题(已下线)2012-2013学年新疆兵团农二师华山中学高二上学期期末考试化学试卷(已下线)2014届贵州省六校联盟高三第一次联考化学试卷2015-2016北京大学附中宇华教育集团高二12月化学卷2015-2016北京大学附中宇华教育集团高一12月化学卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年安徽省安庆市怀宁县高河中学高二上期末化学试卷甘肃省武威第五中学2018-2019学年高二上学期期末考试化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高二上学期第一次月考化学试题福建省华安一中、龙海二中2019-2020学年高二上学期第一次联考化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】黑龙江省绥化地区肇东第四中学2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第六中学2020-2021学年高二上学期期末考试(合格考)化学试题吉林省大安市第六中学2021-2022学年高二上学期第一次月考化学试题湖南省长沙铁路第一中学2021-2022学年高二上学期第一次阶段性考试化学试题海南省海口嘉勋高级中学2021-2022学年高二上学期10月月考化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题安徽省芜湖市无为襄安中学2022-2023高二上学期第一次月考化学试题
8 . 反应A(g)+B(g)  C(g)+D(g)过程中能量变化如图,下列说法正确的是( )
C(g)+D(g)过程中能量变化如图,下列说法正确的是( )
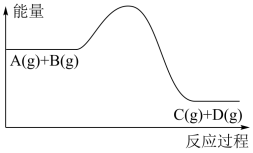
 C(g)+D(g)过程中能量变化如图,下列说法正确的是( )
C(g)+D(g)过程中能量变化如图,下列说法正确的是( ) 
| A.该反应为吸热反应 |
| B.升高温度,利于A的转化率增大 |
| C.加入催化剂时,可以降低反应热 |
| D.增大压强,能够缩短反应达到平衡状态的时间 |
您最近一年使用:0次
名校
解题方法
9 . (1)已知:①Fe(s)+l/2O2(g)===FeO(s) △H1=—272.0 kJ/mol
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是________________ 。
(2)如图所示的装置中发生反应2A2(g)+B2(g) 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:

①此反应的平衡常数表达式为__________ ;若将温度升高到700℃,反应的平衡常数将____________ (填“增大”、“减小”或“不变”)。
②比较大小:w1________ w2(填“>”、“=”、“<”),a、b、c由大到小的关系___________ 。
③若打开K,一段时间后重新达平衡,容器B的体积将___________ (填“增大”、“减小”或“不变”)。
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系___________ 。
⑤能说明A中已达到平衡状态的是________ (填序号,有一个或多个选项符合题意)。
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
②2Al(s)+3/2O2(g)==Al2O3(s) △H2=-1675.7 kJ/mol
A1和FeO发生铝热反应的热化学方程式是
(2)如图所示的装置中发生反应2A2(g)+B2(g)
 2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
2C(g) △H=-akJ·mol-1(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2molA2和1molB2两容器分别在500℃时达平衡,A中C的浓度为w1mol·L-1,放出热量 bkJ,B中C的浓度为w2mol·L-1,放出热量 ckJ。请回答下列问题:
①此反应的平衡常数表达式为
②比较大小:w1
③若打开K,一段时间后重新达平衡,容器B的体积将
④若让A,B体积相等且固定P,在B中改充入4mol A2和2mol B2,在500℃时达平衡后C 的浓度为w3mol·L-1,则 w1,w3的关系
⑤能说明A中已达到平衡状态的是
A.υ(C)=2υ(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
您最近一年使用:0次
名校
解题方法
10 . 乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g) CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
②2CH3OH(g) C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
③CH3CH2OH(g) CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1
④C2H5OH(g) C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1
回答下列问题:
(1)a=___________ 。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
①欲提高C2H5OH的平衡转化率,应采取的措施为___________ (填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________ ,平衡时C2H5OH的转化率为_______ (结果保留两位有效数字,下同),该反应的平衡常数K=_________ 。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____ mol,n(C2H5OH)=_____ mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______ ,由此规律推出反应在12h时c(C2H5OH)等于______ mol•L-1
①2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJ•mol-1②2CH3OH(g)
 C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1
C2H4(g)+2H2O(g) △H2= —29.1kJ•mol-1③CH3CH2OH(g)
 CH3OCH3(g) △H3= +50.7kJ•mol-1
CH3OCH3(g) △H3= +50.7kJ•mol-1④C2H5OH(g)
 C2H4(g)+ H2O(g) △H4=akJ•mol-1
C2H4(g)+ H2O(g) △H4=akJ•mol-1回答下列问题:
(1)a=
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(C2H5OH)/(mol•L-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
您最近一年使用:0次
2019-05-06更新
|
87次组卷
|
2卷引用:【全国百强校】山西省忻州市第一中学2018-2019学年高二下学期期中考试化学试题



