1 . 合成氨的工艺流程一般分三步:第一步为原料气的制备,将天然气等原料制成含氢和氮的粗原料气;第二步为净化,主要包括变换过程、脱硫脱碳过程以及气体精制过程;第三步为氨合成,将纯净的氢氮混合气压缩,增大压强,在催化剂的作用下合成氨。
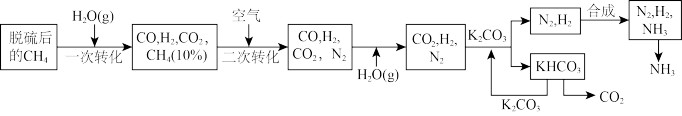
已知几种物质的燃烧热如表所示:
回答下列问题:
(1)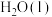 的汽化热(
的汽化热( )为+44 kJ·mol
)为+44 kJ·mol ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为_________ 。
(2)“二次转化”时进口处混合气的温度在1200℃左右,随后混合气开始急剧升温,而在出口处混合气的温度降到1000℃左右,试解释其原因:_________ 。
(3)整个流程图中有两处循环,一处是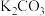 循环,还有一处循环,请在流程图上标出循环方向和循环物质
循环,还有一处循环,请在流程图上标出循环方向和循环物质_________ 。
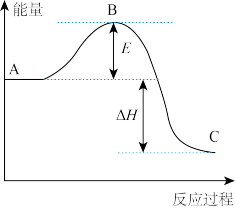
(4)合成氨反应过程中的能量变化如图所示,图中A、C分别表示_________ 、_________ ,E的大小对该反应的反应热_________ (填“有”或“无”)影响。该反应常用铁作催化剂,其反应机理可能为 在催化剂表面反应生成
在催化剂表面反应生成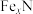 ,接着催化剂吸附的氢气不断与
,接着催化剂吸附的氢气不断与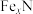 作用,最后生成
作用,最后生成 ,该催化循环机理的化学方程式可表示为
,该催化循环机理的化学方程式可表示为_________ 。
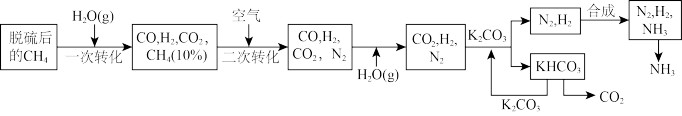
已知几种物质的燃烧热如表所示:
| 物质 |  |  |  |  |
燃烧热 | -285.5 | -890.3 | -283 | -393.5 |
(1)
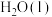 的汽化热(
的汽化热( )为+44 kJ·mol
)为+44 kJ·mol ,则“一次转化”过程中生成CO的热化学方程式为
,则“一次转化”过程中生成CO的热化学方程式为(2)“二次转化”时进口处混合气的温度在1200℃左右,随后混合气开始急剧升温,而在出口处混合气的温度降到1000℃左右,试解释其原因:
(3)整个流程图中有两处循环,一处是
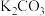 循环,还有一处循环,请在流程图上标出循环方向和循环物质
循环,还有一处循环,请在流程图上标出循环方向和循环物质(4)合成氨反应过程中的能量变化如图所示,图中A、C分别表示
 在催化剂表面反应生成
在催化剂表面反应生成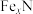 ,接着催化剂吸附的氢气不断与
,接着催化剂吸附的氢气不断与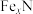 作用,最后生成
作用,最后生成 ,该催化循环机理的化学方程式可表示为
,该催化循环机理的化学方程式可表示为
您最近一年使用:0次
2022-11-11更新
|
141次组卷
|
3卷引用:山西省部分名校2022-2023学年高二上学期期中联合考试化学试题
2 . 甲烷及其衍生物在国民经济中有着重要的作用。回答下列问题:
(1)研究表明 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气: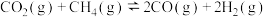

已知:①
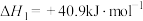
②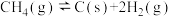
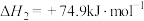
③
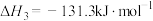
则上述制取合成气反应的
_______  ,利于反应自发进行的条件是
,利于反应自发进行的条件是_______ (填“高温”或“低温”)。
(2)在T℃,向VL体积恒定的密闭容器中,充入10mol 和15mol
和15mol 发生反应
发生反应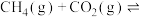
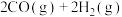 。
。
①为了加快该反应的速率,下列措施可行的是_______ (填字母)。
A.按原比例充入 、
、 B.缩小容器体积
B.缩小容器体积
C.增大反应物与催化剂的接触面积 D.移出产物CO、
②起始时容器内的总压强为25kPa,测得t min后反应达到平衡, 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率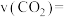
_______  ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
_______ ( 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
(3)下列能说明反应达到平衡状态的是_______(填字母)。
(4)甲醇是重要的化工原料。利用CO与 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为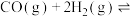
 。在一容积可变的密闭容器中按一定的投料比充入CO与
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
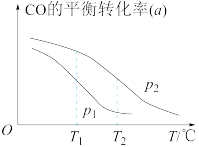
①该反应平衡常数大小: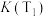
_______ 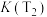 (填“>”或“<”)。
(填“>”或“<”)。
②图中压强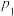
_______  (填“>”或“<”)。
(填“>”或“<”)。
(1)研究表明
 与
与 在催化剂存在下可发生反应制得合成气:
在催化剂存在下可发生反应制得合成气: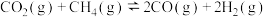

已知:①

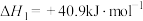
②
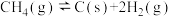
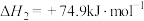
③

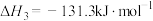
则上述制取合成气反应的

 ,利于反应自发进行的条件是
,利于反应自发进行的条件是(2)在T℃,向VL体积恒定的密闭容器中,充入10mol
 和15mol
和15mol 发生反应
发生反应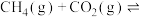
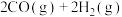 。
。①为了加快该反应的速率,下列措施可行的是
A.按原比例充入
 、
、 B.缩小容器体积
B.缩小容器体积C.增大反应物与催化剂的接触面积 D.移出产物CO、

②起始时容器内的总压强为25kPa,测得t min后反应达到平衡,
 的平衡转化率为60%。则从起始到平衡反应的平均速率
的平衡转化率为60%。则从起始到平衡反应的平均速率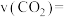
 ,在该温度下反应的平衡常数
,在该温度下反应的平衡常数
 为以分压表示的平衡常数,气体分压=气体总压×体积分数)。
为以分压表示的平衡常数,气体分压=气体总压×体积分数)。(3)下列能说明反应达到平衡状态的是_______(填字母)。
| A.混合气体的密度保持不变 |
B. 的物质的量保持不变 的物质的量保持不变 |
| C.容器内混合气体原子总数不变 |
D.每生成1molCO的同时消耗1mol |
 合成甲醇,其反应的化学方程式为
合成甲醇,其反应的化学方程式为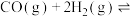
 。在一容积可变的密闭容器中按一定的投料比充入CO与
。在一容积可变的密闭容器中按一定的投料比充入CO与 ,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。
①该反应平衡常数大小:
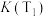
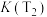 (填“>”或“<”)。
(填“>”或“<”)。②图中压强
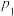
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
名校
3 . 参考下列图表和有关要求回答问题:
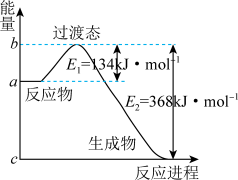
图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_______ ,ΔH的变化是_______ (填“增大”、“减小”、“不变”)。请写出NO2和CO反应的热化学方程式:_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应: ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为反应_______ (填“吸热”或“放热)。
③某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向_______ (填“正向”、“逆向”或“平衡”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中 的大小:
的大小:
_______  (填“>”或“<”)。
(填“>”或“<”)。
①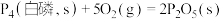

②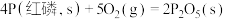


图Ⅰ
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是
(2)在一定体积的密闭容器中,进行如下化学反应:
 ,其化学平衡常数K和温度t的关系如表所示:
,其化学平衡常数K和温度t的关系如表所示:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②该反应为反应
③某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
 ,
, ,
, ,
, ,则下一时刻,反应向
,则下一时刻,反应向(3)已知常温时红磷比白磷稳定,比较下列反应中
 的大小:
的大小:
 (填“>”或“<”)。
(填“>”或“<”)。①
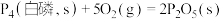

②

您最近一年使用:0次
2022-11-09更新
|
148次组卷
|
3卷引用:山西省阳泉市第一中学校2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
4 . 锆(Zr)是一种适用于霰弹枪的金属燃烧剂,在一定温度下,锆能与氧气、氮气、水蒸气等发生反应。已知一些反应如下:
①Zr(s)+O2(g)=ZrO2(s) △H1;
②2Zr(s)+N2(g)=2ZrN(s) △H2;
③Zr(s)+2H2O(g)=ZrO2(s)+2H2(g) △H3
则2H2O(g)=2H2(g)+O2(g)分解的焓变为
①Zr(s)+O2(g)=ZrO2(s) △H1;
②2Zr(s)+N2(g)=2ZrN(s) △H2;
③Zr(s)+2H2O(g)=ZrO2(s)+2H2(g) △H3
则2H2O(g)=2H2(g)+O2(g)分解的焓变为
| A.△H1+△H2-△H3 | B.△H1-△H3 | C.△H1-△H2+△H3 | D.△H3-△H1 |
您最近一年使用:0次
2022-10-12更新
|
218次组卷
|
4卷引用:山西省朔州市怀仁一中2023-2024学年高二上学期12月期中考试化学试题
名校
5 . TiN具有良好的导电和导热性,可用于高温结构材料和超导材料。可利用化学气相沉积技术来制备氮化钛。请回答下列问题:
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)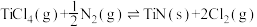
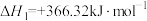
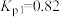
(ⅱ)
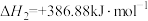
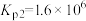
(ⅲ)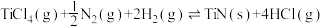
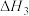
①已知反应(ⅳ)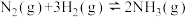
 ,则
,则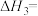
_______  。
。
②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是_______ 。
(2)在1200℃、130kPa反应条件下,将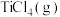 、
、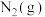 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中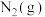 与
与 的分压相等,则
的分压相等,则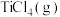 平衡转化率为
平衡转化率为_______ (保留三位有效数字),0~20min之间,以分压表示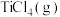 的平均反应速率为
的平均反应速率为_______ 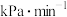 。
。
(3)制备氮化钛的原料氨气的合成。将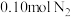 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
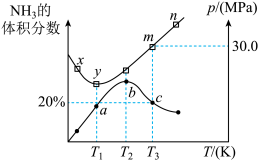
①对于该可逆反应过程,下列有关说法正确的是_______ (填序号)。
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度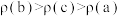
②x、y、m三点对应温度下的平衡常数由大到小的顺序为_______ 。
③当温度为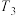 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数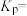
_______ 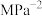 (列出计算式即可)。
(列出计算式即可)。
(1)已知1200℃下,三种制备氮化钛反应的热化学方程式:
(ⅰ)
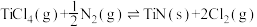
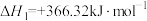
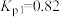
(ⅱ)

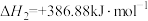
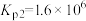
(ⅲ)
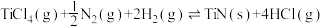
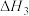
①已知反应(ⅳ)
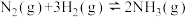
 ,则
,则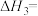
 。
。②利用反应ⅰ和ⅱ两种方式制备TiN时。反应ⅱ的反应趋势远大于ⅰ,其原因是
(2)在1200℃、130kPa反应条件下,将
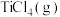 、
、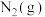 、
、 以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中
以物质的量之比1∶1∶2加入反应容器进行反应ⅲ。20min后反应达到平衡状态,平衡时混合气中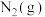 与
与 的分压相等,则
的分压相等,则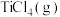 平衡转化率为
平衡转化率为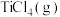 的平均反应速率为
的平均反应速率为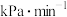 。
。(3)制备氮化钛的原料氨气的合成。将
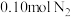 和
和 投入到某刚性反应容器中,测得反应过程中
投入到某刚性反应容器中,测得反应过程中 的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
的体积分数和反应体系的总压p随着温度的升高而变化的曲线如图:
①对于该可逆反应过程,下列有关说法正确的是
A.a、b、c三点时,该反应均处于平衡状态
B.m→n过程中,该反应平衡逆向移动
C.混合气体的平均摩尔质量M(b)>M(c)>M(a)
D.混合气体的密度
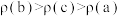
②x、y、m三点对应温度下的平衡常数由大到小的顺序为
③当温度为
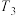 ,该反应达到平衡时,以气体分压表示的该反应的平衡常数
,该反应达到平衡时,以气体分压表示的该反应的平衡常数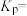
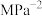 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2022-09-03更新
|
477次组卷
|
3卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
6 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=___________ kJ·mol-1;该反应的平衡常数K=___________ (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有___________ 。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=___________ ,CO的转化率α(CO)=___________ 。
(4)将合成气以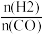 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是___________ (填字母)。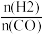 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为___________ 时最有利于二甲醚的合成。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1
CH3OH(g) ΔH1=-90.7 kJ·mol-1 K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1 K2③CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1 K3回答下列问题:
(1)反应3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)的ΔH=
CH3OCH3(g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5 min内v(H2O)=
(4)将合成气以
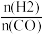 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)
=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是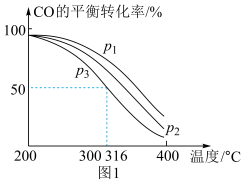
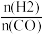 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是CuMn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为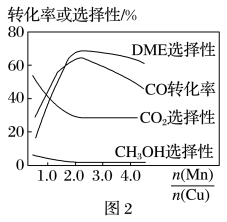
您最近一年使用:0次
2023-09-29更新
|
226次组卷
|
16卷引用:山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题
山西省吕梁市柳林县2021-2022学年高二上学期期中考试化学试题山东省实验中学2019-2020学年高二上学期期中考试化学试题辽宁省六校协作体2020-2021学年高二上学期期中联考化学试题黑龙江省八校2021-2022学年高二上学期期中联合考试化学试题广东省深圳市南山为明学校2023-2024学年高二上学期期中考试化学试题广东省深圳市罗湖外语学校2023-2024学年高二上学期期中考试化学试题云南省下关第一中学2023-2024学年高二下学期5月期中考试化学试题山东省师范大学附属中学2019-2020学年高二上学期第五次学分认定考试化学试题吉林省长春外国语学校2021-2022学年高二上学期第一次月考化学试题辽宁省铁岭市六校协作体2021-2022学年高一下学期期末联考化学试题第二章化学反应速率与化学平衡湖南省衡阳市田家炳实验中学2022-2023学年高二上学期9月月考化学试题黑龙江省佳木斯市第一中学2023-2024学年高二上学期10月月考化学试题重庆市璧山来凤中学2023-2024学年高二上学期9月月考化学试题陕西省西安市铁一中学2023-2024学年高二上学期期末考试化学试题湖南省长沙市周南中学2023-2024学年高二下学期第一次月考化学试题
7 . Ⅰ.在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应: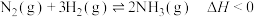 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
①上表中T1_______ T2(用含“>”“<”“=”的关系式表示),其中a、b、80%三者的大小关系是_______ (用含“>”“<”“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是_______ (填字母序号)。
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡_______ (填“向左移动”“向右移动”或“不移动”)。
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
甲醇合成反应:_______。
甲醇脱水反应: 。
。
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为_______ 。
(3)请写出甲醇合成反应的热化学方程式:_______ 。
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应:
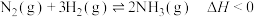 ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:| 1小时 | 2小时 | 3小时 | 4小时 | |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1
②研究表明,合成氨的速率与相关物质的浓度关系为
 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:甲醇合成反应:_______。
甲醇脱水反应:
 。
。(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(3)请写出甲醇合成反应的热化学方程式:
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
您最近一年使用:0次
8 . 已知: 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式:
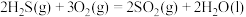
 ①
①

 ②
②

 ③
③
 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是
 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式: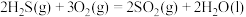
 ①
①
 ②
②
 ③
③ 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是A.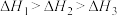 | B.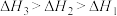 |
C.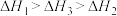 | D.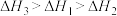 |
您最近一年使用:0次
2023-12-03更新
|
479次组卷
|
24卷引用:山西省怀仁市2021-2022学年高二上学期期中化学试题
山西省怀仁市2021-2022学年高二上学期期中化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期中考试化学试题(理)河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题山东省聊城市2023-2024学年高二上学期11月期中考试化学试题天津市南开区2023-2024学年高二上学期11月期中考试化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)广西钦州市2021-2022学年高二上学期期末考试化学试题第二节 反应热的计算 第2课时 反应热的计算贵州省部分学校2022-2023学年高二上学期10月联考化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题章末检测卷(一) 化学反应的热效应广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题安徽省无为襄安中学2022-2023学年高二下学期开学考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题
9 . “一碳化学”的研究对象为含有一个碳原子的物质,如CO、CO2、CH4等,“一碳化学”在消除二氧化碳排放、有效降低全球变暖风险中具有十分广泛的应用。请完成下列各题:。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=_______ kJ·mol-1。其正反应的活化能为EakJ·mol-1,则逆反应的活化能为_______ kJ·mol-1。该反应自发进行的条件是_______ (填“高温”“低温”或“任意条件”)。
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:
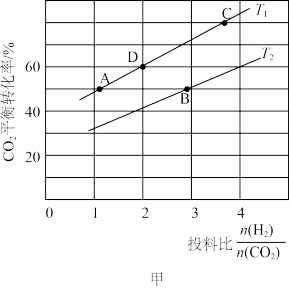
①写出该反应的化学方程式:_______ 。
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=_______ 。
③若T1<T2,则反应的ΔH_______ (填“<”“>”或“=”)0;T1温度下D点所对应反应的平衡常数为_______ (保留两位小数);KA、KB、KC三者之间的大小关系为_______ 。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:
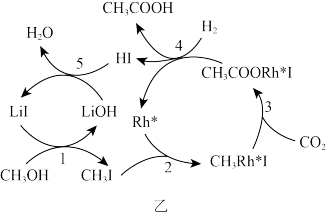
①根据图示,写出总反应的化学方程式:_______ 。
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:_______ 。
(1)CH4与CO2反应可获得应用广泛的合成气(CO和H2):CH4+CO2=2CO+2H2。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-820kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41kJ·mol-1
③2CO(g)+O2(g)=2CO2(g) ΔH3=-566kJ·mol-1
则反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=
(2)一定条件下,将CO2与H2的混合气体通过催化剂可实现将CO2转变为二甲醚(CH3OCH3)(g),同时有H2O(g)生成。在某压强下,在不同温度、不同投料比时,CO2与H2反应生成二甲醚的反应中,CO2的平衡转化率如图甲所示:

①写出该反应的化学方程式:
②T1温度下,在2L密闭容器中充入18mol原料气,5min后反应达到D点,则0~5min内的平均反应速率v(CH3OCH3)=
③若T1<T2,则反应的ΔH
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图乙所示:

①根据图示,写出总反应的化学方程式:
②原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式:
您最近一年使用:0次
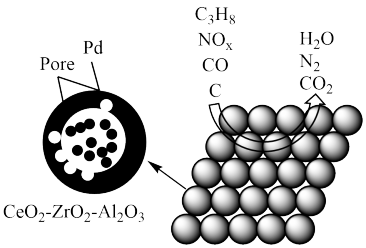
10 . 造成大气污染的NOx、SO2主要来自于汽车尾气及工厂废气的排放,对其进行处理是我们研究的重要课题。
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。
(2)已知:2C(s)+O2(g) 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1
N2(g)+O2(g) 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g)+2CO(g) 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
则用焦炭还原NO生成无污染气体的热化学方程式为_______ 。
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。
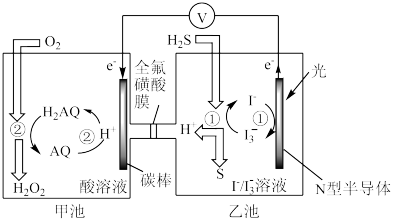
①装置中H+向_______ 池迁移。
②写出乙池溶液中发生反应的离子方程式_______ 。
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为_______ ;现采用电解法将上述吸收液中的 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_______ (填字母代号)口流出。
②写出阴极的电极反应式:_______ 。
(1)某汽车安装的尾气净化装置工作原理如图所示。下列叙述错误的是_______(填字母)。

| A.Pd-Pore催化剂可提高尾气净化反应的平衡转化率 |
| B.NOx的生成主要是与汽油燃烧不充分有关 |
| C.在此变化过程中,NOx被还原 |
| D.在催化剂的作用下,CO、NOx、C3H8都转化为无毒的物质 |
 2CO(g) ΔH1=-221.0kJ·mol-1
2CO(g) ΔH1=-221.0kJ·mol-1N2(g)+O2(g)
 2NO(g) ΔH2=+180.5kJ·mol-1
2NO(g) ΔH2=+180.5kJ·mol-12NO(g)+2CO(g)
 2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1
2CO2(g)+N2(g) ΔH3=-746.0kJ·mol-1则用焦炭还原NO生成无污染气体的热化学方程式为
(3)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓。

①装置中H+向
②写出乙池溶液中发生反应的离子方程式
(4)铈元素(Ce)常见有+3、+4两种价态。NO可以被含Ce4+的溶液吸收,生成含有Ce3+和
 的吸收液,反应的离子方程式为
的吸收液,反应的离子方程式为 转化为无毒物质,同时再生Ce4+,其原理如图所示。
转化为无毒物质,同时再生Ce4+,其原理如图所示。
①Ce4+从电解槽的
②写出阴极的电极反应式:
您最近一年使用:0次
2022-08-20更新
|
148次组卷
|
2卷引用:山西省怀仁市第一中学2021-2022学年高三上学期期中理科综合化学试题



