名校
1 . 将CH4和CO2重整转化为合成气一直是减少温室气体排放的研究方向之一,涉及如下反应:
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)
积碳反应:CH4(g)⇌C(s)+2H2(g) =+75 kJ/mol
=+75 kJ/mol
回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s) =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=_______ kJ/mol
(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
(3)在体积为5L恒容密闭容器中充入2.0mol CH4和4.0molCO2,500℃下仅发生主反应,CH4、CO2的物质的量随时间变化如下表所示:
①CO2在 0~30 min 内的平均反应速率v(CO2)= ___________ 。
②主反应的平衡常数表达式为_____________ 。
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K_______ (填“增大”、“减小”或“不变”)
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率______ 90%(填“<”、“=”或“>”)。
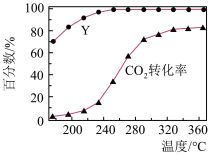
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为__________ mL·min-1。
主反应:CH4(g)+CO2(g)⇌2CO(g)+2H2(g)

积碳反应:CH4(g)⇌C(s)+2H2(g)
 =+75 kJ/mol
=+75 kJ/mol回答问题(1)~(3):
(1)已知:2CO(g)⇌CO2(g)+C(s)
 =-172 kJ/mol, 则
=-172 kJ/mol, 则 =
=(2)恒温恒容密闭容器中仅发生主反应,能说明反应达到平衡状态的是________.(填标号)
| A.容器内的压强不再变化 | B.c (CH4):c(CO2): c (CO): c (H2)=1:1:2:2 |
| C.混合气体的密度不再变化 | D.断开4molC-H键同时断开2molH-H键 |
| 时间/min 反应物 | 0 | 15 | 30 | 45 | 60 | 75 |
| n(CH4)/mol | 2.0 | 1.3 | 0.8 | 0.4 | 0.2 | 0.2 |
| n(CO2)/mol | 4.0 | 3.3 | 2.8 | 2.4 | 2.2 | 2.2 |
②主反应的平衡常数表达式为
③若在60min 时再充入2.0 mol CH4,达到新平衡后CH4的转化率减小,此时平衡常数K
④ 若相同条件下改为充入4.0 mol CH4和 8.0 mol CO2反应,平衡后CH4的转化率
(4)CO2催化加H2可以制备CH4,保持反应气中CO2与 H2的体积比为 1∶4,以40 mL·min-1的流速通过催化剂,甲烷化过程中,含碳产物CH4的物质的量百分数(Y)及CO2的转化率随温度的变化如图所示。320℃时CO2反应速率为

您最近一年使用:0次
2022-11-27更新
|
173次组卷
|
2卷引用:广东省佛山市南海区2022-2023学年高二上学期学业水平测试化学试题
2 . 回答下列问题:
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
已知:①CO(g)+H2O(g) CO2(g)+H2(g) △H1=-40.9kJ·mol-1
CO2(g)+H2(g) △H1=-40.9kJ·mol-1
②CO(g)+2H2(g) CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1
试计算制备反应的△H=____ 。
(2)对于反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
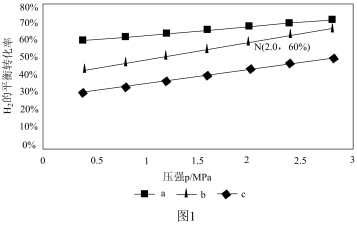
①比较a、b、c各曲线所表示的投料比大小顺序为____ (用字母表示)。
②点N在线b上,计算540K的压强平衡常数Kp=____ (用平衡分压计算)。
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=____ 。
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g) C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-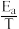 +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=____ kJ·mol-1。
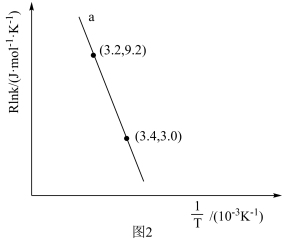
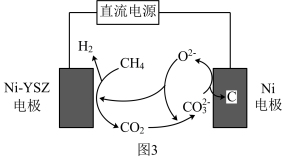
(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:____ 。
(1)一种工业制备甲醇的反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H已知:①CO(g)+H2O(g)
 CO2(g)+H2(g) △H1=-40.9kJ·mol-1
CO2(g)+H2(g) △H1=-40.9kJ·mol-1②CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4kJ·mol-1
CH3OH(g) △H2=-90.4kJ·mol-1试计算制备反应的△H=
(2)对于反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
CH3OH(g)+H2O(g),已知:v正=k正p(CO2)·p3(H2),v逆=k逆p(CH3OH)·p(H2O)。k正、k逆分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K,按初始投料比n(CO2):n(H2)=3:1、n(CO2):n(H2)=1:1、n(CO2):n(H2)=1:3,得到不同压强条件下H2的平衡转化率关系如图1:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻p(CO2)=0.2MPa,p(CH3OH)=p(H2O)=0.1MPa,p(H2)=0.4MPa,此时。v正:v逆=
(3)甲醇催化可制取丙烯的反应为:3CH3OH(g)
 C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-
C3H6(g)+3H2O(g),反应的Arrhenius经验公式的实验数据如图2中曲线a所示,已知Arrhenius经验公式为Rlnk=-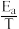 +C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
+C(Ea为活化能,k为速率常数,R和C为常数)。该反应的活化能Ea=
(4)甲烷蒸汽重整工业制氢面临着大量的“碳排放”,我国科技工作者发明了一种电化学分解甲烷的方法,其电化学反应原理如图3所示。请写出Ni-YSZ电极上发生的电极反应方程式:

您最近一年使用:0次
解题方法
3 . 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、材料等领域。
(1)基态钛原子的价电子排布式为_______ 。
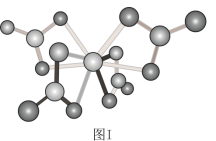
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是_______ ,试㝍出该反应的方程式_______ 。
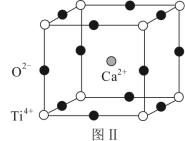
(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为_______ g。
(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


资料:TiCl4及所含杂质氯化物的性质
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式_______ 。
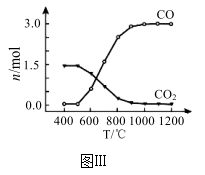
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H_______ 0(填“>”“<”或“=”),判断依据_______ 。
(1)基态钛原子的价电子排布式为
(2)钛可与高于70℃的浓硝酸发生反应,生成Ti(NO3)4.其球棍结构如图Ⅰ,Ti的配位数是

(3)钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ.设NA为阿伏加德罗常数的值,计算一个晶胞的质量为

(4)TiCl4是由钛精矿(主要成分为TiO2制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如图:


资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | -25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | — | 微溶 | 难溶 | |
TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-220.9kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
②氯化过程中CO和CO2可以相互转化,根据如图Ⅲ判断:CO2生成CO反应的△H

您最近一年使用:0次
2022-04-09更新
|
504次组卷
|
4卷引用:天津市2022届高三下学期普通高中学业水平等级性考试模拟预测化学试题
天津市2022届高三下学期普通高中学业水平等级性考试模拟预测化学试题天津市和平区2022届高三一模化学试题(已下线)2022年辽宁省高考真题变式题(16-19)(已下线)2022年辽宁高考真题化学试题变式题(原理综合题)
4 . 用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是_______________________________________________ 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是______ (填字母)。
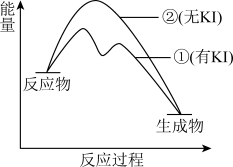
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I = H2O + IO
= H2O + IO 是放热反应
是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到___________________________________ ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ._________________________________________ 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是________________________ 。
(4)资料4:I + I
+ I
 I
I K= 640。
K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
① a =____________________ 。
② 该平衡体系中除了含有I 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是_____________________ 。
(1)资料1:KI在该反应中的作用:H2O2 + I
 = H2O + IO
= H2O + IO ;H2O2 + IO
;H2O2 + IO = H2O + O2↑+ I
= H2O + O2↑+ I 。总反应的化学方程式是
。总反应的化学方程式是(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是

a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I
 = H2O + IO
= H2O + IO 是放热反应
是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ.
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是
(4)资料4:I
 + I
+ I
 I
I K= 640。
K= 640。为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
| 微粒 | I | I | I |
| 浓度/ (mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
② 该平衡体系中除了含有I
 、I
、I 和I
和I 外,一定还含有其他含碘微粒,理由是
外,一定还含有其他含碘微粒,理由是
您最近一年使用:0次
2020-01-23更新
|
356次组卷
|
11卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
北京市2020普通高中学业水平考试等级性抽样测试化学试题北京师范大学附中2019-2020学年高二上学期期中考试化学试题2020年北京新高考试测化学试题湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练北京市海淀区清华大学附属中学2020届高三下学期统一测试化学试题(已下线)易错11 影响化学反应速率的因素-备战2021年高考化学一轮复习易错题内蒙古赤峰二中2021-2022学年高三上学期第一次月考化学试题北京市第十四中学2021-2022学年高二上学期期中考试化学试题(已下线)第20讲 化学反应速率(练)-2023年高考化学一轮复习讲练测(全国通用)浙江省嘉兴市第一中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 第40练 化学反应速率
名校
解题方法
5 . AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________ 。
Ⅱ.上述反应适宜的温度范围是______ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________ 、_________ 和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
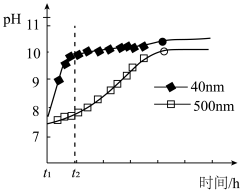
① AlN粉末水解的化学方程式是____________________________________ 。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________ 。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________ 。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是
Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:
 2AlN。
2AlN。③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。

① AlN粉末水解的化学方程式是
② 解释t1-t2时间内两条曲线差异的可能原因:
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近一年使用:0次
2020-01-23更新
|
325次组卷
|
4卷引用:北京市2020普通高中学业水平考试等级性抽样测试化学试题
6 . 偏二甲肼( )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。
(1)已知: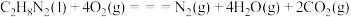



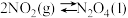

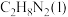 和
和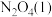 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)__________ 。该反应______ (填“是”或“不是”)自发反应,判断的理由是_______ 。
(2)肼( )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为_________________________________ 。
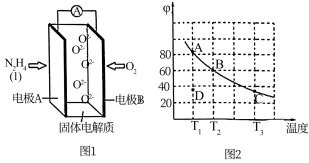
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g) 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数( )随温度的变化如图2所示
)随温度的变化如图2所示
①D点v(正)________ v(逆)(填“>”“=”或“<”)。
②A、B、C点中平衡常数K的值最大的是________ 点。 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为________ ;若达平衡时间为5 s,则此时间内的 平均反应速率为
平均反应速率为________ 。
③若其条件不变,在 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数________ (填“增大”“不变”或“减小”)。
 )、肼(
)、肼( )和四氧化二氧(
)和四氧化二氧( )可作为运载火箭的推进剂。
)可作为运载火箭的推进剂。(1)已知:
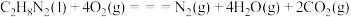



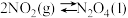

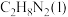 和
和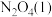 反应生成
反应生成 、
、 和
和 并放出大量热,写出该反应的热化学方程式(
并放出大量热,写出该反应的热化学方程式( 用含
用含 、
、 、
、 的代数式表示)
的代数式表示)(2)肼(
 )也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
)也可用于新型环保燃料电池中,燃料电池的工作原理示意图如图1所示,该燃料电池的负极反应式为
(3)将4molN2O4放入2 L,恒容密闭容器中发生反应N2O4(g)
 2NO2(g),平衡体系中N2O4的体积分数(
2NO2(g),平衡体系中N2O4的体积分数( )随温度的变化如图2所示
)随温度的变化如图2所示①D点v(正)
②A、B、C点中平衡常数K的值最大的是
 时,N2O4的平衡转化率为
时,N2O4的平衡转化率为 平均反应速率为
平均反应速率为③若其条件不变,在
 原平衡基础上,再加入一定量
原平衡基础上,再加入一定量 ,达到新平衡时,与原平衡相比,NO2的体积分数
,达到新平衡时,与原平衡相比,NO2的体积分数
您最近一年使用:0次
2020-01-10更新
|
429次组卷
|
5卷引用:2020年天津市学业水平等级考适应性测试化学试题
2014高三·全国·专题练习
名校
解题方法
7 . 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为_________________________________ 。
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
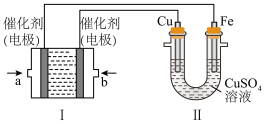
①a处应通入________ (填“CH4”或“O2”),b处电极上发生的电极反应式是__________________________________ 。
②电镀结束后,装置Ⅰ中溶液的pH________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________ 。
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________ (忽略水解)。
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________ L(标准状况下)。
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g)
ΔH=-566 kJ·mol-1。
则CH4与O2反应生成CO和H2的热化学方程式为
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。

①a处应通入
②电镀结束后,装置Ⅰ中溶液的pH
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷
您最近一年使用:0次
2018-10-02更新
|
348次组卷
|
10卷引用:2014年高中化学苏教版选修四模块综合检测练习卷
(已下线)2014年高中化学苏教版选修四模块综合检测练习卷(已下线)2014年高中化学二轮创新训练上 专题8电化学原理练习卷2015-2016学年湖北孝感高级中学高二上期中测试化学试卷2015-2016学年福建师大附中高二下期中化学试卷河北省蠡县中学2018-2019学年高二上学期第一次(8月)月考化学试题河北省保定市蠡县中学2018-2019学年高二上学期9月月考化学试题贵州省三都水族自治县高级中学2019-2020学年高三上学期期末考试理综化学试题福建省莆田市仙游县枫亭中学2019-2020学年高二上学期期中考试(选考)化学试题河北省邯郸市永年区第一中学2020-2021学年高二上学期10月月考化学试题山东省威海市第二中学2023-2024学年高二上学期第一次月考(实验班)化学试题
名校
解题方法
8 . “低碳经济”正成为科学家研究的主要课题,为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为_______ mol。
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=__________ 。
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
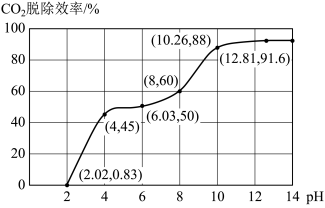
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为____________ (精确到0.01)。
②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是______________ 。
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:
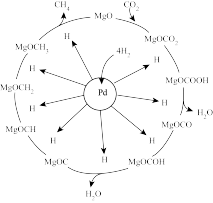
① 该反应的化学方程式为________________ ;反应过程中碳元素的化合价为-2价的中间体是_________ 。
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为_________________ ;300℃时上述反应的平衡常数K=___________________ 。
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是________ (填字母):
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
(1)有科学家提出可利用FeO吸收和利用CO2,相关热化学方程式如下:
6FeO(s)+CO2(g)=2Fe3O4(s)+C(s) ΔH=-76.0kJ·mol-1
①上述反应中每生成1molFe3O4,转移电子的物质的量为
②已知:C(s)+2H2O(g)=CO2(g)+2H2(g) △H=+113.4kJ·mol-1,则反应:3FeO(s)+H2O(g)=Fe3O4(s)+H2(g)的△H=
(2)用氨水捕集烟气中的CO2生成铵盐是减少CO2排放的可行措施之一。
①分别用不同pH的吸收剂吸收烟气中的CO2,CO2脱除效率与吸收剂的pH关系如图所示,若烟气中CO2的含量(体积分数)为12%,烟气通入氨水的流量为0.052 m3·h-1(标准状况),用pH为12.81的氨水吸收烟气30min,脱除的CO2的物质的量最多为

②通常情况下温度升高,CO2脱除效率提高,但高于40℃时,脱除CO2效率降低的主要原因是
(3)一定条件下,Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,回答下列问题:

① 该反应的化学方程式为
② 向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1、H2:0.8mol·L-1、CH4:0.8mol·L-1、H2O:1.6mol·L-1,CO2的平衡转化率为
③已知该反应正反应放热,现有两个相同恒容绝热(与外界无热量交换)密闭容器Ⅰ、Ⅱ,在Ⅰ中充入1molCO2和4molH2,在Ⅱ中充入1molCH4和2molH2O(g),300℃下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅱ中CH4的物质的量分数相同
C.容器Ⅰ中CO2的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO2的转化率与容器Ⅱ中CH4的转化率之和小于1。
您最近一年使用:0次
2018-04-13更新
|
367次组卷
|
3卷引用:2017-2018学年人教版选修4化学平衡之平衡状态的判断习题专项训练题



